Espectrometría de masas
A espectrometría de masas ou espectrometría de masa[1] (abreviada EM e na literatura inglesa, MS) é unha técnica analítica que se usa para medir a razón masa-carga de ións. Os resultados preséntanse como un espectro de masas, un gráfico da intensidade en función da razón masa-carga. A espectrometría de masas utilízase en moitos campos da ciencia e aplícase a mostras puras ou a mesturas complexas.
Un espectro de masas é un tipo de gráfico do sinal dos ións en función da razón masa-carga. Estes espectros úsanse para determinar a sinatura isotópica ou elemental dunha mostra, así como as masas de partículas e moléculas e para dilucidar a identidade química ou estrutura de moléculas e outros compostos químicos.
Nun procedemento típico de espectrometría de masas, unha mostra, que pode ser sólida, líquida ou gasosa, é ionizada, por exemplo bombardeándoa cun feixe de electróns. Isto pode causar que algunhas das moléculas da mostra rompan en fragmentos cargados positivamente ou simplemente queden cargadas positivamente sen se fragmentar. Estes ións (fragmentos) son despois separados de acordo coa súa razón masa-carga, por exemplo ao aceleralos e sometelos a un campo magnético ou eléctrico: os ións da mesma razón masa-carga sofren a mesma cantidade de desviación.[2] Os ións detéctanse por un mecanismo que pode detectar partículas cargadas, como un multiplicador de electróns. Os resultados móstranse como espectros da intensidade do sinal dos ións detectados en función da razón masa-carga. Os átomos ou moléculas da mostra poden ser identificados correlacionando as masas coñecidas (por exemplo, unha molécula enteira) para identificar masas ou por un padrón de fragmentación característico.
Historia da espectrometría de masas
[editar | editar a fonte]
En 1886, Eugen Goldstein observou os raios dunhas descargas de gas a baixa presión que viaxaban desde o ánodo e a través de canles nun cátodo perforado, en dirección oposta á dos raios catódicos cargados negativamente (que viaxan do cátodo ao ánodo). Goldstein chamou a estes raios anódicos cargados positivamente "Kanalstrahlen"; a tradución habitual deste termo é "raios canais". Wilhelm Wien atopou que fortes campos eléctricos ou magnéticos deflectaban os raios canais e, en 1899, construíu un aparello con campos magnéticos e eléctricos perpendiculares que separaba os raios positivos de acordo coa súa razón carga-masa (Q/m). Wien atopou que a razón carga-masa dependía da natureza do gas no tubo de descarga. O científico inglés J. J. Thomson mellorou posteriormente o traballo de Wien ao reducir a presión para crear o espectrógrafo de masas.

A palabra espectrógrafo pasou a formar parte do vocabulario científico internacional en 1884.[3][4] Os primeiros aparellos de espectrometría que medían a razón masa-carga de ións denomináronse especrógrafos de masas, que consistían en instrumentos que rexistraban un espectro de valores de masas nunha placa fotográfica.[5][6] Un espectroscopio de masas é similar a un espectrógrafo de masas excepto en que o feixe de ións se dirixe a unha pantalla fosforescente.[7] A configuración dun espectroscopio de masas utilizouse nos primeiros instrumentos cando se desexaba que os efectos dos axustes se observasen rapidamente. Unha vez que o instrumento era debidamente axustado, inseríase e expoñíase unha placa fotográfica. O termo espectroscopio de masas continuou usándose incluso a pesar de que a iluminación directa dunha pantalla fosforescente foi substituída por medidas indirectas feitas cun osciloscopio.[8] O uso do termo espectroscopia de masas agora é desaconsellado debido á posible confusión coa espectroscopia de luz.[2][9] A espectrometría de masas abréviase miúdo como EM ou MS (do inglés mass-spec ou mass spectrometry).[2]
As técnicas modernas da espectrometría de masas foron ideados por Arthur Jeffrey Dempster e F.W. Aston en 1918 e 1919, respectivamente.
Os espectrómetros de masas de sector coñecidos como calutróns desenvolveunos Ernest O. Lawrence e usáronse para separar os isótopos do uranio durante o Proxecto Manhattan.[10] Os espectrómetros de masa calutrón utilizáronse para o enriquecemento do uranio na planta Y-12 de Oak Ridge, Tennessee creada durante a segunda guerra mundial.
En 1989, unha metade do Premio Nobel de Física concedéuselles a Hans Dehmelt e Wolfgang Paul polo desenvolvemento da técnica da trampa nas décadas de 1950 e 1960.
En 2002 o Premio Nobel de Química recibírono John Bennett Fenn polo desenvolvemento da ionización electrospray (ESI, do inglés electrospray ionization ) e Koichi Tanaka polo desenvolvemento da desorción láser suave (SLD, do inglés soft laser desorption ) e a súa aplicación á ionización de macromoléculas biolóxicas, especialmente proteínas.[11]
Partes dun espectrómetro de masas
[editar | editar a fonte]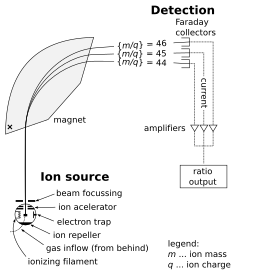
Un espectrómetro de masas consta de tres compoñentes: unha fonte de ións, un analizador de masas e un detector. O ionizador converte unha porción da mostra en ións. Hai unha ampla variedade de técnicas de ionización, dependendo da fase (sólida, líquida ou gasosa) da mostra e a eficiencia de varios mecanismos de ionización para especies descoñecidas. Un sistema de extracción quita os ións da mostra, os cales son despois dirixidos a través do analizador de masas e ao detector. As diferenzas en masa dos fragmentos permiten que o analizador de masas clasifique os ións pola súa razón masa-carga. O detector mide o valor dunha cantidade indicadora e así proporciona datos para calcular as abundancias de cada ión presente. Algúns detectores tamén dan información espacial, por exemplo, unha placa multicanle.
Exemplo teórico
[editar | editar a fonte]Seguidamente, descríbese a operación dun analizador de espectrómetro de masas, que é de tipo sector. (Outros tipos de analizadores trátanse máis abaixo). Consideremos unha mostra de cloruro de sodio (sal de mesa). Na fonte de ións a mostra é vaporizada (pasa ao estdo gasoso) e ionizada (transformada en partículas cargadas electricamente) formando ións sodio (Na+) e cloruro (Cl−). Os átomos de sodio e os seus ións son monoisotópicos, cunha masa de 23 daltons (úsase o símbolo Da ou o símbolo antigo u). Os átomos e ións de cloruro poden aparecer como dous isótopos estables con masas de aproximadamente 35 u (cunha abundacnia natural do 75 %) e de 37 u (cunha abundancia natural do 25 %). A parte correspondente ao analizador do espectrómetro contén campos eléctricos e magnéticos, que exercen forzas sobre os ións que viaxan a través deles. A velocidade dunha partícula cargada pode ser incrementada ou diminuída mentres pasan a través do campo eléctrico, e a súa dirección pode ser alterada polo campo magnético. A magnitude da deflexión da taxectoria dos ións en movemento depende da súa razón masa-carga. Os ións máis lixeiros son desviados pola forza magnética a un maior grao que os máis pesados (baseándose na segunda lei de Newton do movemento, F = ma). As correntes de ións clasificados magneticamente pasan desde o analizador ao detector, o cal rexistra a abundancia relativa de cada tipo de ión. Esta información utilízase para determinar a composición en elementos químicos da mostra orixinal (é dicir, que están presentes na mostra tanto o sodio coma o cloro) e a composición isotópica dos seus constituíntes (a razón de 35Cl respecto a 37Cl).
Creación de ións
[editar | editar a fonte]
A fonte de ións é a parte do espectrómetro de masas que ioniza o material sometido a análise (o analito). Os ións son despois transportados por campos magnéticos ou eléctricos ao analizador de masas.
As técnicas de ionización foron claves para determinar que tipos de mostras se poden analizar por espectrometría de masas. A ionización de electróns e a ionización química utilízanse para gases e vapores. Nas fontes de ionización química, o analito é ionizado por reaccións ión-molécula químicas durante as colisións na fonte. Dúas técnicas que se utilizan con frecuencia con mostras biolóxicas líquidas ou sólidas son a ionización electrospray (inventada por John Fenn[12]) e a desorción/ionización láser asistida por matriz (MALDI, desenvolvida inicialmente como unha técnica similar chamada "desorción láser suave ou SLD" por K. Tanaka,[13] pola cal se concedeu un Premio Nobel, e como MALDI por M. Karas e F. Hillenkamp[14]).
Ionizacións dura e suave
[editar | editar a fonte]
Na espectrometría de masas, ionización refírese á produción de ións da fase de gas axeitados para a resolución no analizador de masas ou filtro de masas. A ionización ocorre na fonte de ións. Hai varias fontes de ións dispoñibles; cada unha delas ten vantaxes e desvantaxes para determinadas aplicacións. Por exemplo, a ionización elecrónica (EI) proporciona un alto grao de fragmentación, creando espectros de masas moi detallados que, cando se analizan apropiadamente, poden darnos información importante para a dilucidación/caracterización estrutural e facilitan a identificación de compostos descoñecidos comparándoos con bibliotecas de espectros de masas obtidas en condicións operativas idénticas. Porén, a EI non é axeitada para acoplarse coa cromatografía líquida de alto rendemento (HPLC), é dicir, a LC-MS, xa que á presión atmosférica, os filamentos usados para xerar electróns arden rapidamente. Así, a EI acóplase predominantemente coa cromatografía de gas (GC), é dicir, GC-MS, na cal o sistema completo está nun alto baleiro.
As técnicas de ionización dura son procesos que aplican grande cantidade de enerxía residual na molécula suxeito orixinando un alto grao de fragmentación (é dicir, a rotura sistemática de enlaces actúa eliminando o exceso de enerxía, restaurando a estabilidade do ión resultante). Os ións orixinados adoitan ter un m/z máis baixo que o ión molecular (á parte de no caso de transferencia de protóns e non incluíndo picos isotópicos). O exemplo máis común de ionización dura é a ionización electrónica (EI).
A ionización suave refírese aos procesos nos que se aplica pouca enerxía residual na molécula suxeito e como resultado hai pouca fragmentación. Exemplos son o bombardeo atómico rápido (FAB), a ionización química (CI), a ionización química a presión atmosférica (APCI), a fotoionización a presión atmosférica (APPI), a ionización electrospray (ESI), a ionización electrospray de desorción (DESI), e a ionización/desorción láser asistida por matriz (MALDI).
Plasma acoplado indutivamente
[editar | editar a fonte]
As fontes de plasma acoplado indutivamente (ICP) utilízanse principalmente para a análise de catións dunha ampla gama de tipos de mostras. Nesta fonte, utilízase un plasma que é en conxunto neutro electricamente, pero que ten unha fracción substancial dos seus átomos ionizados por altas temperaturas, para atomizar as moléculas da mostra introducida e para arrancar máis electróns externos deses átomos. O plasma xérase habitualmente a partir de gas argon, xa que a primeira enerxía de ionización de átomos de argon é maior que a primeira enerxía de ionización de calquera outro elemento excepto o He, F e o Ne, pero máis baixa que a segunda enerxía de ionización de todos excepto os metais máis electropositivos. O quentamento conséguese por correntes de radio-frecuencias que pasan a través dunha bobina que rodea o plasma.
Espectrometría de masas de fotoionización
[editar | editar a fonte]A fotoionización pode utilizarse en experimentos que pretenden usar a espectrometría de masas como medio para resolver os mecanismos cinéticos químicos e a ramificación de produtos isómeros.[15] En tales exemplos, utilízase un fotón de alta enerxía, dunha fonte de raios X ou UV, para disociar moléculas gasosas estables nun gas transportador de He ou Ar. En casos nos que se utiliza unha fonte de luz sincrotrón, pode usarse unha enerxía de fotón axustable para adquirir unha curva de eficiencia de fotoionización que pode usarse xunto coa razón de carga m/z para obter a pegada dactilar de especies moleculares e iónicas. Máis recentemente, desenvolveuse a fotoionización a presión atmosférica (APPI) para ionizar moléculas principalmente como efluentes de sistemas LC-MS.
Ionización do ambiente
[editar | editar a fonte]Algunhas aplicacións para a ionización do ambiente son aplicacións medioambientais e clínicas. Nestas técnicas, fórmanse ións nunha fonte de ións fóra do espectrómetro de masas. A obtención de mostras é máis fácil, xa que estas non necesitan unha previa separación ou preparación. Algúns exemplos de técnicas de ionización do ambiente son a Análise Directa en Tempo Real (DART), a DESI, a SESI, a LAESI, a ionización química a presión atmosférica de desorción (DAPCI), e a fotoionización a presión atmosférica de desorción DAPPI, entre outras.
Outras técnicas de ionización
[editar | editar a fonte]Outras técnicas son a descarga luminescente, a desorción de campo (FD), o bombardeo atómico rápido (FAB), o termospray, a desorción/ionización en silicio (DIOS), a ionización química a presión atmosférica (APCI), a espectrometría de masas de ións secundarios (SIMS), a ionización de chispas e a ionización térmica (TIMS).[16]
Selección de masas
[editar | editar a fonte]Os analizadores de masas separan os ións segundo a súa razón masa-carga. As seguintes dúas leis gobernan a dinámicas das partículas cargadas en campos eléctricos e magnéticos no baleiro:
- (segunda lei de Newton do movemento nun caso non relativista, é dicir, válida só a unha velocidade dos ións moito máis baixa que a velocidade da luz).
Aquí F é a forza aplicada ao ión, m é a masa do ión, a é a aceleración, Q é a carga iónica, E é un campo elécrico, e v × B é o produto vectorial da velocidade do ión polo campo magnético
Creando unha ecuación coas expresións anteriores para a forza aplicada ao ión obtemos:
Esta ecuación é a clásica ecuación do movemento para partículas cargadas. Xunto coas condicións iniciais da partícula, determina completamente o movemento da partícula no espazo e o tempo en termos de m/Q. Así, os espectrómetros de masas poderían considerarse como "espectrómetrs de masa respecto á carga". Cando se presentan os datos, é común usar m/z adimensionais (oficialmente), onde z é o número de cargas elementais (e) no ión (z=Q/e). Esta cantidade, aínda que se chama informalmente razón masa-carga, falando con máis precisión representa a razón do número másico e do número de carga, z.
Hai moitos tipos de analizadores de masas, que usan tanto campos estáticos coma dinámicos, e campos magnéticos ou elécricos, pero todos operan segundo a ecuación anterior. Cada tipo de analizador ten as súas vantaxes e inconvenientes. Moitos espectrómedtros de masas usan dous ou máis analizadores para a espectrometría de masas en tándem (MS/MS). Ademais dos analizadores de masas máis común da listaxe de máis abaixo, hai outros deseñados para situacións especiais.
Hai varias características que son importantes nos analizadores. O poder de resolución de masas é a medida da capacidade de distinguir dous picos con m/z lixeiramente diferente. A exactitude da masa é o erro da medida da razón m/z respecto do verdadeiro m/z. A exactitude da masa mídese xeralmente en partes por millón (ppm) ou mili unidades de masa (mmu). O rango de masas é o rango de m/z que se pode analizar cun determinado analizador. O rango dinámico liñal é o rango no cal o sinal iónico é liñal coa concentración de analito. A velocidade refírese ao marco de tempo do experimento e basicamente utilízase para determinar o número de espectros por unidade de tempo que se poden xerar.
Instrumentos de sector
[editar | editar a fonte]
Un analizador de masas de campo de sector usa un campo eléctrico e/ou magnético estático que afecta dalgunha maneira o camiño e/ou a velocidade das partículas cargadas. Como se sinalou anteriormente, os instrumentos de sector curvan as traxectorias dos ións a medida que pasan polo analizador de masas, segundo as súas razóns de masa-carga, desviando máis os ións máis lixeiros, máis cargados e que se moven máis rápido. O analizador pode utilizarse para seleccionar un estreito rango de m/z ou para escanear un rango de m/z para catalogar os ións presentes.[17]
Tempo de voo
[editar | editar a fonte]O analizador de tempo de voo (TOF) usa un campo eléctrico para acelerar os ións nun mesmo potential, e entón mide o tempo que tardan en chegar ao detector. Se as partículas teñen todas a mesma carga, a súa enerxía cinética será idéntica e a súa velocidade dependerá soamente da súa masa. Os ións cunha masa máis baixa chegarán antes ao detector. Se os ións non empezan con enerxías cinéticas idénticas, entón algúns ións poden quedar atrasados respecto dos ións de maior enerxía cinética, diminuíndo a resolución. Empréganse habitualmente as xeometrías de reflexión para corrixir este problema.[18] Porén, en realidade, mesmo as partículas coa mesma m/z poden chegar en diferentes momentos ao detector, porque teñen dierentes velocidades iniciais. A velocidade inicial adoita depender da masa do ión, e convértese nunha diferenza na velocidade final. Debido a isto, os ións coa mesma razón m/z chegarán ao detector en diversos momentos, o cal fai máis anchos os picos mostrados no gráfico de reconto fronte a m/z, pero xeralmente non cambian a localización central dos picos, xa que a velocidsde inicial dos ións está xeralmente centrada a cero. Para solucionar este poblema, acoplouse o enfoque de retardo temporal/extracción retardada coa TOF-MS.[19] (Ver espectrometría de masas de tempo de voo).
Filtro de masas cuadrupolo
[editar | editar a fonte]O analizador de masas cuadrupolo usa campos eléctricos oscilantes para estabilizar ou desestabilizsar selectivamente os camiños dos ións que pasan a través dun campo cuadrupolo de radio-frecuencia (RF) creado entre catro barras paralelas. Soamente os ións nun certo rango de razón masa/carga pasan a través do sistema en calquera momento dado, pero os cambios nos potenciais nas barras permiten que sexan varridos rapidamente un amplo rango de valores m/z, sexa continuamente ou nunha sucesión de saltos discretos. Un analizador de masas cuadrupolo actúa como un filtro selectivo para a masa e está estreitamente relacionado coa trampa iónica cuadrupolo, particularmente coa trampa iónica cuadrupolo liñal, excepto que está deseñado para que pasen os ións non atrapados en vez de recoller os atrapados, e por iso recibe o nome de cuadrupolo de transmisión. Un analizador de masas cuadrupolo potenciado magneticamente inclúe a adición dun campo magnético, tanto aplicado axialmente coma transversalmente. Este novo tipo de instrumento leva a unha mellora de rendemento adicional en canto á resolución e/ou sensibilidade dependendo da magnitude e orientación do campo magnético aplicado.[20][21] Unha variación común do cuadrupolo de transmisión é o espectrómetro de masa de cuadrupolo triplo. O "triple quad" (triplo cuadrupolo) ten tres estadios cuadrupolo consecutivos, o primeiro deles actúa como un filtro de masas para transmitir un determinado ión entrante ao segundo cuadrupolo, que é unha cámara de colisión, onde o ión pode romper en fragmentos. O terceiro cuadrupolo tamén actúa como un filtro de masas, para transmitir un fragmento iónico particular ao detector. Se o cuadrupolo está feito para facer ciclos rápidos e repetitivos nun rango de axustes de filtro de masa, pode obterse un espectro completo. Igualmente, pode facerse un "triple quad" para realizar varios tipos de escaneamento característicos da espectrometría de masas en tándem.
Trampas iónicas
[editar | editar a fonte]Trampa iónica cuadrupolo tridimensional
[editar | editar a fonte]A trampa iónica cuadrupolo funciona cos mesmos principios físicos que o analizador de masas cuadrupolo, pero os ións son atrapados e exectados secuencialmente. Os ións son atrapados nun campo de radio-frecuencia (RF) principalmente cuadrupolo, nun espazo definido por un eléctrodo anular (usualmente conectado ao potencial RF principal) entre dous eléctrodos endcap ou de tapa de extremo (normalmente conectados a potenciais de corrente continua ou de corrente alterna auxiliar). A mostra ionízase internamente (por exemplo cun feixe de electróns ou láser) ou externamente, e nese caso os ións introdúcense a miúdo a traves da apertura dun eléctrodo endcap.
Hai moitos métodos de separación masa/carga e illamento pero o que se usa máis habitualmente é o modo de inestabilidade de masa no cal o potencial RF se aumenta para que as órbitas dos ións con masa a > b sexan estables, mentres que os ións con masa b se fagan inestables e sexan exectados polo eixe z ao detector. Hai tamén métodos de análise non destrutivos.
Os ións poden tamén ser exectdos polo método de excitación de resonancia, por medio do cal se aplica unha voltaxe de excitaciónn oscilatoria suplementaria aos eléctrodos endcap, e a amplitude de voltaxe de atrapamento e/ou a frecuencia da voltaxe de excitación faise variar para trer os ións a unha condición de resonancia en orde ás súas razóns masa/carga.[22][23]
Trampa iónica cilíndrica
[editar | editar a fonte]O espectrómetro de masas de trampa iónica cilíndrica (CIT) é un derivado da trampa iónica cuadrupolo no cal os eléctrodos están formados por aneis planos en vez de por eléctrodos de forma hiperbólica. A arquitectura permite unha fácil miniaturización porque como o tamaño da trampa é reducido, a forma do campo eléctrico preto do centro da trampa, que é a rexión onde están atrapados os ións, toma unha forma similar á dunha trampa hiperbólica.
Trampa iónica cuadrupolo liñal
[editar | editar a fonte]Unha trampa iónica cuadrupolo liñal é similar a unha trampa iónica cuadrupolo, pero atrapa ións nun campo cuadrupolo bidimensional en vez de facelo nun campo cuadrupolo tridimensional como nas trampas iónicas cuadrupolo 3D. O LTQ (do inglés linear trap quadrupole, cuadrupolo de trampa liñal) de Thermo Fisher é un exemplo de trampa iónica liñal.[24]
Unha trampa iónica toroidal pode considerarse como un cuadrupolo liñal curvado e conectado nos extremos ou como unha sección transversal dunha trampa iónica 3D rotada sobre o bordo para formar un toroide (trampa con forma de donut). A trampa pode almacenar grandes volumes de ións distribuíndoos pola estrutura de forma anular da trampa. Esta trampa de forma toroidal é unha configuración que permite un aumento da miniaturización dun analizador de masa de trampa iónica. Ademais, todos os ións se almacenan no mesmo campo atrapador e son exectados xuntos simplificando a detección, a cal pode ser complicada con configuracións en matriz (array) debido a variacións no aliñamento do detector e á fabricación das matrices.[25]
Igual que as trampas toroidais, as tampas liñais e as trampas de cuadrupolo 3D son os analizadores de masas que se miniaturizan máis habitualmente debido á súa alta sensibilidade, tolerancia a presións de mTorr e capacidades para a espectrometría de masas en tándem de analizador simple (por exemplo, escaneamento de ións de produtos).[26]
Orbitrap
[editar | editar a fonte]
Os instrumentos Orbitrap son similares a espectrómetros de masas de resonancia de ciclotrón de ións de transformada de Fourier (ver texto máis abaixo). Os ións están atrapados electrostaticamente nunha órbita arredor dun eléctrodo fusiforme central. O eléctrodo confina os ións para que orbiten aredor do eléctrodo central e oscilen adiante e atrás ao longo do eixe longo do eléctrodo central. Esta oscilación xera unha corrente imaxe nas placas do detector que o instrumento rexistra. As fecuencias destas correntes imaxe dependen das razóns masa-carga dos ións. Os espectros de masa obtéñense pola transformada de Fourier das correntes imaxe rexistradas.
Os Orbitraps teñen unha alta exactitude de masa, alta sensibilidade e un bo rango dinámico.[27]
Resonancia de ciclotrón de ións de transformada de Fourier
[editar | editar a fonte]
A espectrometría de masas de transformada de Fourier (FTMS), ou de xeito máis preciso espectrometía de masas de resonancia de ciclotrón de ións de transformada de Fourier, mide a masa ao detectar a corrente imaxe producida polos ións que "ciclotronan" en presenza dun campo magnético. En lugar de medir a deflexión de ións cun detector de ións como un multiplicador de electróns, os ións son inxectados nunha trampa Penning (unha trampa de ións eléctrica/magnética estática) onde forman parte dun circuíto. Os detectores que están situados en posicións fixas no espazo miden o sinal eléctrico dos ións que pasan preto deles co paso do tempo, producindo un sinal periódico. Como a frecuencia do ciclado dun ión se dedtermina pola súa razón masa-carga, isto pode ser deconvolucionado realizando unha transformada de Fourier do sinal. A FTMS ten a vantaxe da súa alta sensibilidade (xa que "se conta" cada ión máis dunha vez) e moita maior resolución e, polo tanto, precisión.[28][29]
A resonancia de ciclotrón de ións (ICR) é unha técnica de análise de masa máis vella similar á FTMS agás en que os ións se detectan cun detector tradicional. Os ións atrapados nunha trampa Penning son excitados por un campo elécrico de radio-frecuencia (RF) ata que impactan contra a parede da trampa, onde se localiza o detector. Os ións de diferentes masas resólvense de acordo co tempo de impacto.
Detectores
[editar | editar a fonte]
O elemento final do espectrómetro de masas é o detector. O detector rexistra a carga inducida ou a corrente producida cando pasa un ión ou golpea a súa superficie. Nun instrumento de escaneamento, o sinal producido no detector durante o curso do escaneamento confrontado con onde está o instrumento no escaneamento (a que m/Q) produce un espectro de masas, un rexistro de ións en función de m/Q.
Normalmente, úsanse algúns tipos de multiplicadores de electróns, aínda que tamén se usan outros detectores como as copas de Faraday e os detectores ión-fotón. Como o número de ións que abandonan o analizador de masas nun determinado momento é normalmente bastante pequeno, adoita ser necesaria unha considerable amplificación para conseguir un sinal. Nos instrumentos comerciais modernos úsanse comunmente detectores de placas microcanle.[30] Na FTMS e nos Orbitraps, o detector consiste nun par de superficies de metal dentro da rexión do analizador de masas/trampa de ións das cales os ións só pasan preto a medida que oscilan. Non se produce corrente continua, senón só unha feble corrente imaxe de corrente alterna nun circuíto entre os eléctrodos. Tamén se teñen utilizado outros detectores indutivos.[31]
Espectrometría de masas en tándem
[editar | editar a fonte]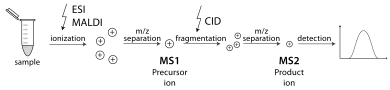
Un espectrómetro de masas en tándem é aquel que pode realizar múltiples roldas de espectrometría de masas, usualmente separadas por algunha forma de fragmentación da molécula. Por exemplo, un analizador de masas pode illar un péptido de entre moitos que entren no espectrómetro de masas. Unha cela de colisión estabiliza despois os ións do péptido mentres coliden cun gas, causando que se fragmenten por disociación inducida por colisión (CID). Un analizador de masas adicional clasifica despois os fragmentos producidos a partir dos péptidos. A espectrometría de masas en tándem pode facerse tamén nun analizador de masas único a medida que pasa o tempo, como na trampa iónica cuadrupolo. Hai varios métodos para a fragmentación de moléculas para a espectrometría de masas en tándem, como a disociación inducida por colisión (CID), a disociación de captura de electróns (ECD), a disociación de transferencia de electróns (ETD), a disociación multifotón infravermello (IRMPD), a disociación radiativa infravermella de corpo negro (BIRD), a disociación de separación de electróns (EDD) e a disociación inducida por superficie (SID). Unha importante aplicación que usa a espectrometría de masas en tándem é a identificación de proteínas.[32]
A espectrometría de masas en tándem permite diversas secuencias experimentais. Moitos espectrómetros de masas comerciais deséñanse para unha execución rápida de secuencias de rutina como a monitorización de reaccións seleccionadas (SRM), escaneamento de ións precursores, escaneamento de ións de produtos e escaneamento de perda neutra.[33]
- Na SRM, o primeiro analizador permite pasar unha soa masa e o segundo analizador monitoriza ións de fragmentos definidos para múltiples usuarios en tempos de morada (dwell-times) máis longos que os que poderían conseguirse nun escaneamento completo. Isto incrementa a sensibilidade.
- En escaneamentos de ións de produtos, o primeiro analizador de masas fíxase para seleccionar un determinado ión precursor ("parental"), mentres que o segundo escanéase para topar todos os fragmentos ("produtos", ou "ións fillos") nos cales pode ser fragmentado na cela de colisión.
- Nos escaneamentos de ións precursores, o segundo analizador de masas fíxase para seleccionar un determinado ión de fragmento ("fillo"), mentres que o primeiro é escaneado para atopar todos os posibles ións precursores que poderían dar lugar a este fragmento.
- Nos escaneamentos de perda neutra, os dous analizadores de masas escanéanse en paralelo, pero separados pola masa dunha subunidade molecular de interese para o analista. Os ións detéctanse se perden esa masa fixada durante a fragmentación. Isto pode utilizarse para buscar calquera composto químico que teña a capacidade de perder un determinado grupo neutro, por exemplo un residuo de azucre. A perda neutra e os escaneamentos de ión precursor usados xuntos poden servir para atopar compostos químicos que presenten motivos moleculares determinados.
Outro tipo de espectrometría de masas en tándem usado para a datación de radiocarbono é a espectrometría de masas con acelerador (AMS), que utiliza voltaxes moi altas, xeralmente no rango dos megavolts, para acelerar ións negativos nun tipo de espectrómetro de masas en tándem.
A METLIN Metabolite and Chemical Entity Database (Base de Datos de Entidades Químicas e Metabolitos METLIN)[34][35][36] é o maior repositorio de datos de espectrometría de masas en tándem experimental adquiridos a partir de estándares. Proporciónanse os datos de espectrometría de masas en tándem sobre uns 850.000 estándares moleculares (que había o 24 de agosto de 2020)[34] para facilitar a identificación de entidades químicas a partir de experimentos de especrometría de masas en tándem. Ademais de para a identificación de moléculas coñecidas, tamén é útil para identificar as descoñecidas usando a súa busca/análise de similitude.[37] Todos os datos de espectrometría de masas en tándem proceden de análises experimentais de estándares a múltiples enerxías de colisión e tanto en modos de ionización positivos coma negativos.[34]
Configuracións e técnicas comúns con espectrómetro de masas
[editar | editar a fonte]Cando unha combinación específica de fonte, analizador e detector se fai convencional na práctica, adoita orixinarse un acrónimo para designalo sucintamente, as máis das veces usado na súa forma en inglés. Un exemplo é MALDI-TOF, que é unha combinación dunha fonte de ionización/desorción láser asistida por matriz cun analizador de masas de tempo de voo. Outros exemplos son: plasma acoplado indutivamente-espectrometría de masas (ICP-MS), especrometría de masas con acelerador (AMS), ionización térmica-espectrometría de masas (TIMS) e espectrometría de masas de fonte de chispa (SSMS).
Certas aplicacións da espectrometría de masas desenvolveron alias que, aínda que falando estritamente parecerían referirse a unha aplicación ampla, na práctica acabaron por connotar un número específico ou limitado de configuracións de instrumentos. Un exemplo disto é a espectrometría de masas de razón isotópica (IRMS), que se refire na práctica ao uso dun limitado número de analizadores de masas baseados en sectores; este nome úsase para indicar tanto a aplicación coma o instrumento usado para a aplicación.
Técnicas de separación combinadas con espectrometría de masas
[editar | editar a fonte]Unha importante mellora para resolver a masa e a determinación das capsacidades da espectometía de masas é usala en tándem con técnicas cromatográficas e outras técnicas de separación.
Cromatografía de gases
[editar | editar a fonte]
Unha combinación común é a cromatografía de gases-espectrometría de masas (GC/MS ou GC-MS). Nesta técnica, utilízase unha cromatografía de gases para separar compostos diferentes. Esta corrente de compostos separados é facilitada en liña á fonte de ións, un filamento metálico ao que se aplica voltaxe. Este filamento emite electróns que ionizan os compostos. Os ións poden despois fragmentarse máis, dando padróns predicibles. Os ións intactos e os fragmentos pasan ao analizador do espectrómetro de masas e son finalmente detectados.[38] Porén, as altas temperaturas (300 °C) usadas no porto (e forno) de inxección da GC-MS poden resultar nunha degradación térmica das moléculas inxectadas, facendo que se midan os produtos de degradación en vez da(s) verdadeira(s) molécula(s) que interesa(n).[39]
Cromatografía líquida
[editar | editar a fonte]
De xeito similar á cromatografia de gases-espectrometría de masas (GC-MS), a cromatografía líquida-espectrometría de masas (LC/MS ou LC-MS) separa os compostos cromatograficamente antes de que sexan intoducidos na fonte de ións e o espectrómetro de masas. Diferénciase da GC-MS en que a fase móbil é líquida, normalmente unha mestura de auga e solventes orgánicos, en lugar dun gas. O máis común é usar na LC-MS unha fonte de ionización electrospray. Outras fontes iónicas de LC-MS de uso común e dispoñibles comercialmente son a ionización química a presión atmosférica e a fotoionización a presión atmosférica. Desenvolvéronse tamén algunhas técnicas novas de ionización como o spray láser.
Electroforese capilar–espectrometría de masas
[editar | editar a fonte]A electroforese capilar-espectrometría de masas (CE-MS) é unha técnica que combina o proceso de separación líquida da electroforese de capilaridade coa espectrometría de masas.[40] A CE-MS é normalmente acoplada á ionización electrospray.[41]
Mobilidade de ións
[editar | editar a fonte]A espectrometría de mobilidade de ións-espectrometría de masas (IMS/MS ou IMMS) é unha técnica na que primeiro se separan os ións por tempo de deriva a través dalgún gas neutro baixo un gradiente de potencial eléctrico aplicado, antes de seren introducidos nun espectrómetro de masas.[42] O tempo de deriva é unha medida da sección transversal colisional relativa á carga do ión. O ciclo de traballo da IMS (o tempo durante o cal ten lugar o experimento) é maior que o da maioría das técnicas espectrométricas de masas, como o espectrómeto de masas pode mostrear ao longo do curso da separación por IMS. Isto produce datos sobre a separación por IMS e a razón masa-carga dos ións de maneira similar á LC-MS.[43]
O ciclo de traballo da IMS é curto en relación ás separacións por cromatografía líquida ou de gas e pode así ser acoplado a tales técnicas, producindo modalidades triplas como a LC/IMS/MS.[44]
Datos e análise
[editar | editar a fonte]
Representación dos datos
[editar | editar a fonte]A espectrometría de masas produce varios tipos de datos. A representación máis común dos datos é por medio dun espectro de masas.
Certos tipos de datos de espectrometría de masas represéntanse mellor como un cromatograma de masas. Tipos de cromatogramas son os seguintes: monitoriación de ións seleccionados (SIM), corrente iónica total (TIC), e monitorización de reacción seleccionada (SRM), entre moitos outros.
Outros tipos de datos de espectrometría de datos represéntanse ben como un mapa de contornos de isoliñas tridimensional. Desta forma, a masa respecto á carga m/z está no eixe X, a intensidade no eixe Y e un parámetro experimental adicional, como o tempo, rexístrase no eixe Z.
Análise de datos
[editar | editar a fonte]A análise de datos de espectrometría de masas é especíica para o tipo de experimento que produciu os datos. As subdivisións xerais dos datos son fundamentais para comprendelos.
Moitos espectrómetros de masas funcionan ou en modo ión negativo ou en modo ión positivo. É moi importante coñecer se os ións observados teñen carga positiva ou negativa para poder determinar a masa neutra, pero tamén indica algo sobre a natureza das moléculas.
Diferentes tipos de fontes de ións orixinan un distinto conxunto de fragmentos producidos a partir das moléculas orixinais. Unha fonte de ionización de electróns produce moitos fragmentos e principalmente radicais cunha soa carga (1−), que é un número impar de electróns), mentres que unha fonte electrospray adoita producir ións cuasemoleculares non radicais que frecuentemente teñen múltiples cargas. A espectrometría de masas en tándem produce á mantenta ións de fragmentos post-fonte e pode cambiar drasticamente a clasificación dos datos obtidos nun experimento.
O coñecemento da orixe dunha mostra pode proporcionar unha idea das moléculas que compoñen a mostra e das súas fragmentacións. Unha mostra procedente dun proceso de síntese/fabicación probablemente conterá impurezas relacionadas quimicamente co compoñente diana. Unha mostra biolóxica preparada crúa probablemente conterá unha certa cantidade de sales, os cales poden formar adutos coas moléculas do analito en certas análises.
Os resultados poden tamén depender moito da preparción da mostra e de como foi introducida ou analizada. Un exemplo importante é o tipo de matriz que se utiliza para a detección por MALDI, xa que gran parte da enerxética do evento de desorción/ionización é controlada pola matriz en vez de pola potencia láser. Ás veces ás mostras incorpórase sodio ou outra especie química portadora de ións para producir adutos en lugar de especies protonadas.
A espectometría de masas pode medir a masa molar, a estrutura molecular e a pureza da mostra. Cada unha destas cuestións necesitan un procedemento experimental diferente; polo tanto, unha definición axeitada do obxectivo do experimento é un prerrequisito para a recollida adecuada de datos e a correcta interpretación dos mesmos.
Interpretación dos espectros de masas
[editar | editar a fonte]
Como a estrutura precisa ou a secuencia peptídica dunha molécula se descifra por medio dun conxunto de masas de fragmentos, a interpretación de espectros de masas require o uso combinado de varias técnicas. Habitualmente a primeira estratexia para identificar un composto descoñecido é comparar o seu espectro de masas experimental cunha biblioteca de espectros de masas. Se non se encontran correspondencias na busca, entón debe realizarse unha interpretación manual[45] ou unha interpretación do espectro de masas asistida por software. A simulación por computador dos procesos de ionización e de fragmentación que ocorren no espectrómetro de masas é a ferramenta principal para asignar unha estrutura ou secuencia peptídica a unha molécula. Unha información estrutural a priori fragméntase in silico e o padrón resultante compárase co espectro observado. Tal simulación está a miúdo apoiada por unha biblioteca de fragmentación[46] que contén os padróns publicados de reaccións de descomposición coñecidas. Desenvolveuse software que aproveita esta idea para pequenas moléculas e para proteínas.
A análise de espectros de masas pode tamén ser de espectros con masa precisa. Un valor da razón masa-carga (m/z) cuxa precisión é só de números enteiros (sen decimais) pode representar un inmenso número de estruturas iónicas teoricamente posibles; porén, cifras de masa máis precisas reducen significativamente o número de fórmulas moleculares candidatas. Un algoritmo de computador chamado xerador de fórmulas calcula todas as fórmulas moleculares que se axustan teoricamente a unha masa precisa dada coa tolerancia especificada.
Unha técnica recente para dilucidar estruturas en espectrometría de masas chamada pegada dactilar de ión precursor, identifica as informacións estruturais realizando unha busca dos espectros en tándem da molécula baixo investigación nunha biblioteca de espectros de ións de produtos de ións precursores caracterizados estruturalmente.[47]
Aplicacións
[editar | editar a fonte]
A espectrometría de masas ten usos cualitativos e cuantitativos. Estes inclúen a identificación de compostos descoñecidos, a determinación da composición isotópica de elementos dunha molécula, e a determinación da estrutura dun composto observando a súa fragmentación. Outros usos son cuantificar a cantidade dun composto nunha mostra ou estudar os fundamentos da química de ións en fase gasosa (a química de ións e espécimes neutros no baleiro). A espectrometría de masas é agora usada frecuentemente en laboratorios analíticos que estudan as propiedades físicas, químicas ou biolóxicas dunha gran variedade de compostos. A cuantificación pode ser relativa (analizada en relación a unha mostra de referencia) ou absoluta (analizada usando un método de curva estándar).[48][49]
Como técnica analítica posúe claras vantaxes como: (1) un incremento da sensibilidade comparada con outras técnicas analíticas porque o analizador, como filtro de masa-carga, reduce a interferencia de fondo; (2) unha excelente especificidade a partir dos padróns de fragmentación característicos para identificar compostos descoñecidos ou confirmar a presenza de compostos dos que se sospeita; (3) información sobre o peso molecular; (4) información sobre a abundancia isotópica de elementos, e (5) datos químicos resoltos temporalmente.
Algunhas das desvamtaxes deste método son que a miúdo non pode distinguir entre isómeros ópticos e xeométricos e as posicións dos substituíntes nas posicións o-, m- e p- en aneis aromáticos. Ademais, o seu alcance está limitado a identificar hidrocarburos que producen ións fragmentados similares.
Espectrometría de masas de razón isotópica: datos e rastreo de isótopos
[editar | editar a fonte]
A espectrometría de masas tamén se usa para determinar a composición isotópica de elementos na mostra. As diferenzas na masa entre isótopos dun elemento son moi pequenas, e os isótopos menos abundantes dun elemento son normalmente moi raos, así que cómpre dispoñer dun instrumento moi sensible. Estes instrumentos, ás veces denominados espectrómetros de masa de razón isotópica (IR-MS), actualmente usan un só imán para curvar un raio de partículas ionizadas cara a unha serie de copas de Faraday que converten os impactos das partículas en corrente eléctrica. Pode facerse unha análise on line rápida do contido de deuterio da auga usando a especrometría de masas luminescente fluínte, FA-MS. Probablemente o espectrómetro de masas máis sensible e preciso para este propósito é o espectrómetro de masas con acelerador (AMS). Isto débese a que proporciona mellor sensibilidade, con capacidade de medir átomos individuais e medir núclidos cun rango dinámico de ~1015 en relación co isótopo estable principal.[50] As razóns isotópicas son marcadores importantes de diversos procesos. Algunhas razóns isotópicas utilízanse para determinar a idade de materiais, como por exemplo na datación por carbono. O etiquetado con isótopos estables tamén se usa para a cuantificación de proteínas. (ver máis abaixo #Caracterización de proteínas).
Espectrometría de masas de introdución en membrana: medición de gases en disolución
[editar | editar a fonte]A espectrometría de masas de intodución en membrana combina a espectrometría de masas de razón isotópica cunha cela/cámara de reacción separada por unha membrana permeable ao gas. Este método permite o estudo de gases a medida que evolucionan en solución. É un método amplamente usado para o estudo da produción de oxíxeno polo fotosistema II.[51]
Análise de gases traza
[editar | editar a fonte]Varias técnicas utilizan ións creados nunha fonte iónica específica inxectados nun tubo de fluxo ou un tubo de deriva. O tubo de fluxo de ións selecionados (SIFT-MS), e a reacción de transferencia de protóns (PTR-MS), son variantes da ionización química específicos para a análise de gases traza do aire, alento ou espazo líquido usando un tempo de reacción ben definido que permita facer cálculos da concentración do analito a partir da cinética da reacción coñecida sen a necesidade dun estándar interno ou calibración.
Outra técnica con aplicacións no campo da análise de gases traza é a ionización electrospray secundaria (SESI-MS), que é unha variante da ionización electrospray. A SESI consiste nunha pluma electrospray de solvente acidificado puro que interacciona con vapores neutros. As moléculas de vapor quedan ionizadas a presión atmosférica cando se transfire a carga desde os ións formados no electrospray ás moléculas. Unha vantaxe deste método é que é compatible coa maioría dos sistemas ESI-MS.[52][53]
Análise de gas residual
[editar | editar a fonte]
Un analizador de gas residual (RGA) é un espectrómetro de masas pequeno e xeralmente robusto, tipicamente deseñado para o control de procesos e monitorizar a contaminación en sistemas de baleiro. Cando se constrúe como un analizador de masas cuadrupolo, existen dúas aplicacións, que utilizan ambas unha fonte iónica aberta (OIS) ou pechada (CIS). Os RGAs poden encontrarse en aplicacións de alto baleiro como as cámaras de investigación, equipos de ciencia de superficies, aceleradores, microscopios de varrido etc. Os RGAs utilízanse na maioría dos casos para monitorizar a calidade do baleiro e detectar facilmente trazas diminutas de impurezas no ambiente gasoso a baixa presión. Estas impurezas poden medirse baixando ata niveis de Torr, presentando unha detectabilidade de sub-ppm en ausencia de interferencias de fondo.
Os RGAs tamén se poden usar como detectores de fugas in situ sensibles que xeralmente utilizan helio, alcohol isopropílico ou outras moléculas trazadoras. Con sistemas de baleiro que bombean ata chegar a Torr, comprobando a integridade dos selos de baleiro e a calidade das fugas de baleiro, poden detectarse fugas de aire, fugas virtuais e outros contaminantes a baixo nivel antes que se inicie un proceso.
Sonda atómica
[editar | editar a fonte]Unha sonda atómica é un instrumento que combina a espectrometría de masas de tempo de voo e a microscopia de evaporación de campo para mapar a localización de átomos individuais.
Farmacocinética
[editar | editar a fonte]A farmacocinética adoita estudarse usando a espectrometría de masas debido á natureza complexa da matriz (xeralmente sangue ou urina) e a necesidade dunha alta sensibilidade para observar datos puntuais de baixa dose e longo tempo. Os instrumentos máis usados nesta aplicación son os da LC-MS cun espectrómetro de masas triplo cuadrupolo. Para engadir especificidade emprégase usualmente a espectrometría de masas en tándem. As curvas estándar e os estándares internos utilízanse para a cuantificación de normalmente un só fármaco nas mostras. As mostras representan diferentes puntos temporais a medida que se administra o fármaco e despois metabolízase ou elimínase do corpo. As mostras en branco ou t=0 tomadas antes da administración son importantes para determinar o fondo e asegurar a integridade dos datos con ditas matrices de mostras complexas. Dáselle moita importancia á liñaridade da curva estándar; porén, non é raro usar un axuste de curvas con funcións máis complexas como as cuadráticas, xa que a resposta da maioría dos espectrómetos de masas é menor que a liñal en rangos de concentracións grandes.[54][55][56]
Actualmente hai un considerable interese no uso da espectrometría de masas de alta sensibilidade para estudos de microdosaxe, que poderían ser unha alternativa á experimentación animal.
Estudos recentes mostran que a ionización electrospray secundaria (SESI) é unha técnica poderosa para monitorizar a cinética de fármacos por análise do alento.[57][58] Como o alento se produce naturalmente, poden recollerse doadamente varios tipos de datos. Isto permite que o número recollido de tipos de datos aumente substancialmente.[59] En estudos animais, esta estratexia con SESI pode reducir o sacrificio animal.[58] En humanos, a análise con SESI-MS non invasivo do alento pode axudar ao estudo da cinética de fármacos a nivel personalizado.[57][60][61]
Caracterización de proteínas
[editar | editar a fonte]A espectrometría de masas é un método importante para a caracterización e secuenciación de proteínas, o que se chama espectrometría de masas de proteínas. Os dous métodos primarios para a ionización de proteínas completas son a ionización electrospray (ESI) e a desorción/ionización láser asistida por matriz (MALDI). Conforme co rendemento e rango de masas dos espectrómetros de masas dispoñibles, utilízanse dúas estratexias para a caracterización de proteínas. Na primeira, ionízanse as proteínas intactas por medio dalgunha das dúas técnicas descritas antes, e despois introdúcense nun analizador de masas. Esta estratexia denomínase estratexia "de arriba a abaixo" (top-down) da análise de proteínas. Porén, a estratexia de arriba a abaixo está en gran medida limitada a estudos dunha soa proteína de baixo rendemento. Na segunda, as proteínas dixírense encimaticamente orixinando pequenos péptidos usando proteases como a tripsina ou a pepsina, sexa en solución, sexa en en xel despois da separación electroforética. Tamén se usan outros axentes proteolíticos. O conxunto recollido de produtos péptidos adoita separarse por cromatografía antes da introdución do analizador de masas. Cando se usa o padrón característico de péptidos para a identificación de proteínas, o método denomínase pegada dactilar de masa de péptido (PMF), se a identificación se realiza usando os datos de secuencia determinados en análises de espectrometría de masas en tándem, chámase secuenciación de péptidos de novo. Estes procedementos de análise de proteínas tamén se denominan estratexia "de abaixo a arriba" (bottom-up), e tamén foi usada para analizar a distribución e posición de modificacións postranducionais, como a fosforilación de proteínas.[62] Está tamén empezando a utilizarse unha terceira estratexia intermedia chamada "da metade a abaixo" (middle-down), que supón analizar péptidos proteolíticos que son maiores que os típicos péptidos trípticos.[63]
Exploración espacial
[editar | editar a fonte]
Como método estándar para a análise, os espectrómetros de masa chegaron a outros planetas e lúas levados por naves de exploración. Dous foron levados a Marte polo programa Viking. A sonda espacial Mars Phoenix Lander lanzada en 2007 levaba un espectrómetro de masas Analizador de Gases Evolucionado e Térmico para estudar mostras do solo de Marte.[64] Por outra parte, a inicios de 2005 a misión Cassini–Huygens levaba un instrumento GC-MS especializado a bordo da sonda Huygens que atravesou a atmosfera de Titán, a lúa máis grande do planeta Saturno. Este instrumento analizou mostras atmosféricas durante o seu traxecto descendente e vaporizou e analizou mostras da superficie conxelada cuberta de hidrocarburos de Titán unha vez que a sonda aterrou. Estas medidas compararon a abundancia de isótopos de cada partícula en relación á súa abundancia natural na Terra.[65] Ademais, a bordo da nave Cassini–Huygens había un espectrómetro de masas neutro e iónico que tomara medicións da composición atmosférica de Titán e das plumas de Encelado.
Os espectrómetros de masas son tamén amplamente utilizados en misións espaciais para medir a composición de plasmas. Por exemplo, a nave Cassini levaba o Espectrómetro de Plasma Cassini (CAPS),[66] para medir a masa de ións na magnetosfera de Saturno.
Monitor de gas respirado
[editar | editar a fonte]Os espectrómetros de masas foron utilizados nos hospitais para a análise de gases respiratorios desde 1975 ata o final do século XX. Algúns dos antigos probablemente seguen en uso pero xa non se fabica ningún máis.[67]
Estaban situados normalmente na sala de operacións (quirófano), formaban parte dun sistema complexo no cal as mostras de gases respiratorios de pacientes que foran anestesiados facíanse pasar polo instrumento por un mecanismo de válvula deseñado para conectar secuencialmente ata 32 salas co espectrómeto de masas. Un computador dirixía todas as opreracións do sistema. Os datos recollidos polo espectrómetro de masas enviábanse ás salas individuais para o uso do anestesista.
A característica máis especial deste espectrómetro de masas de sector magnético talvez era que un plano de detectores, cada un situado apropiadamente para recoller todas as especies iónicas que se esperaba que houbese nas mostras, permitía que o instrumento informase simultaneamente de todos os gases respirados polo paciente. Aínda que o rango de masas estaba limitado a pouco máis de 120 u, a fragmentación dalgunhas das moléculas máis pesadas evitaba a necesidade de ter un límite de detección máis alto.[68]
Espectrometría de masas preparativa
[editar | editar a fonte]A función primaria da espectrometría de masas é unha ferramenta para análises químicas baseada na detección e cuantificación de ións de acordo coa súa razón masa-carga. Porén, a espectrometría de masas tamén mostra boas perspectivas para a síntese de materiais.[50] A caída ou aterraxe suave de ións caracterízase pola deposición de especies intactas sobre superficies a baixa enerxía cinética que exclúe a fragmentación das especies incidentes.[69] Informouse da técnica da caída suave por primeira vez en 1977 para a reacción de ións de baixa enerxía que conteñen xofre sobre unha supeficie de chumbo.[70]
Notas
[editar | editar a fonte]- ↑ No BUSCatermos aparecen ambas as variantes: espectrometría de masas ou de masa.
- ↑ 2,0 2,1 2,2 Sparkman, O. David (2000). Mass spectrometry desk reference. Pittsburgh: Global View Pub. ISBN 978-0-9660813-2-9.
- ↑ "Definition of spectrograph|date=setembro de 2017." Merriam Webster. Consultado o 13 de xuño de 2008.
- ↑ Downard K (2004). Mass Spectrometry - A Foundation Course. Royal Society of Chemistry. ISBN 978-0-85404-609-6. doi:10.1039/9781847551306.
- ↑ Squires G (1998). "Francis Aston and the mass spectrograph". Dalton Transactions (23): 3893–3900. doi:10.1039/a804629h.
- ↑ Downard KM (2007). "Historical account: Francis William Aston: the man behind the mass spectrograph". European Journal of Mass Spectrometry 13 (3): 177–90. PMID 17881785. doi:10.1255/ejms.878.
- ↑ Thomson JJ (1913). Rays Of Positive Electricity and Their Application to Chemical Analysis. Londres: Longman's Green and Company.
- ↑ Siri W (1947). "Mass spectroscope for analysis in the low-mass range". Review of Scientific Instruments 18 (8): 540–545. Bibcode:1947RScI...18..540S. doi:10.1063/1.1740998.
- ↑ Price P (agosto de 1991). "Standard definitions of terms relating to mass spectrometry : A report from the committee on measurements and standards of the American society for mass spectrometry". Journal of the American Society for Mass Spectrometry 2 (4): 336–48. PMID 24242353. doi:10.1016/1044-0305(91)80025-3.
- ↑ Parkins WE (2005). "The uranium bomb, the calutron, and the space-charge problem". Physics Today 58 (5): 45–51. Bibcode:2005PhT....58e..45P. ISSN 0031-9228. doi:10.1063/1.1995747.
- ↑ "The Nobel Prize in Chemistry 2002: Information for the Public". The Nobel Foundation. 9 de outubro de 2002. Consultado o 2007-08-29.
- ↑ Fenn JB, Mann M, Meng CK, Wong SF, Whitehouse CM (outubro de 1989). "Electrospray ionization for mass spectrometry of large biomolecules". Science 246 (4926): 64–71. Bibcode:1989Sci...246...64F. PMID 2675315. doi:10.1126/science.2675315.
- ↑ Tanaka K, Waki H, Ido Y, Akita S, Yoshida Y, Yoshida T (1988). "Protein and Polymer Analyses up to m/z 100 000 by Laser Ionization Time-of flight Mass Spectrometry". Rapid Commun Mass Spectrom 2 (20): 151–3. Bibcode:1988RCMS....2..151T. doi:10.1002/rcm.1290020802.
- ↑ Karas M, Bachman D, Bahr U, Hillenkamp F (1987). "Matrix-Assisted Ultraviolet Laser Desorption of Non-Volatile Compounds". Int J Mass Spectrom Ion Proc 78: 53–68. Bibcode:1987IJMSI..78...53K. doi:10.1016/0168-1176(87)87041-6.
- ↑ Osborn DL, Zou P, Johnsen H, Hayden CC, Taatjes CA, Knyazev VD, North SW, Peterka DS, Ahmed M, Leone SR (outubro de 2008). "The multiplexed chemical kinetic photoionization mass spectrometer: a new approach to isomer-resolved chemical kinetics". The Review of Scientific Instruments (Submitted manuscript) 79 (10): 104103–104103–10. Bibcode:2008RScI...79j4103O. PMID 19044733. doi:10.1063/1.3000004.
- ↑ Bruins, A. P. (1991). "Mass spectrometry with ion sources operating at atmospheric pressure". Mass Spectrometry Reviews 10 (1): 53–77. Bibcode:1991MSRv...10...53B. doi:10.1002/mas.1280100104.
- ↑ Cottrell JS, Greathead RJ (1986). "Extending the Mass Range of a Sector Mass Spectrometer". Mass Spectrometry Reviews 5 (3): 215–247. Bibcode:1986MSRv....5..215C. doi:10.1002/mas.1280050302.
- ↑ Wollnik, H. (1993). "Time-of-flight mass analyzers". Mass Spectrometry Reviews 12 (2): 89–114. Bibcode:1993MSRv...12...89W. doi:10.1002/mas.1280120202.
- ↑ Guilhaus M (1998). "Principles and Instrumentation in Time-of-flight Mass Spectrometry" (PDF). Journal of Mass Spectrometry 30 (11): 1519–1532. doi:10.1002/jms.1190301102. Arquivado dende o orixinal (PDF) o 2018-02-06 – vía Google Scholar.
- ↑ Syed SU, Maher S, Taylor S (decembro de 2013). "Quadrupole mass filter operation under the influence of magnetic field". Journal of Mass Spectrometry 48 (12): 1325–39. Bibcode:2013JMSp...48.1325S. PMID 24338888. doi:10.1002/jms.3293.
- ↑ Maher S, Syed SU, Hughes DM, Gibson JR, Taylor S (agosto de 2013). "Mapping the stability diagram of a quadrupole mass spectrometer with a static transverse magnetic field applied". Journal of the American Society for Mass Spectrometry 24 (8): 1307–14. Bibcode:2013JASMS..24.1307M. PMID 23720050. doi:10.1007/s13361-013-0654-5.
- ↑ Paul W, Steinwedel H (1953). "Ein neues Massenspektrometer ohne Magnetfeld". Zeitschrift für Naturforschung A 8 (7): 448–450. Bibcode:1953ZNatA...8..448P. doi:10.1515/zna-1953-0710.
- ↑ March RE (2000). "Quadrupole ion trap mass spectrometry: a view at the turn of the century". International Journal of Mass Spectrometry 200 (1–3): 285–312. Bibcode:2000IJMSp.200..285M. doi:10.1016/S1387-3806(00)00345-6.
- ↑ Schwartz JC, Senko MW, Syka JE (xuño de 2002). "A two-dimensional quadrupole ion trap mass spectrometer". Journal of the American Society for Mass Spectrometry 13 (6): 659–69. PMID 12056566. doi:10.1016/S1044-0305(02)00384-7.
- ↑ Lammert SA, Rockwood AA, Wang M, Lee ML, Lee ED, Tolley SE, Oliphant JR, Jones JL, Waite RW (xullo de 2006). "Miniature toroidal radio frequency ion trap mass analyzer". Journal of the American Society for Mass Spectrometry 17 (7): 916–922. PMID 16697659. doi:10.1016/j.jasms.2006.02.009.
- ↑ Snyder DT, Pulliam CJ, Ouyang Z, Cooks RG (xaneiro de 2016). "Miniature and Fieldable Mass Spectrometers: Recent Advances". Analytical Chemistry 88 (1): 2–29. PMC 5364034. PMID 26422665. doi:10.1021/acs.analchem.5b03070.
- ↑ Hu Q, Noll RJ, Li H, Makarov A, Hardman M, Graham Cooks R (abril de 2005). "The Orbitrap: a new mass spectrometer". Journal of Mass Spectrometry 40 (4): 430–43. Bibcode:2005JMSp...40..430H. PMID 15838939. doi:10.1002/jms.856.
- ↑ Comisarow MB, Marshall AG (1974). "Fourier-transform ion cyclotron resonance spectroscopy". Chemical Physics Letters 25 (2): 282–283. Bibcode:1974CPL....25..282C. doi:10.1016/0009-2614(74)89137-2.
- ↑ Marshall AG, Hendrickson CL, Jackson GS (1998). "Fourier-transform ion cyclotron resonance mass spectrometry: a primer". Mass Spectrometry Reviews 17 (1): 1–35. Bibcode:1998MSRv...17....1M. PMID 9768511. doi:10.1002/(SICI)1098-2787(1998)17:1<1::AID-MAS1>3.0.CO;2-K.
- ↑ Dubois F, Knochenmuss R, Zenobi R, Brunelle A, Deprun C, Le Beyec Y (1999). "A comparison between ion-to-photon and microchannel plate detectors". Rapid Communications in Mass Spectrometry 13 (9): 786–791. Bibcode:1999RCMS...13..786D. doi:10.1002/(SICI)1097-0231(19990515)13:9<786::AID-RCM566>3.0.CO;2-3.
- ↑ Park MA, Callahan JH, Vertes A (1994). "An inductive detector for time-of-flight mass spectrometry". Rapid Communications in Mass Spectrometry 8 (4): 317–322. Bibcode:1994RCMS....8..317P. doi:10.1002/rcm.1290080407.
- ↑ Boyd, Robert K. (1994). "Linked-scan techniques for MS/MS using tandem-in-space instruments". Mass Spectrometry Reviews 13 (5–6): 359–410. Bibcode:1994MSRv...13..359B. doi:10.1002/mas.1280130502.
- ↑ Busch, Kenneth L. "A Glossary for Mass Spectrometry" (PDF). Waters.com. Waters. Consultado o 12 de febreiro de 2024.
- ↑ 34,0 34,1 34,2 Xue J, Guijas C, Benton HP, Warth B, Siuzdak G (outubro de 2020). "METLIN MS2 molecular standards database: a broad chemical and biological resource". Nature Methods 17 (10): 953–954. PMC 8802982. PMID 32839599. doi:10.1038/s41592-020-0942-5.
- ↑ Smith CA, O'Maille G, Want EJ, Qin C, Trauger SA, Brandon TR, Custodio DE, Abagyan R, Siuzdak G (decembro de 2005). "METLIN: a metabolite mass spectral database". Therapeutic Drug Monitoring 27 (6): 747–51. PMID 16404815. doi:10.1097/01.ftd.0000179845.53213.39.
- ↑ Guijas C, Montenegro-Burke JR, Domingo-Almenara X, Palermo A, Warth B, Hermann G, Koellensperger G, Huan T, Uritboonthai W, Aisporna AE, Wolan DW, Spilker ME, Benton HP, Siuzdak G (marzo de 2018). "METLIN: A Technology Platform for Identifying Knowns and Unknowns". Analytical Chemistry 90 (5): 3156–3164. PMC 5933435. PMID 29381867. doi:10.1021/acs.analchem.7b04424.
- ↑ Benton HP, Wong DM, Trauger SA, Siuzdak G (agosto de 2008). "XCMS2: processing tandem mass spectrometry data for metabolite identification and structural characterization". Analytical Chemistry 80 (16): 6382–9. PMC 2728033. PMID 18627180. doi:10.1021/ac800795f.
- ↑ Eiceman, G.A. (2000). Gas Chromatography. In R.A. Meyers (Ed.), Encyclopedia of Analytical Chemistry: Applications, Theory, and Instrumentation, pp. 10627. Chichester: Wiley. ISBN 0-471-97670-9
- ↑ Fang M, Ivanisevic J, Benton HP, Johnson CH, Patti GJ, Hoang LT, Uritboonthai W, Kurczy ME, Siuzdak G (novembro de 2015). "Thermal Degradation of Small Molecules: A Global Metabolomic Investigation". Analytical Chemistry 87 (21): 10935–41. PMC 4633772. PMID 26434689. doi:10.1021/acs.analchem.5b03003.
- ↑ Loo JA, Udseth HR, Smith RD (xuño de 1989). "Peptide and protein analysis by electrospray ionization-mass spectrometry and capillary electrophoresis-mass spectrometry". Analytical Biochemistry 179 (2): 404–12. PMID 2774189. doi:10.1016/0003-2697(89)90153-X.
- ↑ Maxwell EJ, Chen DD (outubro de 2008). "Twenty years of interface development for capillary electrophoresis-electrospray ionization-mass spectrometry". Analytica Chimica Acta 627 (1): 25–33. Bibcode:2008AcAC..627...25M. PMID 18790125. doi:10.1016/j.aca.2008.06.034.
- ↑ Verbeck GF, Ruotolo BT, Sawyer HA, Gillig KJ, Russell DH (xuño de 2002). "A fundamental introduction to ion mobility mass spectrometry applied to the analysis of biomolecules". Journal of Biomolecular Techniques 13 (2): 56–61. PMC 2279851. PMID 19498967.
- ↑ Matz LM, Asbury GR, Hill HH (2002). "Two-dimensional separations with electrospray ionization ambient pressure high-resolution ion mobility spectrometry/quadrupole mass spectrometry". Rapid Communications in Mass Spectrometry 16 (7): 670–5. Bibcode:2002RCMS...16..670M. PMID 11921245. doi:10.1002/rcm.623.
- ↑ Sowell RA, Koeniger SL, Valentine SJ, Moon MH, Clemmer DE (setembro de 2004). "Nanoflow LC/IMS-MS and LC/IMS-CID/MS of protein mixtures". Journal of the American Society for Mass Spectrometry 15 (9): 1341–53. PMID 15337515. doi:10.1016/j.jasms.2004.06.014.
- ↑ Tureček F, McLafferty FW (1993). Interpretation of mass spectra. Sausalito: University Science Books. ISBN 978-0-935702-25-5.
- ↑ Mistrik R. "A New Concept for the Interpretation of Mass Spectra Based on a Combination of a Fragmentation Mechanism Database and a Computer Expert System". Highchem.com. Arquivado dende o orixinal o 11 de xaneiro de 2012.
- ↑ Sheldon MT, Mistrik R, Croley TR (marzo de 2009). "Determination of ion structures in structurally related compounds using precursor ion fingerprinting". Journal of the American Society for Mass Spectrometry 20 (3): 370–6. PMID 19041260. doi:10.1016/j.jasms.2008.10.017.
- ↑ Metabolon (2022-01-06). "Solutions to Overcome Limitations of Mass Spectrometry". Metabolon (en inglés). Consultado o 2022-10-27.
- ↑ Zhou, Bin; Xiao, Jun Feng; Tuli, Leepika; Ressom, Habtom W. (2012). "LC-MS-based metabolomics". Mol. BioSyst. (en inglés) 8 (2): 470–481. ISSN 1742-206X. PMC 3699692. PMID 22041788. doi:10.1039/c1mb05350g.
- ↑ 50,0 50,1 Maher S, Jjunju FP, Taylor S (2015). "100 years of mass spectrometry: Perspectives and future trends". Rev. Mod. Phys. 87 (1): 113–135. Bibcode:2015RvMP...87..113M. doi:10.1103/RevModPhys.87.113.
- ↑ Shevela D, Messinger J (novembro de 2013). "Studying the oxidation of water to molecular oxygen in photosynthetic and artificial systems by time-resolved membrane-inlet mass spectrometry". Frontiers in Plant Science 4: 473. PMC 3840314. PMID 24324477. doi:10.3389/fpls.2013.00473.
- ↑ Li X, Huang L, Zhu H, Zhou Z (febreiro de 2017). "Direct human breath analysis by secondary nano-electrospray ionization ultrahigh-resolution mass spectrometry: Importance of high mass resolution and mass accuracy". Rapid Communications in Mass Spectrometry 31 (3): 301–308. Bibcode:2017RCMS...31..301L. PMID 27859758. doi:10.1002/rcm.7794.
- ↑ Barrios-Collado C, Vidal-de-Miguel G, Martinez-Lozano Sinues P (febreiro de 2016). "Numerical modeling and experimental validation of a universal secondary electrospray ionization source for mass spectrometric gas analysis in real-time". Sensors and Actuators B: Chemical (en inglés) 223: 217–225. doi:10.1016/j.snb.2015.09.073. hdl:20.500.11850/105470.
- ↑ Hsieh Y, Korfmacher WA (xuño de 2006). "Increasing speed and throughput when using HPLC-MS/MS systems for drug metabolism and pharmacokinetic screening". Current Drug Metabolism 7 (5): 479–89. PMID 16787157. doi:10.2174/138920006777697963.
- ↑ Covey TR, Lee ED, Henion JD (October 1986). "High-speed liquid chromatography/tandem mass spectrometry for the determination of drugs in biological samples". Analytical Chemistry 58 (12): 2453–60. PMID 3789400. doi:10.1021/ac00125a022.
- ↑ Covey TR, Crowther JB, Dewey EA, Henion JD (febreiro de 1985). "Thermospray liquid chromatography/mass spectrometry determination of drugs and their metabolites in biological fluids". Analytical Chemistry 57 (2): 474–81. PMID 3977076. doi:10.1021/ac50001a036.
- ↑ 57,0 57,1 Gamez G, Zhu L, Disko A, Chen H, Azov V, Chingin K, Krämer G, Zenobi R (maio de 2011). "Real-time, in vivo monitoring and pharmacokinetics of valproic acid via a novel biomarker in exhaled breath". Chemical Communications 47 (17): 4884–6. PMID 21373707. doi:10.1039/c1cc10343a.
- ↑ 58,0 58,1 Li X, Martinez-Lozano Sinues P, Dallmann R, Bregy L, Hollmén M, Proulx S, Brown SA, Detmar M, Kohler M, Zenobi R (xuño de 2015). "Drug Pharmacokinetics Determined by Real-Time Analysis of Mouse Breath". Angewandte Chemie 54 (27): 7815–8. PMID 26015026. doi:10.1002/anie.201503312. hdl:20.500.11850/102558.
- ↑ Gaugg MT, Engler A, Nussbaumer-Ochsner Y, Bregy L, Stöberl AS, Gaisl T, Bruderer T, Zenobi R, Kohler M, Martinez-Lozano Sinues P (setembo de 2017). "Metabolic effects of inhaled salbutamol determined by exhaled breath analysis". Journal of Breath Research 11 (4): 046004. Bibcode:2017JBR....11d6004G. PMID 28901297. doi:10.1088/1752-7163/aa7caa. hdl:20.500.11850/220016.
- ↑ Martinez-Lozano Sinues P, Kohler M, Brown SA, Zenobi R, Dallmann R (febreiro de 2017). "Gauging circadian variation in ketamine metabolism by real-time breath analysis". Chemical Communications 53 (14): 2264–2267. PMID 28150005. doi:10.1039/C6CC09061C.
- ↑ Tejero Rioseras A, Singh KD, Nowak N, Gaugg MT, Bruderer T, Zenobi R, Sinues PM (xuño de 2018). "Real-Time Monitoring of Tricarboxylic Acid Metabolites in Exhaled Breath". Analytical Chemistry 90 (11): 6453–6460. PMID 29767961. doi:10.1021/acs.analchem.7b04600.
- ↑ Ferries S, Perkins S, Brownridge PJ, Campbell A, Eyers PA, Jones AR, Eyers CE (setembro de 2017). "Evaluation of Parameters for Confident Phosphorylation Site Localization Using an Orbitrap Fusion Tribrid Mass Spectrometer". Journal of Proteome Research 16 (9): 3448–3459. PMID 28741359. doi:10.1021/acs.jproteome.7b00337.
- ↑ Chait BT (2011). "Mass spectrometry in the postgenomic era". Annual Review of Biochemistry 80: 239–46. PMID 21675917. doi:10.1146/annurev-biochem-110810-095744.
- ↑ Hoffman JH, Chaney RC, Hammack H (outubro de 2008). "Phoenix Mars Mission--the thermal evolved gas analyzer". Journal of the American Society for Mass Spectrometry 19 (10): 1377–83. PMID 18715800. doi:10.1016/j.jasms.2008.07.015.
- ↑ Petrie S, Bohme DK (2007). "Ions in space". Mass Spectrometry Reviews 26 (2): 258–80. Bibcode:2007MSRv...26..258P. PMID 17111346. doi:10.1002/mas.20114.
- ↑ "Cassini Plasma Spectrometer". Southwest Research Institute. Arquivado dende o orixinal o 2018-10-08. Consultado o 2008-01-04.
- ↑ Riker JB, Haberman B (1976). "Expired gas monitoring by mass spectrometry in a respiratory intensive care unit". Critical Care Medicine 4 (5): 223–9. PMID 975846. doi:10.1097/00003246-197609000-00002.
- ↑ Gothard JW, Busst CM, Branthwaite MA, Davies NJ, Denison DM (setembro de 1980). "Applications of respiratory mass spectrometry to intensive care". Anaesthesia 35 (9): 890–5. PMID 6778243. doi:10.1111/j.1365-2044.1980.tb03950.x.
- ↑ Verbeck G, Hoffmann W, Walton B (outubro de 2012). "Soft-landing preparative mass spectrometry". The Analyst 137 (19): 4393–407. Bibcode:2012Ana...137.4393V. PMID 22900257. doi:10.1039/C2AN35550G.
- ↑ Franchetti V, Solka BH, Baitinger WE, Amy JW, Cooks RG (1977). "Soft landing of ions as a means of surface modification". Mass Spectrom. Ion Phys. 23 (1): 29–35. Bibcode:1977IJMSI..23...29F. doi:10.1016/0020-7381(77)80004-1.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Método Dumas de determinación do peso molecular
- Análise de gas evolucionado
- Espectrómetro de masas de helio
- Dilución isotópica
- MassBank (base de datos), unha base de datos espectrais xaponesa
- Imaxes de espectrometría de masas
- Software de espectrometría de masas
- MasSpec Pen
- Micromatrices para espectrometría de masas
- Espectrometría de masas de ións secundarios a nanoescala
- Reflectrón
Bibliografía
[editar | editar a fonte]- Tureček, František; McLafferty, Fred W. (1993). Interpretation of mass spectra. Sausalito, Calif: University Science Books. ISBN 978-0-935702-25-5.
- de Hoffman, Edmond; Stroobant, Vincent (2001). Mass Spectrometry: Principles and Applications (2nd ed.). John Wiley and Sons. ISBN 978-0-471-48566-7.
- Downard, Kevin (2004). Mass Spectrometry – A Foundation Course. Cambridge UK: Royal Society of Chemistry. ISBN 978-0-85404-609-6.
- Siuzdak, Gary (1996). Mass spectrometry for biotechnology. Boston: Academic Press. ISBN 978-0-12-647471-8.
- Dass, Chhabil (2001). Principles and practice of biological mass spectrometry. New York: John Wiley. ISBN 978-0-471-33053-0.
- Muzikar P, et al. (2003). "Accelerator Mass Spectrometry in Geologic Research". Geological Society of America Bulletin 115: 643–654. Bibcode:2003GSAB..115..643M. ISSN 0016-7606. doi:10.1130/0016-7606(2003)115<0643:AMSIGR>2.0.CO;2.
- Maher S, Jjunju FP, Taylor S (2015). "100 years of mass spectrometry: Perspectives and future trends". Rev. Mod. Phys. 87 (1): 113–135. Bibcode:2015RvMP...87..113M. doi:10.1103/RevModPhys.87.113.
- Sobott, Frank (2014). Biological Mass Spectrometry. Boca Raton: Crc Pr I Llc. ISBN 978-1439895276.
- Sparkman, O. David (2006). Mass Spectrometry Desk Reference. Pittsburgh: Global View Pub. ISBN 978-0-9660813-9-8.
- Watson, J. Throck; Sparkman, O. David (2007). Introduction to Mass Spectrometry: Instrumentatio, Applications, and Strategies for Data Interpretation (4th ed.). Chichester: Jonh Wiley & Sons. ISBN 978-0-470-51634-8.
- Tuniz C (1998). Accelerator mass spectrometry: ultrasensitive analysis for global science. Boca Raton: CRC Press. ISBN 978-0-8493-4538-8.
- Kandiah M, Urban PL (xuño de 2013). "Advances in ultrasensitive mass spectrometry of organic molecules". Chemical Society Reviews 42 (12): 5299–322. PMID 23471277. doi:10.1039/c3cs35389c.
- Calmes, Jordan (2011). Mass spec : the biography of a scientific instrument (MS). Massachusetts Instite of Technology. hdl:1721.1/68473.
Ligazóns externas
[editar | editar a fonte]| Commons ten máis contidos multimedia sobre: Espectrometría de masas |
- Mass Spectrometry en Curlie (en inglés)
- Titorial interactivo sobre espectros de masas do National High Magnetic Field Laboratory
- Simulación dun espectrómetro de masas. Unha aplicación interactiva que simula a consola dun espectrómetro de masas.
- Simulación dun espectrómetro de masas en tempo real. Ferramenta para simular espectros de masas no buscador.





