Carboxipeptidase A
| Carboxipeptidase A | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| Carboxipeptidase A do páncreas bovino | |||||||||
| Identificadores | |||||||||
| Número EC | 3.4.17.1 | ||||||||
| Número CAS | 9031-98-5 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
A carboxipeptidase A é o nome que normalmente se utiliza para referirse ao encima exopeptdase pancreático que hidroliza enlaces peptídidcos de residuos de aminoácidos C-terminais con cadeas laterais aromáticas ou alifáticas. Agora o máis habitual é denominar esta carboxipeptidase como CPA1 (carboxipeptidase A1) e a outro encima pancreático relacionado como CPA2 (carboxipeptidase A2), pero hai máis CPAs.
Tipos[editar | editar a fonte]
Ademais da CPA1 e CPA2 pancreáticas, hai outros catro encimas de mamíferos que se denominan con números desde CPA-3 a CPA-6, pero ningún deles se expresa no páncreas. Estes outros encimas de tipo CPA teñen diversas funcións.
- CPA3 (tamén chamado CPA de mastocito) está implicado na dixestión de proteínas que fan os mastocitos.
- CPA4 (que antes se chamaba CPA-3, pero foi renumerado cando o CPA de mastocito foi designado tamén como CPA-3) pode estar implicado na progresión de tumores, pero é un encima que polo momento non foi ben estudado.
- CPA5 non foi estudado.
- CPA6 exprésase en moitos tecidos durante o desenvolvemento dos ratos e en adultos mostra unha distribución máis limitada no cerebro e outros varios tecidos. O CPA6 está presente na matriz extracelular, onde é encimaticamente activo. Unha mutación humana no CPA6 foi ligada á síndrome de Duane (movementos anormais do ollo). Recentemente, atopáronse mutacións en CPA6 ligadas á epilepsia.
Función[editar | editar a fonte]
A CPA1 e a CPA2 (e presumiblemente todas as outras CPAs) empegan un ión cinc (Zn) no sitio activo da proteína para a hidrólise do enlace peptídico do residuo de aminoácido do extremo C-terminal. A perda do Zn orixina a perda de actividade, que pode ser recuperada reintegrando o Zn ou substituíndoo por outros metais divalentes como cobalto ou níquel. A carboxipeptidase A prodúcese no páncreas e é fundamental en moitos procesos do corpo humano como a dixestión, modificación postraducional de proteínas, coagulación do sangue e reprodución.
Aplicacións[editar | editar a fonte]
A ampla gama de funcionalidades que ten esta proteína faina un modelo ideal para a investigación en relación con outras proteases de cinc de estrutura descoñecida. Recentes investigacións biomédicas sobre colaxenases, encefalinases e o encima convertedor da anxiotensina utilizaron a carboxipeptidase A para inhibir as sínteses e facer probas cinéticas. Por exemplo, un fármaco co que se trata a presión arterial alta chamado Captopril, foi deseñado baseándose nun inhibidor da carboxipeptidase A. A carboxipeptidase A e o encima diana de Captopril, o encima convertedor da anxiotensina, teñen estruturas moi similares, xa que conteñen un ión cinc no sitio activo. Isto permitiu utilizar un potente inhibidor da carboxipeptidase A para inhibir o encima e así baixar a presión arterial por medio do sistema renina-anxiotensina-aldosterona.[1]
Estrutura[editar | editar a fonte]
A carboxipeptidase A (CPA) contén un centro metálico de cinc (Zn2+) en xeometría tetraédrica con residuos de aminoácidos próximos para facilitar a catálise e a unión. Dos 307 aminoácidos que forman a súa cadea peptídica, os seguintes residuos de aminoácidos son importantes para a catálise e a unión; Glu-270, Arg-71, Arg-127, Asn-144, Arg-145 e Tyr-248. A figura 1 ilustra o sitio activo co complexo de cinc tetraédrico cos residuos de aminoácidos importantes que rodean o complexo.[2]

O metal cinc funciona como un catalizador ácido de Lewis fortemente electrofilico que estabiliza unha molécula de auga coordinada, así como estabiliza os intermediarios negativos que ocorren por medio dunha reacción hidrolítica. A estabilización da molécula de auga coordinada e dos intermediarios negativos está asistida por residuos polares do sitio activo que están en estreita proximidade para facilitar a formación de pontes de hidróxeno.[2] O sitio activo pode describirse como dividido en dous subsitios denominados S1’ e S1. O subsitio S1’ é o peto hidrofóbico do encima e Tyr-248 actúa cubrindo o peto hidrofóbico unha vez que o substrato ou o inhibidor están unidos (SITE).[2] A formación de pontes de hidróxeno entre o grupo hidroxilo da Tyr-248 facilita esta conformación debido á interacción cos carboxilatos terminais dos substratos unidos. Cómpre que se produza un movemento substancial para que o modelo de axuste inducido deste encima explique como se produce a interacción.
Unha tríade de residuos interacciona co carboxilato C-terminal por medio de pontes de hidróxeno:
- Un enlace salino coa Arg-145 cargada positivamente.
- Ponte de hidróxeno desde a Tyr-248.
- Ponte de hidróxeno desde o nitróxeno da amida da Asn-144.
Mecanismo[editar | editar a fonte]
A carboxipeptidase A clasifícase como metaloexopeptidase e consta dunha soa cadea polipeptídica unida a un ión cinc. Este caracterísitco ión metálico está localizado no sitio activo do encima, xunto con cinco residuos de aminoácidos que están implicados na unión ao substrato: Arg-71, Arg-127, Asn-144, Arg-145, Tyr-248 e Glu-270. Os estudos de cristalografía de raios X revelaron cinco subsitios na proteína. Estes sitios alostéricos interveñen na creación de especificidade encima-ligando observada na maioría dos encimas. Un destes subsitios induce un cambio conformacional na Tyr-248 despois da unión da molécula de substrato no sitio activo primario. O hidroxilo fenólico da tirosina forma unha ponte de hidróxeno co carboxilato terminal do ligando. Ademais, fórmase unha segunda ponte de hidróxeno entre a tirosina e un enlace peptídico de substratos péptidos máis longos. Estes cambios fan que o enlace entre o encima e o ligando, sexa este un substrato ou un inhibidor, sexa máis forte. Esta propiedade da carboxipeptidase A leva a cumprir a primeira cláusula da hipótese do "axuste inducido" de Daniel E. Koshland.
O subsitio S1 é onde ocorre a catálise, e o ión cinc está coordinado polos residuos Glu-72, His-69 e His-196 do encima. Existe un plano que corta en dous a fenda do sitio activo, onde os residuos Glu-270 e Arg-127 están en lados opostos do complexo cinc-auga acoplado. O cinc é rico en electróns debido aos ligandos de glutamina que o coordinan porque antes de que se una o substrato, o Glu-72 coordina como bidentado pero cambia a monodentado despois da unión do substrato. Como resultado, o metal cinc non pode desprotonar a molécula de auga coordinada para formar o nucleófilo hidroxilo.[2]
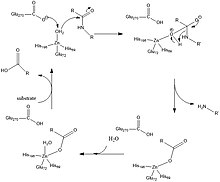
O Glu-270 e a Arg-127 xogan un importante papel na catálise mostrada na Figura 2. A Arg-127 actúa estabilizando o carbonilo do substrato que está unido ao grupo amino da fenilalanina. Simultaneamente, a molécula de auga coordinada co cinc é desprotonada polo Glu-270 e interacciona co carbonilo estabilizado pola Arg-127. Isto crea un intermediario, mostrado na Figura 2, no cal o oxíxeno cargado negativamente está coordinado co cinc, e por medio de interaccións electrostáticas desfavorables entre o Glu-270 e o produto ionizado facilita a liberación do produto ao final da catálise.[2]
En recentes estudos computacionais, o mecanismo da catálise é similar mais coa diferenza de que a molécula de auga desprotonada se une ao carbono do carbonilo, mentres que na Figura 2 se mostra que o grupo hidroxilo se mantén coordinado ao cinc. Entón ocorre a proteólise e a molécula de auga é despois introducida de novo no sitio activo para coordinarse co cinc.[3]
Realizáronse varios estudos para explorar os detalles do enlace entre a carboxipeptidase A e o substrato e ver como isto afecta a velocidade da hidrólise. En 1934 descubriuse por medio de experimentos cinéticos que, para que o substrato se una, o péptido que vai ser hidrolizado debe estar a carón do grupo hidroxilo libre terminal. Ademais, a velocidade da hidrólise pode ser acelerada se o residuo C-terminal é alifático ramificado ou aromático. Porén, se o substrato é un dipéptido cun grupo amino libre, este sofre a hidrólise lentamente; non obstante, isto pode evitarse se o grupo amino é bloqueado por N-acilación.[4]
Está bastante claro que a estrutura do encima, ou máis en concreto o sitio activo, é moi importante para comprender o mecanismo da reacción. Por esta razón, Rees e coegas estudaron o complexo encima-ligando para buscar unha resposta clara sobre o papel exercido polo ión cinc. Estes estudos encontraron que no encima libre o número de coordinación do cinc é 5; o centro metal está coordinado con dous nitróxenos Nδ1 imidazol, os dous oxíxenos do carboxilato do glutamato-72 e unha molécula de auga para formar un tetraedro distorsionado. Porén, unha vez que se une o ligando no sitio activo da carboxipeptidase A, este número de coordinación pode variar de 5 a 6. Cando o dipéptido glicil-L-tirosina está unido, o nitróxeno amino do dipéptido e o oxíxeno carbonilo substituíron o ligando da auga. Isto dará un número de coordinación de 6 para o cinc no complexo carboxipeptidase A-dipéptido glicil-L-tirosina. Os mapas de densidade electrónica proporcionaron evidencias de que o nitróxeno amino ocupa unha segunda posición preto do glutamato-270. A proximidade destes dous residuos tería como resultado un impedimento estérico que impediría que o ligando auga se coordinase co cinc. Isto causaría un número de coordinación de 5. Os datos para ambos os casos son substanciais, o que indica que ambas as situación ocorren naturalmente.[5]
Propuxéronse dous mecanismos para a función catalítica da carboxipeptidase A. O primeiro é unha vía nucleofílica que implica un intermediario acilo encima covalente que contén a base do sitio activo Glu-270. As probas da existencia deste intermediario anhidro non son definitivas; Suh e colegas illaron o que se supón é o intermediario acilo. Porén, a confirmación do acilo encima fíxose sen experimentos de atrapamento, facendo que a conclusión sexa débil.[1]
O segundo mecanismo proposto é unha vía de auga promovida. Este mecanismo implica o ataque da molécula de auga no enlace peptídico escindible do substrato. Este proceso é promovido polo ión cinc e axudado polo residuo Glu-270.[1]
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 1,2 Christianson DW, Lipscomb WN (febreiro de 1989). "Carboxypeptidase A". Accounts of Chemical Research 22 (2): 62–9. doi:10.1021/ar00158a003.
- ↑ 2,0 2,1 2,2 2,3 2,4 Christianson, D., W., and Lipscomb, W., N. (1989) Carboxypeptidase A. American Chemical Society, Vol (22): 62-69.
- ↑ Valdez CE, Morgenstern A, Eberhart ME, Alexandrova AN (novembro de 2016). "Predictive methods for computational metalloenzyme redesign - a test case with carboxypeptidase A". Physical Chemistry Chemical Physics 18 (46): 31744–31756. Bibcode:2016PCCP...1831744V. PMID 27841396. doi:10.1039/c6cp02247b.
- ↑ Lipscomb WN (marzo de 1970). "Structure and mechanism in the enzymic activity of carboxypeptidase A and relations to chemical sequence.". Accounts of Chemical Research 3 (3): 81–9. doi:10.1021/ar50027a001.
- ↑ Rees DC, Lewis M, Honzatko RB, Lipscomb WN, Hardman KD (xuño de 1981). "Zinc environment and cis peptide bonds in carboxypeptidase A at 1.75-A resolution". Proceedings of the National Academy of Sciences of the United States of America 78 (6): 3408–12. Bibcode:1981PNAS...78.3408R. PMC 319577. PMID 6943549. doi:10.1073/pnas.78.6.3408.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
- Inhibidor da carboxipeptidase A
- Carboxipeptidase B
- Carboxipeptidase
- Carboxipeptidase A1
- Carboxipeptidase A2
Ligazóns externas[editar | editar a fonte]
- A base de datos on line MEROPS para peptidases e os seus inhibidores: M14.001[Ligazón morta]
- Carboxypeptidases A Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
