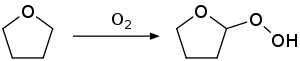Hidroperóxido

Un hidroperóxido ou peroxol é un composto que contén o grupo funcional hidroperóxido (ROOH). Se R é orgánico, o composto denomínase hidroperóxido orgánico, que é un tipo de peróxido orgánico, o cal ten a fórmula xeral ROOR. Os hidroperóxidos orgánicos poden de forma intencionada ou non iniciar unha polimerización explosiva en materiais con enlaces químicos insaturados.[1]
Propiedades
[editar | editar a fonte]A lonxitude de enlace O−O no peróxidos é duns 1,45 Å e os ángulos R−O−O (R = H, C) son duns 110°. Os ángulos diedros nos enlaces C−O−O−H son duns 120°. O enlace O−O é relativamente débil, cunha enerxía de disociación de enlace de 45–50 kcal/mol, que é de menos da metade da forza dos enlaces C−C, C−H e C−O.[2][3]
Uso e reaccións
[editar | editar a fonte]Os hidroperóxidos poden ser reducidos a alcohois con hidruro de litio aluminio, como se describe na seguinte ecuación idealizada:
- 4 ROOH + LiAlH4 → LiAlO2 + 2 H2O + 4 ROH
Esta reacción é na que están baseados os métodos de análise de peróxidos orgánicos.[4] Outro xeito de avaliar o contido de perácidos e peróxidos é a titulación volumétrica con alcóxidos como o etóxido de sodio.[5] Os ésteres de fosfito e fosfinas terciarias tamén realizan a redución:
- ROOH + PR3 → OPR3 + ROH
Os hidroperóxidos son intermediarios na produción de moitos compostos orgánicos na industria. Por exemplo, na oxidación catalizada polo cobalto de ciclohexano a ciclohexanona:[6]
- C6H12 + O2 → (CH2)5CO + H2O
A acetona e fenol prodúcense polo denominado proceso do cumeno, que se produce a partir do hidroperóxido de cumeno.
Moitos epóxidos prepáranse usando hidroperóxidos como reactivos, como o proceso Halcon para a produción de óxido de propileno. A epoxidación de Sharpless é unha reacción relacionada realizada a escala de laboratorio. O ter-butil hidroperóxido (TBHP) é un oxidante soluble en solventes orgánicos empregado nestas operacións.[7]
Os aceies secantes, como os que se encontran en moitas pinturas e vernices, funcionan por medio da formación de hidroperóxidos.
Formación
[editar | editar a fonte]Os hidroperóxidos xogan un importante papel en bioloxía. Coñécense centos de hidroperóxidos, que derivan de ácidos graxos, esteroides, e terpenos. A biosíntese destas especies é efectuada en gran medida por enzimas.


Os compostos con enlaces C-H alílicos e bencílicos son especialmente susceptibles á oxixenación.[9] Esta reactividade aprovéitase industrialmente a moi grande escala para a produción de fenol polo proceso do cumeno ou proceso de Hock cos intermediarios cumeno e hidroperóxido de cumeno.[10] Ditas reaccións dependen de iniciadores de radicais quet reaccionan co oxíxeno para formar un intermediario que abstrae un átomo de hidróxeno dun enlace C-H débil. O radical resultante únese ao O2 para dar un hidroperoxil (ROO.), que despois continúa o ciclo de abstracción do átomo de H.[11]
A reacción de autooxidación obsérvase con éteres comúns, como o dietil éter, diisopropil éter, tetrahidrofurano ou 1,4-dioxano. Un produto ilustrativo é o dietil éter peróxido. Dito composto pode orixinar unha forte explosión. O solvente común tetrahidrofurano (THF) exemplifica esta tendencia a formar hidroperóxidos altamente explosivos almacenados ao aire.[11]
Para minimizar este problema as mostras comerciais de THF adoitan estar inhibidas con hidroxitolueno butilado (BHT). A destilación de THF ata quedar seco evítase porque os peróxidos explosivos se concentran no residuo.

Notas
[editar | editar a fonte]- ↑ Klenk, Herbert; Götz, Peter H.; Siegmeier, Rainer; Mayr, Wilfried, "Peroxy Compounds, Organic", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH
- ↑ Bach, Robert D.; Ayala, Philippe Y.; Schlegel, H. B. (1996). "A Reassessment of the Bond Dissociation Energies of Peroxides. An ab Initio Study". J. Am. Chem. Soc. 118 (50): 12758–12765. doi:10.1021/ja961838i.
- ↑ Otto Exner (1983). "Stereochemical and conformational aspects of peroxy compounds". En Saul Patai. PATAI'S Chemistry of Functional Groups. Wiley. pp. 85–96. ISBN 9780470771730. doi:10.1002/9780470771730.ch2.
- ↑ Higuchi, T.; Zuck, Donald Anton (1951). "Behaviors of Several Compounds as Indicators in Lithium Aluminum Hydride Titration of Functional Groups". Journal of the American Chemical Society 73 (6): 2676. doi:10.1021/ja01150a073.
- ↑ Martin, A. J. (1957). "Potentiometric titration of hydroperoxide and peracid in Anhydrous Ethylenediamine". Analytical Chemistry 29: 79–81. doi:10.1021/ac60121a022.
- ↑ ^ Michael T. Musser (2005), "Cyclohexanol and Cyclohexanone", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi: 10.1002/14356007.a08_217
- ↑ Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. (1985). "Enantioselective Epoxidation Of Allylic Alcohols: (2s,3s)-3-propyloxiranemethanol". Org. Synth. 63: 66. doi:10.15227/orgsyn.063.0066.
- ↑ Matsui K (2006). "Green leaf volatiles: hydroperoxide lyase pathway of oxylipin metabolism". Current Opinion in Plant Biology 9 (3): 274–80. PMID 16595187. doi:10.1016/j.pbi.2006.03.002.
- ↑ Knight, H. B.; Swern, Daniel (1954). "Tetralin Hydroperoxide". Org. Synth. 34: 90. doi:10.15227/orgsyn.034.0090..
- ↑ Brückner, R. Reaktionsmechanismen: organische Reaktionen, Stereochemie, moderne Synthesemethoden, pp. 41–42, Spektrum Akademischer Verlag, Munich, 2004, ISBN 3-8274-1579-9 (en alemán)
- ↑ 11,0 11,1 Heinz G. O. Becker Organikum, Wiley-VCH, 2001, ISBN 3-527-29985-8 pp. 206–207