Talidomida
| Talidomida | |
|---|---|
 | |

|

|
(RS)-2-(2,6-dioxopiperidin-3-il)-1H-isoindole-1,3(2H)-diona | |
| Identificadores | |
| Número CAS | 50-35-1 |
| PubChem | 5426 |
| UNII | 4Z8R6ORS6L |
| DrugBank | DB01041 |
| KEGG | D00754 |
| ChEBI | CHEBI:9513 |
| Código ATC | L04 |
| |
| Propiedades | |
| Fórmula molecular | H10N2O4 |
| Masa molar | 102,09 g mol−1 |
| Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
A talidomida (de ftalimido-glutarimida,[1] actualmente vendida como Immunoprin, Talidex, Talizer, ou Thalomid) é un fármaco inmunomodulador e o prototipo do grupo de fármacos da clase talidomida.
Hoxe, a talidomida véndea a compañía Celgene, principalmente como tratamento para certos cancros (mieloma múltiple) e para complicacións da lepra.
A talidomida foi comercializada inicialmente en 1957 en Alemaña Occidental co nome comercial de Contergan, e foi a compañía farmacéutica alemá Chemie Grünenthal (agora Grünenthal) a que a desenvolveu e vendeu. Primeiramente prescribíase como un sedativo ou hipnótico, e considerábase que curaba a “ansiedade, insomnio, gastrite, e tensión".[2] Despois utilizouse contra as náuseas e para aliviar os mareos matutinos en mulleres preñadas. A talidomida vendeuse sen receita en Alemaña desde o 1 de outubro de 1957. Pouco despois de que se empezase a vender en Alemaña, entre 5.000 e 7.000 nenos naceran con focomelia (malformación das extremidades). Só o 40% destes nenos sobreviviron.[3] En todo o mundo, informouse duns 10.000 casos de meniños nacidos con focomelia debido á talidomida, dos cales só o 50% sobreviviron. Aqueles que estiveron expostos á talidomida cando estaban no ventre materno sufriron defectos nas súas extremidades, xa que estas non se desenvolvían ou quedaban tocas. Outros efectos eran deformidades nos ollos, corazón, tractos alimenticios e urinarios, cegueira e xordeira.[4] Os efectos negativos da talidomida fixeron que se implantasen regulacións e controis máis estruturados e esixentes sobre o desenvolvemento e uso de fármacos.[5]
Usos médicos actuais
[editar | editar a fonte]A talidomida utilízase actualmente para varias condicións como son: eritema nodoso leproso, mieloma múltiple e outros cancros, para algúns síntomas do VIH/SIDA, enfermidade de Crohn, sarcoidose, enfermidade de enxerto contra hóspede, artrite reumatoide e varias condicións da pel que non responden aos tratamentos usuais.[6] Porén, non hai claras evidencias de que a talidomida ou a lenalidomida sexan útiles para producir ou manter a remisión na enfermidade de Crohn.[7][8]
Tratamento da lepra
[editar | editar a fonte]En 1964, o médico israelita Jacob Sheskin administrou talidomida a un paciente que estaba doente de lepra en condicións críticas. O paciente mostraba eritema nodoso leproso (ENL), unha dolorosa condición da pel, que é unha das complicacións da lepra. Este tratamento, que se intentou a pesar da prohibición do uso da talidomida, tivo resultados favorables: o paciente quedou durmido durante horas e puido erguerse da cama sen axuda ao espertar. Pouco despois fíxose un ensaio clínico que estudaba o uso da talidomida na lepra.[9]
A talidomida foi utilizada por médicos brasileiros como medicamento de elección para o tratamento de eritema nodoso leproso grave desde 1965, e en 1996, informouse de polo menos 33 casos de embriopatía por talidomida en persoas nacidas no Brasil despois de 1965.[10] Desde 1994, a produción, venda e prescrición de talidomida foi estritamente controlada, e requiriuse ás mulleres que utilizasen dúas formas de control da natalidade e que se sometesen a probas de embarazo regulares. Malia isto, continúa habendo casos de embriopatía por talidomida,[11][12] e no Brasil foron identificados polo menos 100 casos entre 2005 e 2010.[13] Nese período foron distribuídas no Brasil 5,8 millóns de pílulas de talidomida, fundamentalmente entre xente pobre en áreas con pouco acceso ao sistema sanitario, e estes casos déronse malia os controis establecidos.
En 1998 a FDA dos Estados Unidos aprobou o uso deste fármaco para o tratamento do eritema nodoso leproso (ENL).[14] Debido ao potencial da talidomida de causar defectos de nacemento, o fármaco pode distribuírse só baixo condicións estritamente controladas. A FDA esixiu que Celgene Corporation, que planeaba comercializar a talidomida co nome de marca Thalomid, establecese un sistema para a instrución dos pacientes sobre os riscos e modo de uso da talidomida e un programa de supervisión para a prescrición segura.[14]
Máis recentemente, a Organización Mundial da Saúde (OMS) manifestou o seguinte:
"A OMS non recomenda o uso da talidomida na lepra xa que a experiencia mostrou que é virtualmente imposible desenvolver e aplicar un mecanismo de vixilancia infablible para combater o mal uso do fármaco. O fármaco clofazimina é agora un compoñente da terapia multifármaco (MDT), introducida pola OMS en 1981 como o tratamento estándar para a lepra e agora subministrado gratuitamente a todos os pacientes do mundo."[15]
Tratamento do cancro
[editar | editar a fonte]A talidomida foi inicialmente probada en humanos como un axente para o tratamento do mieloma múltiple debido á súa actividade anti-anxioxénica.[16] Os fundamentos iniciais deste traballo establecéronse nunha conferencia clave en 1993 na American Society of Hematology do Dr. Folkman cando presentou a hipótese de que todos os tumores malignos de sangue son dependentes da anxioxénese, baseándose no seu descubrimento de que os niveis de factor de crecemento anxioxénico (FGF) estaban elevados na urina dos pacientes de leucemia.[17] Estudos posteriores feitos no seu laboratorio mostraron a eficacia do uso do inhibidor da anxioxénese TNP-470 en modelos de ratos con leucemia. Adicionalmente, en 1994 Vacca demostrara que o crecemento da anxioxénese multiplicábase por 5 na medula ósea de pacientes de mieloma múltiple.[18] Cando a familia dun paciente que estaba nos últimos estadios de mieloma múltiple solicitou calquera axuda que fose posible ao Dr. Folkman en 1997, el intentou obter TNP-470 como terapia, pero o TNP-470 non podía obterse fóra dos ensaios clínicos que estaban en marcha, e así o Dr. D'Amato suxeriu que nese paciente se utilizase no seu lugar a talidomida.[19] Iniciouse entón un pequeno estudo do uso da talidomida con ese paciente e varios outros feito polo Dr. Bart Barlogie no que se observaron efectos drásticos positivos.[16] Desde entón, moitos estudos mostraron que a talidomida, en combinación con dexametasona, incrementa a supervivencia de pacientes de mieloma múltiple.
Na década de 2000, a combinación de talidomida e dexametasona, a miúdo en combinación tamén con melfalán, converteuse nun dos réximes de tratamento máis comúns para os pacientes con mieloma múltiple acabados de diagnosticar.[20][21] A talidomida pode tamén causar efectos secundarios, como polineuropatía, fatiga, erupcións na pel, e tromboembolismo venoso (VTE), ou coágulos sanguíneos, o que podería orixinar un accidente cerebrovascular ou infarto de miocardio.[22][23]
En 2006 a FDA dos Estados Unidos deu unha aprobación acelerada para o uso da talidomida en combinación coa dexametasona para o tratamento de mieloma múltiple acabado de diagnosticar.[24] A aprobación da FDA chegou sete anos despois dos primeiros informes da súa eficacia na literatura médica.
Efectos adversos
[editar | editar a fonte]Efectos adversos por frecuencia:[25][26][27][28]
Moi común (pode afectar a máis de 1 de cada 10 persoas medicadas):
- Somnolencia (~40%)
- Edema (~60%)
- Hipotensión (baixa presión arterial)
- Dores de cabeza
- Hematuria (sangue na urina)
- Artralxia (dor nas articulacións)
- Mialxia (dor muscular)
- Incremento da bilirrubina
- Neutropenia (~30%)
- Leucopenia (~15-40%)
- Linfopenia
- Estrinximento
- Neuropatía periférica (pode ser irreversible e xeralmente orixínase por unha exposición crónica, normalmente de meses, á talidomida.[27])
- Mareos
- Parestesia
- Disestesia
Común (pode afectar ata 1 persoa de cada 10 medicadas):
- Embolismo pulmonar
- Vómitos
- Boca seca
- Erupción cutánea tóxica
- Pel seca
- Erupcións
- Urticaria (proídos)
- Pirexia (febre)
- Astenia
- Enfermidade pulmonar intersticial
- Insuficiencia cardíaca
- Depresión
- Pneumonía
Pouco común (pode afectar ata a 1 persoa de cada 100 medicadas):
- Dispnea (dificultades respiratorias)
- Tremores
Raro (pode afectar ata 1 persoa de cada 1.000 medicadas):
- Incremento do apetito
- Bradicardia (frecuencia cardíaca baixa)
- Taquicardia (frecuencia cardíaca alta)
- Arritmias cardíacas
- Malestar xeral
- Trombose de veas profundas
Moi raro (pode afectar ata 1 persoa de cada 10.000 medicadas):
- Trombocitopenia
- Anemia
- Hipotiroidismo
- Libido reducida
- Confusión
- Ataques epilépticos
- Hipotensión ortostática
- Eventos tromboembólicos
- Broncoespasmo
- Obstrución intestinal
- Prurito (proído)
- síndrome de Stevens-Johnson
- Necrólise epidérmica tóxica
- Edema facial
- Fotosensibilidade
- Anormalidades na menstruación
Carcinoxenicidade
[editar | editar a fonte]Os estudos feitos en animais non puideron demostrar ningunha carcinoxenicidade mesmo cando as ratas e ratos foron expostos a unha dose 11 veces maior que a dose terapéutica da talidomida.[28] A pesar disto, houbo certa preocupación sobre se podía causar tumores malignos secundarios en pacientes con mieloma múltiple. A FDA manifestou que se está a investigar este asunto.[29]
Algúns ensaios clínicos apoian que o principal tumor maligno secundario que está asociado coa talidomida é a leucemia mieloide aguda.[30] Noutros países, como Canadá ou Reino Unido, as axencias sanitarias tamén avisaron aos profesionais sanitarios sobre os riscos de tumores malignos secundarios debido á exposición á talidomida.[31][32]
Efectos teratolóxicos
[editar | editar a fonte]- Véxase tamén: Teratóxeno.
Os defectos de nacemento causados pola talidomida tomada por mulleres xestantes poden ir desde malformacións moderadas a formas máis graves. Os posibles defectos de nacemento inclúen a focomelia (membros pouco desenvolvidos), dismelia (anormalidades nos membros), amelia (falta de membros), hipoplasticidade dos ósos, e outros defectos conxénitos que afectan aos oídos, corazón, ou outros órganos internos.[33] Franks et al. estudaron como afectaba o fármaco aos neonatos, a gravidade das deformidades, e outros efectos no período dos primeiros anos en que se empezou a utilizar o fármaco. Despois, Webb en 1963 volveu a revisar o historial de casos do fármaco e as diferentes formas de defectos de nacemento que causara. “A forma máis común de defectos de nacemento debidos á talidomida é o acurtamento das extremidades, na que os brazos son as máis frecuentemente afectadas. Esta síndrome é a presenza de deformidades nos ósos longos co resultado do acurtamento dos membros e outras anormalidades.”[34]
Contraindicacións
[editar | editar a fonte]Entre as contraindicacións están:[28]
- Hipersensibilidades á talidomida coñecidas
- Embarazo ou lactación materna
- Idade do paciente < 12 anos
- Pacientes que non poden ou non queren levar a cabo as medidas contraceptivas necesarias.
Interaccións
[editar | editar a fonte]Non se espera que haxa interaccións farmacocinéticas entre a talidomida e outras medicinas debido aos seus efectos neutros sobre a p-glicoproteína e os citocromos P450.[28] Pode interaccionar con sedativos debido á súa propia acción sedativa.[28] pode interaccionar con axentes bradicárdicos debido aos seus efectos indutores da bradicardia.[28] O risco de neuropatía periférica pode incrementarse polo tratamento simultáneo con outros axentes que se sabe que causan neuropatía periférica.[28] O risco de tromboembolismos venosos coa talidomida parece incrementarse cando os pacientes son tratados con contraceptivos orais ou outros axentes citotóxicos (incluíndo a doxorrubicina e o melfalán) concorrentemente.[28] A talidomida pode interferir cos efectos contraceptivos de varios contraceptivos e, por tanto, advírtese que as mulleres en idade reprodutiva usen polo menos dous medios contraceptivos diferentes para asegurarse de que non se concibirá ningún neno mentres a nai se está medicando con talidomida.[28]
Sobredose
[editar | editar a fonte]Informouse ata agora de dezaoito casos de sobredose con doses de ata 14,4 g sen que se informase de falecementos.[28] Non existe ningún antídoto específico para as sobredoses e o tratamento é puramente de mantemento.[28]
Mecanismo de acción
[editar | editar a fonte]O mecanismo exacto de acción da talidomida non se coñece, pero posibles mecanismos son os seus efectos anti-anxioxénicos e indutores de estrés oxidativo.[35] tamén inhibe a produción de TNF-α, IL-6, IL-10 e IL-12,[36] modula a produción de IFN-γ[36] e potencia a produción de IL-2, IL-4 e IL-5 polas células inmunitarias.[36] Incrementa o reconto de linfocitos, coestimula as células T e modula a citotoxicidade das células asasinas naturais.[36] Ademais, inhibe a actividade de NF-κB e de COX-2.[35]
En 1990, un grupo de investigadores brasileiros decatouse de que os niveis de TNF alfa se elevaban en estados reaccionais da lepra e observaron que os niveis de TNF diminuían nalgúns pacientes co tratamento con talidomida, o que potencialmente explicaría a eficacia da talidomida no tratamento da eritema nodoso leproso (ENL).[37]
O mecanismo da acción teratoxénica da talidomida foi moi investigado e publicáronse uns 2000 artigos científicos e propuxéronse 15 ou 16 mecanismos plausibles.[38] A anxioxénese é crítica durante o desenvolvemento das extremidades do feto. A talidomida pode inhibir directamente a anxioxénese inducida por bFGF ou VEGF in vivo.[39] Os análogos teratoxénicos inhiben a anxioxénese mentres que os análogos non teratoxénicos non a inhiben.[39] En 2009, as investigacións feitas por outros grupos confirmaron "concluíntemente que a perda dos vasos sanguíneos de nova formación é a principal causa da teratoxénese da talidomida, e as extremidades en desenvolvemento son especialmente susceptibles debido á súa relativamente inmadura e altamente anxioxénica rede de vasos sanguíneos".[40] Así, a teoría aceptada é que a inhibición da anxioxénese é o mecanismo de teratoxenicidade como propuxera orixinalmente D'Amato en 1994.
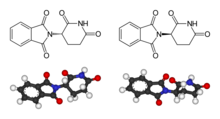
esquerda: (S)-talidomida,
dereita: (R)-talidomida.
A talidomida é racémica; os seus dous enantiómeros poden racemizarse debido ao hidróxeno ácido no centro quiral, que é o carbono do anel de glutarimida unido ao substituínte ftalimida. O proceso de racemización pode ocorrer in vivo[41][42][43][44] de modo que calquera plan de administración dun só enantiómero purificado para evitar os efectos teratoxénicos será probablemente inútil.[43][45][46]
Inactivación da proteína cereblon
[editar | editar a fonte]Cereblon é unha proteína que é importante na formación das extremidades e para a capacidade proliferativa das células do mieloma, que queda inactivada cando a talidomida se une a ela.[47] Isto foi confirmado en estudos que reducían a produción de cereblon en polos en desenvolvemento e embrións de peixe cebra usando técnicas xenéticas. Estes embrións tiñan defectos similares aos causados pola talidomida.
Porén, o descubrimento de que a inhibición de cereblon é responsable da actividade teratoxénica da talidomida no polo e no peixe cebra foi posta en dúbida debido aos informes recentes de que a pomalidomida, un análogo da talidomida máis poderoso, non causa efectos teratoxénicos neses mesmos sistemas modelo malia ser un inhibidor máis potente de cereblon que a talidomida.[48][49]
Farmacocinética
[editar | editar a fonte]| Cmax | Tmax | Vida media | Biodispoñibilidade | Unión a proteínas plasmáticas | Volume de distribución |
Eliminación (aclaramento) na urina | Excreción |
|---|---|---|---|---|---|---|---|
| 1,2 mg/L (dose de 200 mg/día durante 21 días) |
3–6 horas | 5–7,5 horas (dependendo da dose) |
90% | 55 e 66% (para os enantiómeros R e o S, respectivamente) |
122 L | 1,15 mL/min | Urina (91,9%), feces |
O seu metabolismo é hepático (en pequena medida vía 5-hidroxilación mediada por CYP2C19, e principalmente vía hidrólise non encimática nos catro sitios amida).
Análogos da talidomida
[editar | editar a fonte]A exploración das actividades antianxioxénicas e inmunomoduladoras da talidomida levou ao estudo e creación de análogos da talidomida.[50][51] Celgene patrocinou numerosos ensaios clínicos con análogos da talidomida, como a lenalidomida, que son substancialmente máis potentes e teñen menos efectos secundarios, excepto que presentan unha maior mielosupresión.[52] En 2005, Celgene obtivo a aprobación da FDA para a lenalidomida (Revlimid) como primeiro derivado útil comercialmente. Revlimid está dispoñible só en centros con distribución restrinxida para evitar o seu uso durante o embarazo. Estanse a realizar máis estudos para atopar compostos máis seguros con cualidades útiles.
Outro análogo máis potente é a pomalidomida, que en 2013 foi aprobada pola FDA.[53] Estes análogos da talidomida poden utilizarse para tratar diferentes doenzas, ou usarse nun réxime de tratamento para combater dúas condicións.[54] A pomalidomida é comercializada por Celgene e é un activo antianxioxénico que tamén actúa como inmunomodulador. A pomalidomida está aprobada para o tratamento do mieloma múltiple recidivante e refractario.[55] Recibiu unha aprobación similar da Comisión Europea en 2013, e pretende comercializarse en Europa co nome Imnovid.[56]
Usos aprobados
[editar | editar a fonte]| Indicación aprobada | EUA (FDA) (ano)[25][26] | Unión Europea (EMA) (ano) [57] |
Apoio na literatura/Notas |
|---|---|---|---|
| Enfermidade de Crohn | Fármaco orfo | Non | Nenos e adolescentes (nun pequeno ensaio aleatorizado)[58] e adultos (en ensaios clínicos abertos).[59] |
| Eritema nodoso leproso (ENL) | Si (1998) | Non | Algún apoio na literatura científica, incluíndo polo menos dous ensaios controlados con placebo aleatorizados.[60][61][62] |
| Enfermidade de enxerto contra hóspede (GVHD) | Orfo | Non | Apoio na literatura limitado.[59] |
| Transplante de células nai hematopoéticas | Orfo | Non | |
| Síndrome de debilitamento asociado ao VIH | Orfo | Non | |
| Sarcoma de Kaposi (KS) | Orfo | Non | Cancro de tecidos brandos raro que se dá principalmente en persoas inmunocomprometidas. Causado polo herpervirus asociado a sarcoma de Kaposi (KSHV). Un estudo en fase II confirmou a súa eficacia.[63] |
| Mieloma múltiple | Si (2006) | Si (2008) | Numerosos ensaios clínicos confirmaron a súa eficacia, principalmente cando se usa en combinación con outras medicacións.[59] |
| Infección micobacteriana | Orfo | Non | Infeccións micobacterianas como a lepra, tuberculose e infeccións polo complexo Mycobacterium avium. |
| Síndrome mielodisplástico | Orfo | Non | |
| Tumores malignos de cerebro primarios | Orfo | Non | |
| Úlceras aftosas recorrentes | Orfo | Non |
Historia
[editar | editar a fonte]A talidomida foi desenvolvida pola compañía farmacéutica alemá Chemie Grünenthal (agora Grünenthal GmbH).[3][64] Despois de obter unha patente de vinte anos en abril de 1954, Chemie Grünenthal empezou a realizar ensaios clínicos e xa en novembro de 1956 empezou a comercializar a talidomida para o tratamento de infeccións respiratorias co nome de marca Grippex, que era unha combinación de fármacos que contiña talidomida, quinina, vitamina C, fenactina e ácido acetilsalicílico.
Os investigadores de Chemie Grünenthal tamén atoparon que a talidomida era un antiemético especialmente efectivo, que inhibía o efecto dos mareos matutinos das embarazadas.[33] Por tanto, en outubro de 1957, a compañía lanzou a talidomida ao mercado e empezou a comercializala agresivamente baixo o nome comercial de Contergan®.[65] Foi proclamada "medicina marabilla" para o insomnio, tose, arrefriados e dor de cabeza.
Durante este período, o uso de medicamentos durante o embarazo non estaba estritamente controlado, e non se comprobou exhaustivamente se o fármaco podía producir danos potenciais para o feto.[33] Miles de mulleres preñadas tomaron este fármaco para aliviar os seus síntomas. No momento do desenvolvemento do fármaco, os científicos non crían que os fármacos que tomaban as mulleres embarazadas puidesen atravesar a barreira placentaria (que separa as circulacións sanguíneas materna e fetal) e que puidesen danar ao feto en desenvolvemento,[5] a pesar de que o efecto do alcohol sobre o desenvolvemento do feto xa estaba documentado en estudos de casos de nais alcohólicas desde polo menos 1957.[66] Axiña apareceron informes de descubrimentos de anormalidades en nenos nacidos naquela época, que foron rastrexados ata relacionalos co uso da talidomida. A finais de 1959, detectouse que se orixinaba neurite periférica en pacientes que tomaran o fármaco durante un período de tempo, e só despois disto a talidomida deixou de ser vendida sen receita.[67]
Por tanto, aínda que inicialmente se consideraba segura, o fármaco era responsable de deformidades teratoxénicas en nenos nacidos de nais que usaron a talidomida durante o embarazo, antes do terceiro trimestre. En novembro de 1961, a talidomida foi retirada do mercado. Os expertos estiman que a talidomida causou a morte de aproximadamente 2.000 nenos e graves defectos de nacemento a máis de 10.000 nenos, aproximadamente 5.000 deles en Alemaña Occidental. As autoridades reguladoras de Alemaña Oriental non aprobaron a talidomida.[3] Unha razón para os efectos secundarios do fármaco non fosen observados inicialmente e da subseguinte aprobación en Alemaña Occidental foi que daquela os fármacos non tiñan que ser probados para os seus posibles efectos teratoxénicos. Fora probada só en roedores, como era o normal naquel tempo.[68]
A talidomida converteuse nun dos fármacos de prescrición de máis éxito na historia da medicina e a publicidade salientaba as súas grandes cualidades. Por exemplo, no Reino Unido vendeuse co nome Distaval® como remedio para os mareos matutinos de embarazadas e anunciábase dicindo "Distaval pode administrarse con completa seguridade a mulleres embarazadas e nais lactantes sen efectos adversos para a nai ou o neno... A extraordinariamente segura Distaval foi prescrita durante case tres anos neste país" ("Distaval can be given with complete safety to pregnant women and nursing mothers without adverse effect on mother or child...Outstandingly safe Distaval has been prescribed for nearly three years in this country.")[3] Por todo o mundo, moitas compañías farmacéuticas empezaron a producir e vender a talidomida con licenza de Chemie Grünenthal. A mediados da década de 1950, 14 compañías farmacéuticas comercializaban a talidomida en 46 países con decenas de nomes comerciais.
En España vendeuse a talidomia desde finais da década de 1950 deica principios da de 1960. O fármaco non se retirou "oficialmente" de forma efectiva ata 1963 (na maior parte do mundo en 1961). Vendéronse en España 10 fármacos que contiñan talidomida, que foron: Imidan, Varial, Gluto Naftil, Softenon, Noctosediv, Entero-Sediv, Entero-Sediv suspensio, Insonid 25, Insonid 100 e Insonid 50. O número de afectados non se sabe con exactitude, pero na páxina web da Asociación de afectados (AVITE) dan a cifra de arredor de 3.000[69], pero só uns 300 seguían vivos en 2015.[69][70] A compañía Grünenthal foi condenada en España a pagar unha indemnización ás vítimas en 2013, pero esta sentenza foi revogada en 2014 porque os feitos estaban prescritos.[71]

Non en todos os países foi igual. Nos Estados Unidos a FDA rexeitou aprobar a comercialización e distribución da talidomida. Porén, o fármaco foi distribuído en grandes cantidades para realizar probas científicas, unha vez que a compañía Richardson-Merrell (que chegara a un acordo en 1958 coa alemá Chemie Grünenthal) solicitara a súa aprobación en 1960. A funcionaria encargada de levar o asunto na FDA foi Frances Oldham Kelsey, que solicitou á compañía facer máis probas antes da súa aprobación. A compañía negouse e presentou seis veces máis a solicitude, a cal foi sempre rexeitada. Aínda así, un total de 17 nenos naceron en USA con malformacións debidas á talidomida en usos experimentais.[72][73] Finalmente Kelsey recibiu en 1962 de mans de John F. Kennedy o Premio Presidencial por Servizos Distinguidos de Funcionarios Federais pola súa correcta denegación dos permisos para talidomida a pesar das presións exercidas pola compañía Richardson-Merrell. En 2010, a FDA creou o premio Kelsey, que se outorga cada ano a un funcionario distinguido da axencia.[74]
Crise das deformidades no nacemento
[editar | editar a fonte]
A finais da década de 1950 e inicios da de 1960 máis de 10.000 nenos en 46 países naceron con deformidades como a focomelia como consecuencia do uso da talidomida.[75] En realidade, non se sabe exactamente o número de vítimas en todo o mundo, aínda que as estimacións van de 10.000 a 20.000.[47] A pesar dos seus efectos secundarios, a talidomida vendeuse en farmacias en países como Canadá ata 1962,[34][76] e en España non se retirou oficialmente ata 1963[69] Moitos destes nenos con deformidades morrían ao pouco tempo de nacer. Por exemplo, no Reino Unido o fármaco obtivo licenza en 1958 e foi retirado en 1961. Dos aproximadamente 2.000 nenos británicos nacidos con defectos arredor da metade morreu aos poucos meses de nacer e 466 sobreviviran ata polo menos o ano 2010.[77]
O obstetra australiano William McBride e o pediatra alemán Widukind Lenz sospeitaban que había unha conexión entre estes defectos de nacemento e a talidomida, unha teoría que Lenz conseguiu probar en 1961.[78][79] McBride recibiu máis tarde diversos galardóns, como a medalla e premio do Institut de la Vie de París.[80]
En Alemaña Oriental, o xefe da comisión de control de farmacia central Friedrich Jung, sospeitaba que a talidomida tiña un efecto antivitamínico como derivado do ácido glutámico e a talidomida non foi aprobada alí.[81] Mentres tanto, en Alemaña Occidental, pasou certo tempo antes de que o incremento de dismelia producido a finais da década de 1950 fose asociado coa talidomida. En 1958 Karl Beck, un antigo pediatra de Bayreuth escribiu un artigo nun xornal local denunciando unha relación entre as probas de armas nucleares e os casos de dismelia en nenos.[82] Baseándose nisto, o xefe do grupo parlamentario do FDP Erich Mende solicitou que o goberno federal fixese unha declaración oficial.[82] Por razóns estatísticas, as principais series de datos utilizadas para investigar os caos de dismelia empezaban por casualidade ao mesmo tempo que a data de aprobación da talidomida, e non había datos anteriores.[82] Despois de que durante o período nazi coa Lei de Prevención de Descendencia con Enfermidades Hereditarias se utilizasen os datos estatísticos obrigatorios para cometer crimes contra a poboación, en Alemaña Occidental había unha gran reticencia a monitorizar estatisticamente de forma estrita os trastornos conxénitos.[83] En consecuencia, o informe parlamentario rexeitou calquera relación entre a radioactividade e o incremento anormal de dismelia.[82] Ademais o proxecto de investigación DFG iniciado despois da solicitude de Mende non foi de utilidade. O proxecto foi liderado polo patólogo Franz Büchner que dirixiu o proxecto a propagar a súa teoría teratolóxica. Büchner coidaba que a falta dunha nutrición saudable e o comportamento das nais era máis importante que as causas xenéticas.[83] Ademais, tardouse bastante en Alemaña en crear a figura do Cirurxián Xeral, xa que o Ministerio Federal de Sanidade non se creou ata 1962, varios meses despois de que a venda da talidomida fose prohibida.[79][82]
Varios países puxeron restricións a este fármaco ou nunca o aprobaron. O membro da conferencia de admisión farmacéutica de Austria Ingeborg Eichler, obrigou a que a talidomida (co nome comercial Softenon) fose vendida só con prescrición médica, e o resultado foi que houbo un número de afectados relativamente baixo en Austria e Suíza.[84]
Consecuencias legais
[editar | editar a fonte]En 1968, iniciouse en Alemaña un gran proceso criminal no que se acusaba a varios empregados da compañía Grünenthal de homicidio por imprudencia e lesións.
Pero unha vez que Grünenthal chegou a un acordo coas vítimas en abril de 1970, o proceso finalizou en decembro de 1970 cunha sentenza de non culpabilidade. Como parte do acordo, Grünenthal pagou 100 millóns de marcos a unha fundación especialmente creada; despois, o goberno alemán engadiu outros 320 millóns. A fundación pagou ás vítimas unha suma entre 2.500 e 25.000 marcos (dependendo da gravidade da incapacidade) e ademais un pago mensual entre 100 e 450 marcos. Este pago mensual foi desde entón elevado substancialmente e agora é pagado enteiramente polo goberno (xa que a fundación quedou sen cartos). Grünenthal pagou outros 50 millóns de euros á fundación en 2008.

En Reino Unido, en 1968, despois dunha longa campaña iniciada polo The Sunday Times, as vítimas chegaron a un acordo de compensación coa compñaía Distillers Company (agora parte de Diageo), que distribuíra o fármaco en ReinoUnido.[87][88] Esta compensación é distribuída polo Thalidomide Trust e foi substancialmente incrementada por Diageo en 2005.[89] O goberno deulle aos sobreviventes unha bolsa de 20 millóns de libras en 2009, que é distribuída polo Thalidomide Trust.[90]
O 31 de agosto de 2012, o executivo xefe de Grünenthal Harald F. Stock, que foi executivo xefe de Grünenthal GmbH desde xaneiro de 2009 a maio de 2013 e foi membro do comité executivo da compañía ata maio de 2013, pediu desculpas por primeira vez pola produción do fármaco e permanecer en silencio sobre as malformacións conxénitas.[91] Nunha cerimonia, Stock destapou unha estatua dun neno eivado que simbolizaba a todos os que foroan prexudicados pola talidomida e desculpouse por non ter tratado de contactar coas vítimas durante 50 anos. No momento desta petición de desculpas aínda había entre 5.000 e 6.000 afectados vivos. Porén, os avogados das vítimas consideraron que a desculpa era "insultante" e que era "demasiado pouco e demasiado tarde", e criticaron á compañía por non compensar ás vítimas. Tamén criticaron á compañía pola súa afirmación de que ninguén podía saber daquela os danos que podía causar este medicamento, argumentando que naquela época xa había moitos datos alarmantes de aviso.[92]
En España o Real Decreto 1006/2010 regulaba a concesión de axudas no ano 2010 aos afectados pola talidomida en España entre 1960 e 1965.[93] A moitos afectados foille moi difícil probar que tomaran a talidomida despois de pasado tanto tempo. Os afectados iniciaron ademais accións legais contra a compañía alemá e como resultado obtiveron inicialmente unha sentenza favorable en 2013, na que se condenaba á compañía a pagar aos afectados unha indemnización de 20.000 euros por cada punto porcentual de minusvalía, pero só se beneficiaban 24 afectados (os que foran recoñecidos no Real Decreto de 2010) sempre que non estivesen recibindo axudas da Fundación Contergan creada pola compañía.[94]. Porén, a compañía recorreu e en 2014 a sentenza foi revogada porque os feitos estaban prescritos.[95] Os afectados recorreron ao tribunal supremo que fixou a data do 23 de setembro de 2015 para ditar sentenza.[96] Os afectados tamén levaron a cabo iniciativas perante o Parlamento Europeo. O 5 de maio de 2015 o presidente do Parlamento Europeo, Martin Schulz, recibiu ao presidente de AVITE, que solicitou que os afectados españois teñan a mesma indemnización que os alemáns.[97] O 27 de maio de 2015 todos os grupos do Parlamento Europeo mostraron o seu apoio aos afectados pola talidomida en Europa e reclamaron a Alemaña que os reciba nas súas embaixadas e lles ofreza reparacións.[98]
Cambios na regulación dos fármacos
[editar | editar a fonte]O desastre promoveu en moitos países a introdución de regras máis estritas para as probar os fármacos e outorgarlles licenza, como a Directiva 65/65/EEC1 da Unión Europea[99] ou a Emenda Kefauver Harris[100] nos Estados Unidos, e as novas regulacións da FDA, que esixían aos solicitantes de licenzas probar a eficacia e a ausencia de efectos secundarios dos fármacos,[75] e mesmo a FDA iniciou estudos para reclasificar os fármacos que xa estaban no mercado.
Investigacións
[editar | editar a fonte]Os usos experimentais da talidomida son:
- Síndrome de debilitamento da SIDA,[101] diarrea asociada[102] e sarcoma de Kaposi.[59]
- Carcinoma de célula renal (RCC)[59][103]
- Glioblastoma multiforme[59]
- Cancro de próstata[59]
- Melanoma[59]
- Cancro colorrectal[59]
- Enfermidade de Crohn[59]
- Artrite reumatoide[59]
- Síndrome de Behcet[104]
- Cancro de mama[59]
- Cancro de pescozo e cabeza[59]
- Cancro de ovario[59]
- Insuficiencia cardíaca crónica[59]
- Enfermidade de enxerto contra hóspede.[59]
Notas
[editar | editar a fonte]- ↑ "Thalidomide". Oxford English Dictionary (3rd ed.). Oxford University Press. Setembro de 2005. [1] Arquivado 30 de xuño de 2015 en Wayback Machine.
- ↑ Miller, Marylin T. (1991). "Thalidomide Embryopathy: A Model for the Study of Congenital Incomitant Horizontal Strabismus". Transaction of the American Ophthalmological Society 81: 623–674.
- ↑ 3,0 3,1 3,2 3,3 "Reversal of Fortune: How a Vilified Drug Became a Life-saving Agent in the "War" Against Cancer - Onco'Zine - The International Cancer Network (3o de novembro de 30, 2013)". Arquivado dende o orixinal o 03 de xaneiro de 2014. Consultado o 28 de xuño de 2015.
- ↑ Cuthbert, Alan (2001, 2003). The Oxford Companion to the Body. Oxford University Press. Consultado o 26 de febreiro de 2012.
- ↑ 5,0 5,1 Heaton, C. A. (1994). The Chemical Industry. Springer. p. 40. ISBN 0-7514-0018-1.
- ↑ "Thalidomide". The American Society of Health-System Pharmacists. Consultado o xuño de 2014.
- ↑ Srinivasan R, Akobeng AK (Apr 15, 2009). "Thalidomide and thalidomide analogues for induction of remission in Crohn's disease.". The Cochrane database of systematic reviews (2): CD007350. PMID 19370684. doi:10.1002/14651858.CD007350.pub2.
- ↑ Akobeng AK, Stokkers PC (Apr 15, 2009). "Thalidomide and thalidomide analogues for maintenance of remission in Crohn's disease.". The Cochrane database of systematic reviews (2): CD007351. PMID 19370685. doi:10.1002/14651858.CD007351.pub2.
- ↑ Silverman WA (agosto de 2002). "The schizophrenic career of a 'monster drug'". Pediatrics 110 (2 Pt 1): 404–6. PMID 12165600. doi:10.1542/peds.110.2.404.
- ↑ Castilla EE, Ashton-Prolla P, Barreda-Mejia E, Brunoni D, Cavalcanti DP, Correa-Neto J, Delgadillo JL, Dutra MG, Felix T, Giraldo A, Juarez N, Lopez-Camelo JS, Nazer J, Orioli IM, Paz JE, Pessoto MA, Pina-Neto JM, Quadrelli R, Rittler M, Rueda S, Saltos M, Sánchez O, Schüler L (decembro de 1996). "Thalidomide, a current teratogen in South America". Teratology 54 (6): 273–7. PMID 9098920. doi:10.1002/(SICI)1096-9926(199612)54:6<273::AID-TERA1>3.0.CO;2-# (inactivo 2015-01-09).
- ↑ Paumgartten FJ, Chahoud I (xullo de 2006). "Thalidomide embryopathy cases in Brazil after 1965". Reprod. Toxicol. 22 (1): 1–2. PMID 16427249. doi:10.1016/j.reprotox.2005.11.007.
- ↑ Correio Braziliense (xaneiro de 2006). "Talidomida volta a assustar". Arquivado dende o orixinal o 13 de marzo de 2012. Consultado o 28 de xuño de 2015.
- ↑ Crawford, Angus (23 de xullo de 2013). "Brazil's new generation of Thalidomide babies". BBC News.
- ↑ 14,0 14,1 Sheryl Gay Stolberg (17 de xullo de 1998). "Thalidomide Approved to Treat Leprosy, With Other Uses Seen". New York Times. Consultado o 8 de xaneiro de 2012.
- ↑ Anon. "Use of thalidomide in leprosy". WHO:leprosy elimination. WHO. Consultado o 22 de abril de 2010.
- ↑ 16,0 16,1 Singhal S, Mehta J, Desikan R, Ayers D, Roberson P, Eddlemon P, Munshi N, Anaissie E, Wilson C, Dhodapkar M, Zeddis J, Barlogie B (novembro de 1999). "Antitumor activity of thalidomide in refractory multiple myeloma". N. Engl. J. Med. 341 (21): 1565–71. PMID 10564685. doi:10.1056/NEJM199911183412102.
- ↑ Nguyen M, Watanabe H, Budson AE, Richie JP, Hayes DF, Folkman J (marzo de 1994). "Elevated levels of an angiogenic peptide, basic fibroblast growth factor, in the urine of patients with a wide spectrum of cancers". J. Natl. Cancer Inst. 86 (5): 356–61. PMID 7508518. doi:10.1093/jnci/86.5.356.
- ↑ Vacca A, Ribatti D, Roncali L, Ranieri G, Serio G, Silvestris F, Dammacco F (xullo de 1994). "Bone marrow angiogenesis and progression in multiple myeloma". Br. J. Haematol. 87 (3): 503–8. PMID 7527645. doi:10.1111/j.1365-2141.1994.tb08304.x.
- ↑ David Altman (2013-04-02). "From thalidomide to Pomalyst: Better living through chemistry — Vector". Vectorblog.org. Arquivado dende o orixinal o 07 de xaneiro de 2014. Consultado o 2013-05-22.
- ↑ Gieseler F (xuño de 2008). "Pathophysiological considerations to thrombophilia in the treatment of multiple myeloma with thalidomide and derivates". Thromb. Haemost. 99 (6): 1001–7. PMID 18521500. doi:10.1160/TH08-01-0009.
- ↑ Denz U, Haas PS, Wäsch R, Einsele H, Engelhardt M (xullo de 2006). "State of the art therapy in multiple myeloma and future perspectives". Eur. J. Cancer 42 (11): 1591–600. PMID 16815703. doi:10.1016/j.ejca.2005.11.040.
- ↑ Haas PS, Denz U, Ihorst G, Engelhardt M (abril de 2008). "Thalidomide in consecutive multiple myeloma patients: single-center analysis on practical aspects, efficacy, side effects and prognostic factors with lower thalidomide doses". Eur. J. Haematol. 80 (4): 303–9. PMID 18182082. doi:10.1111/j.1600-0609.2007.01022.x.
- ↑ Bennett CL, Angelotta C, Yarnold PR, Evens AM, Zonder JA, Raisch DW, Richardson P (decembro de 2006). "Thalidomide- and lenalidomide-associated thromboembolism among patients with cancer". JAMA 296 (21): 2558–60. PMID 17148721. doi:10.1001/jama.296.21.2558-c.
- ↑ "FDA Approval for Thalidomide". National Cancer Institute. Arquivado dende o orixinal o 28 de xaneiro de 2012. Consultado o 8 de xaneiro de 2012.
- ↑ 25,0 25,1 "THALOMID (thalidomide) capsule [Celgene Corporation]". DailyMed. Celgene Corporation. n novembro de 2013. Consultado o 17 de xaneiro de 2014.
- ↑ 26,0 26,1 "Thalomid (thalidomide) dosing, indications, interactions, adverse effects, and more". Medscape Reference. WebMD. Consultado o 17 de xaneiro de 2014.
- ↑ 27,0 27,1 "Thalidomide Celgene 50 mg Hard Capsules". electronic Medicines Compendium. Celgene Ltd. 1 de agosto de 2013. Consultado o 17 de xaneiro de 2014.
- ↑ 28,00 28,01 28,02 28,03 28,04 28,05 28,06 28,07 28,08 28,09 28,10 "THALOMID® CAPSULES" (PDF). TGA eBusiness Services. Celgene Pty Limited. 21 de xuño de 2013. Consultado o 17 de xaneiro de 2014.
- ↑ The Myeloma Beacon Staff (8 de abril de 2011). "FDA Announces Investigation Into Revlimid, Thalidomide, And Secondary Cancers". The Myeloma Beacon. Consultado o 17 de xaneiro de 2014.
- ↑ Usmani, Saad Z.; Sexton, Rachel; Hoering, Antje; Heuck, Christoph J.; Nair, Bijay; Waheed, Sarah; Al Sayed, Yazan; Chauhan, Nabeel; Ahmad, Nisar (2012-08-23). "Second malignancies in total therapy 2 and 3 for newly diagnosed multiple myeloma: influence of thalidomide and lenalidomide during maintenance". Blood (en inglés) 120 (8): 1597–1600. ISSN 0006-4971. PMC 3429303. PMID 22674807. doi:10.1182/blood-2012-04-421883.
- ↑ "Thalidomide: risk of second primary malignancies". Medicines and Healthcare products Regulatory Agency. maio de 2013. Consultado o 17 de xaneiro de 2014.
- ↑ "Thalidomide drug label to warn of cancer risk". CBC News. 22 de maio de 2013.
- ↑ 33,0 33,1 33,2 Franks ME, Macpherson GR, Figg WD (maio de 2004). "Thalidomide". Lancet 363 (9423): 1802–11. PMID 15172781. doi:10.1016/S0140-6736(04)16308-3.
- ↑ 34,0 34,1 Webb JF (novembro de 1963). "Canadian Thalidomide Experience". Can Med Assoc J 89: 987–92. PMC 1921912. PMID 14076167.
- ↑ 35,0 35,1 Kim JH, Scialli AR (xullo de 2011). "Thalidomide: The Tragedy of Birth Defects and the Effective Treatment of Disease" (PDF). Toxicological Sciences 122 (1): 1–6. PMID 21507989. doi:10.1093/toxsci/kfr088.
- ↑ 36,0 36,1 36,2 36,3 Singhal S, Mehta J (Febreiro de 2002). "Thalidomide in cancer". Biomedicine & Pharmacotherapy 56 (1): 4–12. PMID 11905508. doi:10.1016/S0753-3322(01)00146-9.
- ↑ Sarno EN, Grau GE, Vieira LM, Nery JA (abril de 1991). "Serum levels of tumour necrosis factor-alpha and interleukin-1 beta during leprosy reactional states". Clin. Exp. Immunol. 84 (1): 103–8. PMC 1535359. PMID 2015700. doi:10.1111/j.1365-2249.1991.tb08131.x.
- ↑ Stephens TD, Bunde CJ, Fillmore BJ (xuño de 2000). "Mechanism of action in thalidomide teratogenesis". Biochem. Pharmacol. 59 (12): 1489–99. PMID 10799645. doi:10.1016/S0006-2952(99)00388-3.
- ↑ 39,0 39,1 D'Amato RJ, Loughnan MS, Flynn E, Folkman J (1994). "Thalidomide is an inhibitor of angiogenesis". Proceedings of the National Academy of Sciences of the United States of America 91 (9): 4082–4085. Bibcode:1994PNAS...91.4082D. PMC 43727. PMID 7513432. doi:10.1073/pnas.91.9.4082.
- ↑ Therapontos C, Erskine L, Gardner ER, Figg WD, Vargesson N (maio de 2009). "Thalidomide induces limb defects by preventing angiogenic outgrowth during early limb formation". Proc. Natl. Acad. Sci. U.S.A. 106 (21): 8573–8. Bibcode:2009PNAS..106.8573T. JSTOR 40482723. PMC 2688998. PMID 19433787. doi:10.1073/pnas.0901505106.
- ↑ 41,0 41,1 Teo SK, Colburn WA, Tracewell WG, Kook KA, Stirling DI, Jaworsky MS, Scheffler MA, Thomas SD, Laskin OL (2004). "Clinical pharmacokinetics of thalidomide". Clin Pharmacokinet 43 (5): 311–27. PMID 15080764. doi:10.2165/00003088-200443050-00004.
- ↑ Eriksson T, Björkman S, Roth B, Fyge A, Höglund P (1995). "Stereospecific determination, chiral inversion in vitro and in humans of the enantiomers of thalidomide". Chirality 7 (1): 44–52. PMID 7702998. doi:10.1002/chir.530070109.
- ↑ 43,0 43,1 Muller GW, Corral LG, Shire MG, Wang H, Moreira A, Kaplan G, Stirling DI (agosto de 1996). "Structural modifications of thalidomide produce analogs with enhanced tumor necrosis factor inhibitory activity". J. Med. Chem. 39 (17): 3238–40. PMID 8765505. doi:10.1021/jm9603328.
- ↑ Man HW, Corral LG, Stirling DI, Muller GW (outubro de 2003). "Alpha-fluoro-substituted thalidomide analogues". Bioorg. Med. Chem. Lett. 13 (20): 3415–7. PMID 14505639. doi:10.1016/S0960-894X(03)00778-9.
- ↑ Bartlett JB, Dredge K, Dalgleish AG (abril de 2004). "The evolution of thalidomide and its IMiD derivatives as anticancer agents". Nat. Rev. Cancer 4 (4): 314–22. PMID 15057291. doi:10.1038/nrc1323.
- ↑ Man HW, Schafer P, Wong LM, Patterson RT, Corral LG, Raymon H, Blease K, Leisten J, Shirley MA, Tang Y, Babusis DM, Chen R, Stirling D, Muller GW (marzo de 2009). "Discovery of (S)-N-[2-[1-(3-ethoxy-4-methoxyphenyl)-2-methanesulfonylethyl]-1,3-dioxo-2,3-dihydro-1H-isoindol-4-yl] acetamide (apremilast), a potent and orally active phosphodiesterase 4 and tumor necrosis factor-alpha inhibitor". J. Med. Chem. 52 (6): 1522–4. PMID 19256507. doi:10.1021/jm900210d.
- ↑ 47,0 47,1 Zimmer C (15 de marzo de 2010). "Answers Begin to Emerge on How Thalidomide Caused Defects". New York Times. Consultado o 2010-03-21.
Como informan no número actual de Science, unha proteína coñecida como cereblon acoplada estreitamente á talidomida
- ↑ Mahony C, Erskine L, Niven J, Greig NH, Figg WD, Vargesson N (2013). "Pomalidomide is nonteratogenic in chicken and zebrafish embryos and nonneurotoxic in vitro". Proc. Natl. Acad. Sci. U.S.A. 110 (31): 12703–8. PMC 3732931. PMID 23858438. doi:10.1073/pnas.1307684110.
- ↑ Lopez-Girona A, Mendy D, Ito T, Miller K, Gandhi AK, Kang J, Karasawa S, Carmel G, Jackson P, Abbasian M, Mahmoudi A, Cathers B, Rychak E, Gaidarova S, Chen R, Schafer PH, Handa H, Daniel TO, Evans JF, Chopra R (2012). "Cereblon is a direct protein target for immunomodulatory and antiproliferative activities of lenalidomide and pomalidomide". Leukemia 26 (11): 2326–35. PMC 3496085. PMID 22552008. doi:10.1038/leu.2012.119.
- ↑ Shah JH, Swartz GM, Papathanassiu AE, Treston AM, Fogler WE, Madsen JW, Green SJ (1999). "Synthesis and enantiomeric separation of 2-phthalimidino-glutaric acid analogues: potent inhibitors of tumor metastasis". J. Med. Chem. 42 (16): 3014–7. PMID 10447943. doi:10.1021/jm990083y.
- ↑ D'Amato RJ, Lentzsch S, Anderson KC, Rogers MS (2001). "Mechanism of action of thalidomide and 3-aminothalidomide in multiple myeloma". Seminars in Oncology 28 (6): 597–601. PMID 11740816. doi:10.1016/S0093-7754(01)90031-4.
- ↑ Rao KV (setembro de 2007). "Lenalidomide in the treatment of multiple myeloma". Am J Health Syst Pharm 64 (17): 1799–807. PMID 17724360. doi:10.2146/ajhp070029.
- ↑ "Search of: pomalidomide". Clinicaltrials.gov. Consultado o 2012-09-01.
- ↑ Raghupathy R, Billett HH (marzo de 2009). "Promising therapies in sickle cell disease". Cardiovasc Hematol Disord Drug Targets 9 (1): 1–8. PMID 19275572. doi:10.2174/187152909787581354.
- ↑ "Pomalyst (Pomalidomide) Approved By FDA For Relapsed And Refractory Multiple Myeloma". The Myeloma Beacon. Arquivado dende o orixinal o 07 de xaneiro de 2014. Consultado o 2013-08-10.
- ↑ "Pomalidomide Approved In Europe For Relapsed And Refractory Multiple Myeloma". The Myeloma Beacon. Arquivado dende o orixinal o 18/01/2014. Consultado o 10/8/2013.
- ↑ "Thalidomide Celgene : EPAR - Product Information" (PDF). European Medicines Agency. Celgene Europe Limited. 29 de agosto de 2013. Arquivado dende o orixinal (PDF) o 03 de xullo de 2015. Consultado o 19 de xaneiro de 2014.
- ↑ Lewis, R (26 novembro de 2013). "Thalidomide Induced Remission in Early-Onset Crohn's Disease". Medscape Medical News. WebMD. Consultado o 19 de xaneiro de 2014.
- ↑ 59,00 59,01 59,02 59,03 59,04 59,05 59,06 59,07 59,08 59,09 59,10 59,11 59,12 59,13 59,14 59,15 Franks ME, Macpherson GR, Figg WD (maio de 2004). "Thalidomide". Lancet 363 (9423): 1802–1811. PMID 15172781. doi:10.1016/S0140-6736(04)16308-3.
- ↑ Okafor, MC (2003). "Thalidomide for Erythema Nodosum Leprosum and Other Applications". Medscape Medical News. WebMD. Consultado o 19 de xaneiro de 2014.
- ↑ Waters MF (marzo de 1971). "An internally-controlled double blind trial of thalidomide in severe erythema nodosum leprosum". Leprosy Review 42 (1): 26–42. PMID 4338720.
- ↑ Villahermosa LG, Fajardo TT, Abalos RM, Balagon MV, Tan EV, Cellona RV, Palmer JP, Wittes J, Thomas SD, Kook KA, Walsh GP, Walsh DS (Maio de 2005). "A randomized, double-blind, double-dummy, controlled dose comparison of thalidomide for treatment of erythema nodosum leprosum" (PDF). The American Journal of Tropical Medicine and Hygiene 72 (5): 518–526. PMID 15891124. Arquivado dende o orixinal (PDF) o 04 de setembro de 2015. Consultado o 28 de xuño de 2015.
- ↑ Rose, LJ; Fishman, AD; Sparano, JA (11 de marzo de 2013). Talavera, F; McKenna, R; Harris, JE, ed. "Kaposi Sarcoma Treatment & Management". Medscape Reference. WebMD. Consultado o 19 de xaneiro de 2014.
- ↑ "Thalidomide's Secret Past: The Link with Nazi Germany -Onco'Zine - The International Oncology Network (30 de novembro de 2013)". Arquivado dende o orixinal o 03 de xaneiro de 2014. Consultado o 28 de xuño de 2015.
- ↑ Moghe VV, Kulkarni U, Parmar UI (2008). "Thalidomide" (PDF). Bombay Hospital Journal (Bombay: Bombay Hospital) 50 (3): 473. Arquivado dende o orixinal (PDF) o 22 de xullo de 2011. Consultado o 28 de xuño de 2015.
- ↑ Ver Rouquette (1957) citado por Landesman-Dwyer S (1982). "Maternal drinking and pregnancy outcome". Appl Res Ment Retard 3 (3): 241–63. PMID 7149705. doi:10.1016/0270-3092(82)90018-2.
- ↑ Kelsey FO (1967). "Events after thalidomide". J. Dent. Res. 46 (6): 1201–5. PMID 5235007. doi:10.1177/00220345670460061201.
- ↑ VFA: teratogenic effects 6. Xullo de 2011.
- ↑ 69,0 69,1 69,2 AVITE. Asociación de Víctimas de la Talidomida en España y otras Incapacidades AVITE
- ↑ Scott, Caroline; Haupt, Oliver (3 de maio de 2015). "The forgotten victims". The Sunday Times Magazine. pp. 12–19. Arquivado dende o orixinal o 27 de maio de 2015. Consultado o 8 de maio de 2015.
- ↑ El País. La Audiencia anula la indemnización a los afectados por la talidomida [2]
- ↑ Informe na páxina web de FDA norteamericana.
- ↑ Mekdeci, Betty. "Bendectin Part 1 (PDF link) How a Commonly Used Drug Caused Birth Defects". Arquivado dende o orixinal o 18 de decembro de 2013. Consultado o 28 de xuño de 2015.
- ↑ "The Public's Quiet Savior From Harmful Medicines". The New York Times. 13 de setembro de 2010.
- ↑ 75,0 75,1 Bren L (2001-02-28). "Frances Oldham Kelsey: FDA Medical Reviewer Leaves Her Mark on History". FDA Consumer (U.S. Food and Drug Administration). Consultado o 2009-12-23.
- ↑ "Turning Points of History–Prescription for Disaster". History Television. Arquivado dende o orixinal o 29 de setembro de 2011. Consultado o 24 de febreiro de 2010.
- ↑ "Apology for thalidomide survivors". BBCNews:Health (BBC News). 14 de xaneiro de 2010. Consultado o 14/1/2010.
- ↑ Anon. "Widukind Lenz". who name it?. Ole Daniel Enersen. Consultado o 1/5/2009.
- ↑ 79,0 79,1 Anon (7/6/2002). "Thalidomide:40 years on". BBC news (BBC). Consultado o 2009-05-01.
- ↑ "Report of Thalidomide at University of New South Wales". Embryology.med.unsw.edu.au. Arquivado dende o orixinal o 28 de outubro de 2012. Consultado o 2012-12-30.
- ↑ "DDR-Bürger schliefen ohne Contergan" [East German citizens slept without thalidomide]. Neues Deutschland (en alemán). 4 de novembro de 2007. Consultado o 6 de xuño de 2013.
- ↑ 82,0 82,1 82,2 82,3 82,4 Thomann, Klaus-Dieter (2007). "Die Contergan-Katastrophe: Die trügerische Sicherheit der "harten" Daten" [The thalidomide disaster: The false security of 'hard' data]. Deutsches Ärzteblatt (en alemán) 104 (41): A–2778 / B–2454 / C–2382. Arquivado dende o orixinal o 13 de xullo de 2015. Consultado o 6 de xuño de 2013.
- ↑ 83,0 83,1 Die Contergankatastrophe: Eine Bilanz Nach 40 Jahren, Ludwig Zichner, Michael A. Rauschmann, Klaus-Dieter Thomann, Gabler Wissenschaftsverlage, 2005 – 190 Seiten
- ↑ "10.000 Fälle von Missbildungen" [10,000 cases of malformations] (en alemán). ORF. Arquivado dende o orixinal o 14 de agosto de 2009. Consultado o 6 de xuño de 2013.
- ↑ "NoBody's Perfect (2008): Release Info". IMDB. Consultado o 6 de xuño de 2013.
- ↑ Brussat, Frederic; Brussat, Mary Ann. "Film Review: NoBody's Perfect". Spirituality & Practice. Consultado o 6 de xuño de 2013.
- ↑ Ryan, Caroline (1 de abril de 2004). "They just didn't know what it would do". BBC News:Health (BBC news). Consultado o 2009-05-01.
- ↑ Flintoff, John-Paul (23 de marzo de 2008). "Thalidomide: the battle for compensation goes on". The Sunday Times (London: Times Newspapers Ltd.). Arquivado dende o orixinal o 13 de maio de 2008. Consultado o 2009-05-01.
- ↑ "Compensation offer on Thalidomide". BBC News. 7 de xullo de 2005. Consultado o 26 de xullo de 2011.
- ↑ "Thalidomide survivors to get £20m". BBC News. 23 de decembro de 2009. Consultado o 26 de xullo de 2011.
- ↑ "Speech on the occasion of the inauguration of Thalidomide-Memorial; Grünenthal GmbH Website (consultado o 3 de decembro de 2013)". Arquivado dende o orixinal o 01 de setembro de 2012. Consultado o 28 de xuño de 2015.
- ↑ "Thalidomide apology insulting, campaigners say". BBC News. 1 de setembro de 2012.
- ↑ BOE númeo 190 do 6 de agosto de 2010. Real Decreto 1006/2010, de 5 de agosto, por el que se regula el procedimiento de concesión de ayudas a las personas afectadas por la talidomida en España durante el período 1960-1965. [3]
- ↑ El Mundo. Las víctimas de la talidomida, contentas con la sentencia
- ↑ El Mundo. La Audiencia Provincial de Madrid anula la indemnización a los afectados por la talidomida. [4]
- ↑ "estusanidad. El "desempate" de la talidomida ya tiene fecha". Arquivado dende o orixinal o 04 de xullo de 2015. Consultado o 03 de xullo de 2015.
- ↑ La Opinión. A Coruña. El Parlamento Europeo apoya a las víctimas españolas de la talidomida. [5]
- ↑ El Confidencial. Eurodiputados piden a Alemania que reciba a afectados de talidomida. [6]
- ↑ "Thalidomide". National Health Service (England). Arquivado dende o orixinal o 03 de decembro de 2013. Consultado o 6 de xuño de 2013.
- ↑ "50 Years: The Kefauver-Harris Amendments". Food and Drug Administration (United States). Consultado o 6 de xuño de 2013.
- ↑ Gordon JN, Trebble TM, Ellis RD, Duncan HD, Johns T, Goggin PM (abril de 2005). "Effects of thalidomide on HIV-associated wasting syndrome: a randomized, double-blind, placebo-controlled clinical trial" (PDF). GUT 54 (4): 540–545. PMC 1774430. PMID 15753541. doi:10.1136/gut.2004.047563.
- ↑ Sharpstone D, Rowbottom A, Francis N, Tovey G, Ellis D, Barrett M, Gazzard B (xuño de 1997). "Thalidomide: a novel therapy for microsporidiosis". Gastroenterology 112 (6): 1823–1829. PMID 9178672. doi:10.1053/gast.1997.v112.pm9178672.
- ↑ Tunio MA, Hashmi A, Qayyum A, Naimatullah N, Masood R (setembro de 2012). "Low-dose thalidomide in patients with metastatic renal cell carcinoma". Journal of the Pakistan Medical Association 62 (9): 876–879. PMID 23139966.
- ↑ Hamuryudan V, Mat C, Saip S, Ozyazgan Y, Siva A, Yurdakul S, Zwingenberger K, Yazici H (marzo de 1998). "Thalidomide in the treatment of the mucocutaneous lesions of the Behcet Syndrome: a randomized, double-blind, placebo-controlled trial". Annals of Internal Medicine 128 (6): 443–450. PMID 9499327. doi:10.7326/0003-4819-128-6-199803150-00004.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Stephens, Trent; Brynner, Rock (2001-12-24). Dark Remedy: The Impact of Thalidomide and Its Revival as a Vital Medicine. Perseus Books. ISBN 0-7382-0590-7.
- Knightley, Phillip; Evans, Harold (1979). Suffer The Children: The Story of Thalidomide. New York: The Viking Press. ISBN 0-670-68114-8.
Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Rouhi, Maureen (2005). "Thalidomide". Chemical & Engineering News 83 (25): 122. doi:10.1021/cen-v083n025.p122 (inactivo 2015-01-09). Arquivado dende o orixinal o 04 de setembro de 2015. Consultado o 6 de xuño de 2013.
- Thalidomide — Lista anotada de ligazóns (con páxinas en inglés e alemán)
- WHO Pharmaceuticals Newsletter No. 2, 2003 – Ver páxina 11, artigo editorial (en inglés)
- Páxina web de Celgene sobre Thalomid (en inglés)
- The Return of Thalidomide BBC, 31/1/2005 (en inglés)
- The Thalidomide Trust (en inglés).
- Páxina web de The International Contergan Thalidomide Alliance (en inglés).
- "The Big Pitch: How would you conduct a campaign for the new Thalidomide Drugs?"Arquivado 19 de abril de 2012 en Wayback Machine., forum de profesionais da mercadotecnia farmacéutica e médica comentando como deberían enfocar as controversias sobre a talidomida.
- "The 50-year global cover-up" 26/7/2012 (en inglés).
