Western blot

O western blot (ás veces chamado inmunoblot de proteínas ou transferencia western) é unha técnica analítica moi utilizada para detectar proteínas específicas nunha mostra de homoxenado de tecidos ou extracto. Utiliza electroforese en xel para separar as proteínas nativas pola súa estrutura tridimensional ou proteínas desnaturalizadas pola lonxitude da súa cadea polipeptídica. As proteínas son despois transferidas a unha membrana (tipicamente de nitrocelulosa ou PVDF), polo que é unha técnica de blotting ou transferencia. Unha vez na membrana son marcadas con anticorpos específicos para a proteína diana.[1][2] O paso de electroforese en xel está incluído nas análises de western blot para resolver o problema da reactividade cruzada dos anticorpos.
Hai moitas empresas fornecedoras de reactivos que se especializan en proporcionar anticorpos (monoclonais e policlonais) contra decenas de miles de proteínas diferentes. Os anticorpos comerciais poden ser caros, aínda que o anticorpo non unido pode ser reutilizado en distintos experimentos. Este método úsase nos campos da bioloxía molecular, inmunoxenética e outras disciplinas da bioloxía molecular. Disponse de varios motores de busca, como CiteAb, Antibodypedia, e SeekProducts, que poden axudar aos investigadores a encontrar os anticorpos axeitados para o seu uso no western blot.
Outras técnicas relacionadas son a análise dot blot, a inmunohistoquímica e a inmunocitoquímica, onde se usan anticorpos para detectar proteínas en tecidos e células por inmunomarcaxe, e ensaio inmunoabsorbente de encima ligado (ELISA).
O método orixinouse no laboratorio de Harry Towbin no Friedrich Miescher Institute, en Suíza.[1] O nome western blot deullo a esta técnica W. Neal Burnette[3] facendo un xogo de palabras coa técnica coñecida anteriormente Southern blot e cos puntos cardinais xeográficos, a cal é unha técnica para a detección de ADN desenvolvida por Edwin Southern (o nome procede do seu apelido, polo que Southern blot se escribe con maiúscula). A detección de ARN denomínase northern blot e foi desenvolvida por George Stark na Universidade Stanford, en California.[4] O western blot non é necesario escribilo con maiúscula, xa que non procede dun apelido, pero moitas veces aparece escrito con maiúscula por analoxía coa técnica Southern.
Pasos a seguir
[editar | editar a fonte]Preparación dos tecidos
[editar | editar a fonte]As mostras poden tomarse de tecidos completos ou de cultivos celulares. Os tecidos sólidos son primeiro desfeitos mecanicamente usando unha batedora ou blender (para grandes volumes de mostra), ou utilizando un homoxenizador (para pequenos volumes), ou por sonicación. Tamén se pode facer romper as células para que vertan o seu contido por algún dos medios mecánicos antes mencionados. Porén, os virus ou as mostras ambientais poden ser a fonte das proteínas estudadas, polo que o western blot non está restrinxido só a estudos de células.
Hai un amplo surtido de deterxentes, sales e tampóns que se poden empregar para favorecer a lise de células e para solubilizar proteínas. A miúdo engádense inhibidores de proteases e fosfatases para impedir a dixestión da mostra polos seus propios encimas. A preparación dos tecidos faise a miúdo a temperaturas frías para evitar a degradación e desnaturalización de proteínas.
Pode utilizarse unha combinación de técnicas bioquímicas e mecánicas, que comprenden varios tipos de filtración e centrifugación, para separar diferentes orgánulos e compartimentos celulares.

Electroforese en xel
[editar | editar a fonte]- Artigo principal: Electroforese en xel.
As proteínas da mostra son separadas utilizando electroforese en xel. A separación de proteínas pode facerse polo punto isoeléctrico (pI), peso molecular, carga eléctrica, ou por unha combinación destes factores. A natureza da separación depende do tratamento da mostra e da natureza do xel. Isto é un modo moi útil para identificar a proteína.
Con diferenza, o tipo máis común de electroforese en xel emprega xeles de poliacrilamida e tampóns cargados con dodecil sulfato sódico (SDS). A SDS-PAGE (electroforese en xel de poliacrilamida SDS) mantén os polipéptidos en estado desnaturalizado unha vez que foron tratados con axentes redutores fortes para desfacer as súas estruturas secundaria e terciaria (por exemplo, os enlaces disulfuro [S-S] pasan a ser grupos sulfhidrilo [SH e SH]), e así permite a separación de proteinas polo seu peso molecular. As proteínas mostreadas quedan cubertas polo SDS cargado negativamente e móvense ao eléctrodo cargado positivamente a través da rede de acrilamida do xel. As proteínas pequenas migran máis rápido a través desta rede e así as proteínas son separadas de acordo co seu tamaño (xeralmente medido en quilodaltons, kDa). A concentración de acrilamida determina a resolución do xel. Canta maior é a concentración de acrilamida, mellor é a resolución das proteínas de peso molecular menor. Canta menor é a concentración de acrilamida, mellor é a resolución das proteínas de maior peso molecular. As proteínas viaxan a través do xel só nunha dimensión na maioría dos blots.
As mostras cárganse en pozos feitos no xel. Unha das pistas ou carreiros do xel resérvase xeralmente para un marcador ou escada, que é unha mestura de proteínas proporcionada comercialmente que teñen pesos moleculares definidos, tinguidos tipicamente para que formen bandas coloreadas visibles. Cando a voltaxe se aplica ao longo do xel, as proteínas migran a través del a diferentes velocidades dependendo do seu tamaño. Estas diferentes velocidades de avance (diferentes mobilidades electroforéticas) fan que se separen en bandas dentro de cada carreiro do xel (no que corren as proteínas).

Tamén é posible usar un xel bidimensional (2-D) que fai que as proteínas se espallen desde unha soa mostra en dúas dimensións. As proteínas son separadas de acordo co seu punto isoeléctrico (o pH ao cal a súa carga neta é neutra) na primeira dimensión, e segundo os seus pesos moleculares na segunda dimensión.
Transferencia
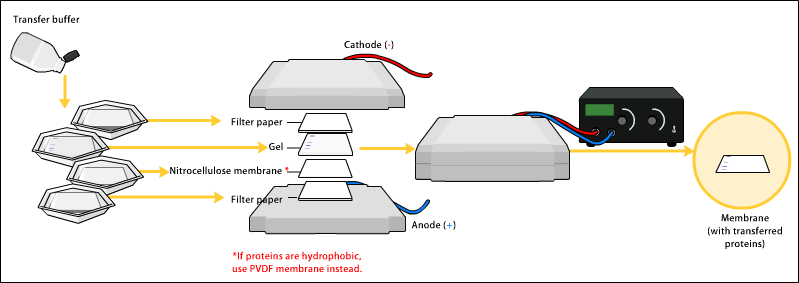
[editar | editar a fonte]Para facer que a proteínas sexan accesibles á detección por anticorpos, son retiradas do xel e pasadas a unha membrana de nitrocelulosa ou difluoruro de polivinilideno (PVDF). O método principal de transferencia de proteínas denomínase electroblotting e utiliza unha corrente eléctrica para impulsar as proteínas desde o xel á membrana de PVDF ou nitrocelulosa. As proteínas móvense desde o interior do xel á membrana pero mantendo a organización que tiñan no xel. Un método antigo de transferencia situaba unha membrana na parte superior do xel, e unha morea de papeis de filtro enriba dela. O conxunto completo situábase nunha solución tampón, que ascende polo papel por capilaridade, arrastrando as proteínas con ela. Na práctica este método xa non se usa, xa que leva moito tempo, e prefírese usar o electroblotting. Como resultado de ambos os procesos de "blotting" (transferencia), as proteínas expóñense sobre unha capa superficial fina para a detección (véxase máis abaixo). Ambas as variedades de membrana son elixidas polas súas propiedades de unión non específica a proteínas (é dicir, únense a todas as proteínas igualmente ben). A unión a proteínas está baseada en interaccións hidrofóbicas, e en interaccións cargadas entre a membrana e a proteína. As membranas de nitrocelulosa son máis baratas que as de PVDF, pero son moito máis fráxiles e non resisten ben para usarse en repetidos experimentos.
A uniformidade e efectividade global da transferencia de proteínas desde o xel á membrana pode ser comprobada tinguindo a membrana cos colorantes Azul Brillante Coomassie ou Ponceau S. O Ponceau S é o máis común dos dous, debido á súa alta sensibilidade e solubilidade en auga. A súa hidrosolubilidade fai máis doado des-tinguir e sondar seguidamente a membrana, como se describe máis adiante.[5]
Bloqueo
[editar | editar a fonte]Como as membranas foron elixidas pola súa capacidade que teñen de que se unan a elas proteínas, e como os anticorpos e as dianas son proteínas, deben tomarse precaucións para impedir a interacción entre a membrana e o anticorpo para impedir as interaccións entre a membrana e o anticorpo usado para a detección da proteína diana. O bloqueo da unión non específica conséguese situando a membrana nunha solución diluída de proteínas, xeralmente do 3 ao 5% de albumina sérica bovina (BSA) ou leite en po desnatada (ambos baratos) en Tris-Tamponado Salino (TBS, Tris-Buffered Saline) ou I-Block, cunha diminuta porcentaxe (0,1%) de deterxente como Tween 20 ou Triton X-100. A proteína na solución diluída únese á membrana en todos os sitios onde non se uniron as proteínas diana. Así, cando se engade o anticorpo, non hai espazo na membrana para que este se una a outro a non ser sobre os sitios de unión da proteína diana específica. Isto reduce o "ruído" no produto final do western blot, o que orixina resultados máis claros, e elimina os falsos positivos.
Detección
[editar | editar a fonte]Durante o proceso de detección a membrana é "sondada" para buscar a proteína de interese cun anticorpo modificado, que está ligado a un encima reporteiro; cando se expón a un substrato apropiado, este encima impulsa unha reacción colorimétrica e produce unha cor. Por varias razóns, isto tradicionalmente ten lugar nun proceso en dúas etapas, aínda que hai agora métodos de detección nunha etapa dispoñibles para certas aplicacións.
Método en dúas etapas
[editar | editar a fonte]Os anticorpos primarios xéranse cando se expón unha especie hóspede ou un cultivo de células inmunitarias á proteína de interese (ou a unha parte dela). Normalmente, esta produción forma parte da resposta inmunitaria, pero aquí os anticorpos van ser recollidos e utilizados como ferramentas de detección específicas e sensibles que se unen á proteína directamente.
Despois do bloqueo, unha solución diluída de anticorpos primarios (xeralmente entre 0,5 e 5 microgramos/mL) incúbase coa membrana e cunha suave axitación. Tipicamente, a solución está composta de solución salina tamponada cunha pequena porcentaxe de deterxente, e ás veces con leite en po e BSA. A solución de anticorpos e a membrana poden selarse e incubarse xuntas durante 30 minutos ou ata toda a noite. Poden tamén ser incubados a diferentes temperaturas, e as temperaturas máis altas están asociadas con maior unión do produto, tanto específica (á proteína diana, o "sinal") coma non específica ("ruído").
Despois de lavar a membrana para retirar os anticorpos primarios que non se uniron, a membrana é exposta a outro anticorpo, dirixido a unha porción específica de especie do anticorpo primario. Os anticorpos proceden de fontes animais (ou cultivos de hibridomas de orixe animal); un anticorpo secundario de rato vaise unir a case calquera anticorpo primario de rato, o que permite algún aforro no custo ao poder todo o laboratorio compartir unha soa fonte de anticorpos producidos en masa, e proporciona resultados moito máis consistentes. Isto coñécese como anticorpo secundario, e debido ás súas propiedades de unión a produtos concretos, adoita denominarse "anti-rato", "anti-cabra" etc. O anticorpo secundario está xeralmente ligado á biotina ou a un encima reporteiro como a fosfatase alcalina ou a peroxidase de ravo picante (Armoracia rusticana). Isto significa que varios anticorpos secundarios se unen a un anticorpo primario e potencian o sinal.
O máis común é usar un anticorpo secundario ligado á peroxidase do ravo picante para clivar un axente quimioluminescente, e o produto de reacción produce luminescencia en proporción á cantidade de proteína existente. Sitúase unha lámina sensible de película fotográfica contra a membrana, e a exposición á luz procedente da reacción crea unha imaxe dun anticorpo unido ao blot. Un modo máis barato pero menos sensible é utilizar o colorante 4-cloronaftol cun 1% de peróxido de hidróxeno; a reacción dos radicais peróxido co 4-cloronaftol produce unha tinguidura púrpura ecura que pode ser fotografada sen usar películas fotográficas especializadas.

Igual que ocorre nos procedementos de ELISPOT e ELISA, o encima pode ser provisto cunha molécula substrato que será convertido polo encima nun produto de reacción coloreado que será visible sobre a membrana (ver a figura de abaixo coas bandas azuis).
Outro método de detección de anticorpos secundarios utiliza anticorpos ligados a un fluoróforo de infravermello próximo (NIR, near-infrared). A luz producida pola excitación dun colorante fluorescente é estática, facendo que a detección da fluorescencia sexa unha medida máis precisa e axeitada da diferenza no sinal producido polos anticorpos etiquetados unidos a proteínas nun western blot. Grazas a isto, as proteínas poden ser cuantificadas con precisión porque o sinal xerado polas diferentes cantidades de proteínas nas membranas se mide en estado estático, en comparación co que ocorre na quimioluminescencia, na cal a luz se mide en estado dinámico.[6]
Unha terceira alternativa é utilizar unha etiqueta radioactiva en vez dun encima acoplado ao anticorpo secundario, tal como etiquetar cunha proteína que se une a anticorpos como a proteína A de Staphylococcus ou a estreptavidina cun isótopo radioactivo de iodo. Pero como hai outros métodos que son máis seguros, rápidos e baratos, este método agora raramente se usa; porén, unha vantaxe que ten é a sensibilidade das imaxes baseadas en autorradiografía, que permiten unha cuantificación moi exacta da proteína cando se combina cun software óptico (por exemplo, Optiquant).
Método nunha etapa
[editar | editar a fonte]Historicamente, o proceso de sondaxe realizábase en dúas etapas debido á relativa facilidade de producir anticorpos primarios e secundarios en procesos separados. Isto dá aos investigadores e empresas grandes vantaxes en termos de flexibilidade, e engade un paso de amplificación ao proceso de detección. Porén, coa chegada dos métodos de análise de proteínas de alto rendemento e os límites máis baixos de detección, houbo interese en desenvolver sistemas de sondaxe nunha soa etapa que permitisen que o proceso ocorrese máis rápido e con menos consumibles. Isto require un anticorpo sonda que recoñeza a proteína de interese e á vez conteña unha etiqueta detectable, que son sondas das que a miúdo se pode dispoñer para etiquetas proteicas coñecidas. A sonda primaria é incubada coa membrana de maneira similar á do anticorpo primario no proceso en dúas etapas, e despois está listo para a detección directa despois dunha serie de pasos de lavado.

Análise
[editar | editar a fonte]Despois de retirar por lavado as sondas non unidas, o western blot está listo para a detección das sondas que están etiquetadas e unidas á proteína de interese. Na práctica, non todos os westerns revelan as proteínas nunha soa banda na membrana. Tómanse aproximacións de tamaños para comparar as bandas tinguidas coas da escada do marcador cargado durante a electroforese. O proceso repítese comunmente para unha proteína estrutural, como a actina ou tubulina, que non deberían cambiar entre mostras. A cantidade de proteína diana é normalizada coa proteína estrutural para facer un control entre grupos. Unha estratexia superior é a normalizaión coa proteína total visualizada con tricloroetanol[7][8] ou epicocconona (do fungo Epicoccum nigrum).[9] Esta práctica asegura a corrección para a cantidade de proteína total na membrana en caso de erros ou transferencias incompletas.
Detección colorimétrica
[editar | editar a fonte]O método de detección colorimétrica depende da incubación do western blot cun substrato que reacciona cun encima reporteiro (como a peroxidase) que está unido ao anticorpo secundario. Isto converte o colorante soluble nunha forma insoluble de diferente cor que precipita ao lado do encima e dese modo tingue a membrana. O desenvolvemento do blot detense despois por medio do lavado do colorante soluble. Os niveis proteicos avalíanse por medio de densitometría (mide a intensidade da tinguidura) ou por espectrofotometría.
Detección quimioluminescente
[editar | editar a fonte]Os métodos de detección quimioluminescentes dependen da incubación do western blot cun substrato que se fai luminoso cando é exposto ao reporteiro no anticorpo secundario. Despois, detéctase a luz por cámaras CCD que capturan imaxes dixitais do western blot ou da película fotográfica. O uso da película para a detección do western blot está desaparecendo lentamente debido á súa non linearidade da imaxe (cuantificación imprecisa). A imaxe analízase por densitometría, o cal avalía as cantidades relativas de tinguidura da proteína e cuantifica os resultados en termos de densidade óptica. Hai novo software que permite analizar datos como o peso molecular se se utilizan estándares axeitados.
As principais compañías que ofrecen sistemas de imaxes de quimioluminescencia son Analytik Jena, UVP, Azure Biosystems,UVITEC, GE e Biorad.

Detección radioactiva
[editar | editar a fonte]A etiquetaxe radioactiva non require substratos encimáticos, e permite situar unha película de raios X médica directamente contra o western blot, a cal se revela a medida que é exposta á etiqueta e crea rexións escuras que corresponden a bandas proteicas de interese. A importancia dos métodos de detección radioactiva está declinando debido ao perigo inherente aos produtos radioactivos, a que é moi cara, riscos de saúde e seguridade, e a que a quimioluminescencia potenciada (ECL, enhanced chemiluminescence) proporciona unha alternativa útil.
Detección fluorescente
[editar | editar a fonte]A sonda etiquetada fluorescentemente é excitada pola luz e a emisión da excitación detéctase despois por medio dun fotosensor como pode ser unha cámara CCD equipada con filtros de emisións apropiados que capturan a imaxe dixital do western blot e permiten analizar máis datos como facer análises de pesos moleculares e unha análise de western blot cuantitativa. A fluorescencia considérase que é un dos mellores métodos para a cuantificación, pero é menos sensible que a quimioluminescencia.[10]
Sondaxe secundaria
[editar | editar a fonte]Unha diferenza importante entre as membranas de nitrocelulosa e de PVDF ten que ver coa capacidade de cada unha delas de soportar que se "arranquen" os anticorpos e se reutilice a membrana para posteriores sondas de anticorpos. Aínda que se dispoñen de protocolos ben establecidos para espir de anticorpos as membranas de nitrocelulosa, as máis robustas membranas PVDF permiten facer ese proceso de forma máis doada, e poden ser reutilizadas máis veces antes de que o ruído de fondo limite os experimentos. Outra diferenza é que, a diferenza da nitrocelulosa, a PVDF antes do seu uso debe ser mergullada en etanol ao 95% (ou isopropanol ou metanol). As membranas PVDF tamén tenden a ser máis grosas e máis resistentes aos danos durante o uso.
Electroforese en xel bidimensional
[editar | editar a fonte]- Artigo principal: Electroforese en xel bidimensional.
O SDS-PAGE bidimensional usa os principios e técnicas indicadas anteriormente. O SDS-PAGE bidimensional, como indica o seu nome, implica a migración de polipéptidos en dúas dimensións. Por exemplo, na primeira das dimensións, os polipéptidos sepáranse polo seu punto isoeléctrico, mentres que na segunda dimensión, os polipéptidos sepáranse de acordo cos seus pesos moleculares. O punto isoeléctrico dunha proteína determínase polo número relativo de aminoácidos cargados positivamente (por exemplo, lisina e arxinina) e negativamente (por exemplo, glutamato e aspartato), e os aminoácidos cargados negativamente contribúen a que o punto isoeléctrico sexa baixo, e os cargados positivamente contribúen a que sexa alto. As mostras poderían tamén separarse primeiramente en condicións non redutoras usando SDS-PAGE, e baixo condicións redutoras na segunda dimensión, o cal rompe as pontes disulfuro que mantiñan xuntas as subunidades. O SDS-PAGE pode tamén ser acoplado con urea-PAGE para un xel bidimensional.
En principio, este método permite a separación de todas as proteínas celulares sobre un xel grande único. Unha vantaxe importante deste método é que a miúdo distingue entre diferentes isoformas dunha proteína particular, por exemplo unha proteína que foi fosforilada (por adición dun grupo cargado negativamente). As proteínas que foron separadasw poden ser cortadas do xel e despois analizadas por espectroscopia de masas, o cal identifica a proteína.
Aplicacións diagnósticas médicas
[editar | editar a fonte]- A proba do VIH confirmatoria emprega un western blot para detectar anticorpos anti-VIH nunha mostra de soro sanguíneo humano. As proteínas de células infectadas polo VIH coñecidas son separadas e transferidas á membrana como se explicou máis arriba. Despois, o soro que se vai probar aplícase no primeiro paso de incubación do anticorpo; os anticorpos libres son lavados, e engádese un anticorpo anti-humano secundario ligado a un sinal encimático. As bandas tinguidas entón indican as proteínas para as cales o soro do paciente contén anticorpos.
- O western blot utilízase tamén como unha proba definitiva para a encefalopatía esponxiforme bovina (tamén coñecida como 'mal das vacas tolas').
- Algunhas formas das probas para a detección da enfermidade de Lyme empregan o western blot.
- O western blot pode tamén usarse como unha proba confirmatoria para a hepatite B.
- En medicina veterinaria, o western blot utilízase ás veces para confirmar o status FIV+ en gatos (presenza do virus da inmunodeficiencia felina).
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Towbin H, Staehelin T, Gordon J. (1979). "Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications". Proceedings of the National Academy of Sciences USA 76 (9): 4350–54. PMC 411572. PMID 388439. doi:10.1073/pnas.76.9.4350.
- ↑ Renart J, Reiser J, Stark GR. (1979). "Transfer of proteins from gels to diazobenzyloxymethyl-paper and detection with antisera: a method for studying antibody specificity and antigen structure". Proceedings of the National Academy of Sciences USA 76 (7): 3116–20. PMC 383774. PMID 91164. doi:10.1073/pnas.76.7.3116.
- ↑ Burnette WN. (1981). "'Western blotting': electrophoretic transfer of proteins from sodium dodecyl sulfate—polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A". Analytical Biochemistry 112 (2): 195–203. ISSN 0003-2697. PMID 6266278. doi:10.1016/0003-2697(81)90281-5.
- ↑ Alwine J, Kemp D, Stark G, (1977). "Method for detection of specific RNAs in agarose gels by transfer to diazobenzyloxymethyl-paper and hybridization with DNA probes.". Proceedings of the National Academy of Sciences USA 74 (12): 5350–5354. PMC 431715. PMID 414220. doi:10.1073/pnas.74.12.5350.
- ↑ Corley RB. (2005). A Guide to Methods in the Biomedical Sciences. Springer. p. 11. ISBN 978-0-387-22844-0.
- ↑ Ambroz K. (2006-09-20). "Improving quantification accuracy for western blots" (PDF). Image Analysis. Arquivado dende o orixinal (PDF) o 29 de agosto de 2008. Consultado o 15 de maio de 2015.
- ↑ Stennert, E; Arold, R (1973). "The double external auditory canal (author's transl)". HNO 21 (10): 293–6. PMID 4769330.
- ↑ Gilda, J. E.; Gomes, A. V. (2013). "Stain-Free total protein staining is a superior loading control to β-actin for Western blots". Analytical Biochemistry 440 (2): 186–8. doi:10.1016/j.ab.2013.05.027. PMC 3809032. PMID 23747530.
- ↑ Moritz, C. P.; Marz, S. X.; Reiss, R; Schulenborg, T; Friauf, E (2014). "Epicocconone staining: A powerful loading control for Western blots". Proteomics 14 (2–3): 162–8. doi:10.1002/pmic.201300089. PMID 24339236.
- ↑ Mathews, Suresh T.; Plaisance, Eric P.; Kim, Teayoun (2009). Kurien, Biji T.; Scofield, R. Hal, eds. Imaging Systems for Westerns: Chemiluminescence vs. Infrared Detection 536. Totowa, NJ: Humana Press. pp. 499–513. ISBN 978-1-934115-73-2. doi:10.1007/978-1-59745-542-8_51.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Far-Eastern blot
- Far-western blot
- Eastern blot
- Northwestern blot
- SDS-PAGE
- Proteólise paralela rápida (FASTpp) [https://web.archive.org/web/20070915213259/http://www.plosone.org/article/fetchObjectAttachment.action
Ligazóns externas
[editar | editar a fonte]- Western blot analysis of sub-cellular fractionated samples using the Odyssey Infrared Imaging System (a protocol)
- Western blot protocol including example buffers and reprobing procedure Arquivado 14 de novembro de 2007 en Wayback Machine.
- Image Studio Lite Western Blot Analysis Software (Free) Arquivado 18 de maio de 2015 en Wayback Machine.
- Western Blotting Principles and Methods Handbook
- Advansta WiKi on Western Blots
Protocolos
[editar | editar a fonte]- Western Blot Video Protocol
- Western Blotting Protocol from Protocolmonkey
- Modified western blotting protocols from Biotechniques
- Dr. Mark Barton Frank Lab protocol
- "Kamps's Western Blotting Protocol" (en inglés). Arquivado dende o orixinal o 11 de decembro de 2012. Consultado o 15 de maio de 2015.
- CSH Protocols collection: Immunoblotting
- Western Blot Protocol from HowtoWesternBlot.net
