Punto isoeléctrico
O punto isoeléctrico (pI, pH(I)), é o pH ao cal unha determinada molécula non ten carga eléctrica ou é electrricamente neutra na media estatística. A nomenclatura estándar para representar o punto isoeléctrico é pH(I),[1] aínda que pI é o que se usa máis comunmente,[2] e será o utilizado neste artigo. A carga neta que hai sobre a molécula está afectada polo pH do ambiente que a rodea e pode quedar cargada máis positvamente ou negativamente debido á ganancia ou perda, respectivamente, de protóns (H+).
As superficies cárganse de forma natural para formar dobres capas. No caso común no que os ións que determinan a carga superficial son H+/OH−, a carga superficial neta está moi afectada polo pH do líquido no que o sólido está mergullado.
O valor do pI pode afectar a solubilidade dunha molécula a un determinado pH. Ditas moléculas teñen unha solubilidade mínima en auga ou solucións salinas ao pH que corresponde ao seu pI e adoitan precipitar fóra da solución. As moléculas anfóteras biolóxicas como as proteínas conteñen tanto grupos funcionais ácidos coma básicos. Os aminoácidos que forman as proteínas poden ser de natureza neutra, positiva, negativa ou polar, dependendo do seu tipo de cadea lateral, e en conxunto danlle á proteína a súa carga global. A un pH por debaixo do seu pI, a proteína leva unha carga neta positiva; por riba do seu pI ten carga neta negativa. As proteínas poden, así, separarse pola súa carga neta nun xel de poliacrilamida realizando unha electroforese en xel preparativa, que utiliza un pH constante para separar as proteínas, ou o isoelectroenfoque, que utiliza un gradiente de pH para separalas. O isoelectroenfoque é tamén o primeiro paso a realizar na electroforese en xel de poliacrilamida bidimensional.
Entre as biomoléculas, as proteínas poden separarse por cromatografía de intercambio iónico. Como as proteínas biolóxicas poden ter carga neta positiva ou negativa dependendpo do pH do contorno, pode utilizarse o pI específico da proteína diana para o proceso de separación e pode despois ser purificada do resto da mestura. Para esta purificación poden utilizarse tampóns de varios pHs para cambiar o pH do contorno. Cando unha proteína diana con carga neta se carga nun intercambiador de ións, a matriz estacionaria pode ser despois cargada positivamente (para anións móbiles) ou negativamente (para catións móbiles). A valores de pH baixos, a carga neta da maioría das proteínas na mestura é positiva, en intercambiadores de catións, e estas proteínas cargadas positivamente únense á matriz cargada negativamente. A valores de pH altos, a carga neta da maioría das proteínas é negativa, polo que se unen á matriz cargada positivamente dos intercambiadores de anións. Cando o contorno ten un pH igual ao pI da proteín, a carga neta é cero e a proteína non se une a ningún intercambiador, e, por tanto, pode ser eluída.[3]
Cálculo do valor do pI[editar | editar a fonte]
Para un aminoácido cun só grupo amino e un grupo carboxilo, o pI pode ser calculado a partir da media dos pKa desa molécula.
O pH dun xel electroforético é determinado polo tampón utilizado no xel. Se o pH do tampón está por riba do pI da proeína á que se vai aplicar a electroforese, a proteína migrará ao polo positivo (a carga negativa é atraída ao polo positivo). Se o pH do tampón está por debaixo do pI da proteína, esta migrará ao polo negativo do xel (a carga positiva é atraída ao polo negativo). Se a proteína se somete a electroforese cun pH do tampón que é igual ao pI, non migrará en absoluto. Isto tamén é aplicable a un aminoácido.
Exemplos[editar | editar a fonte]
|
|
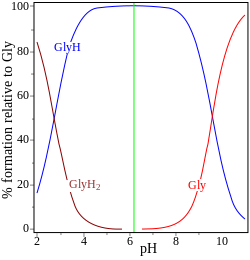
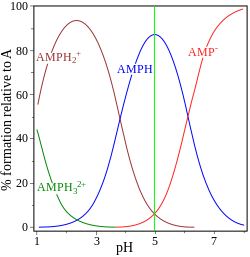
| glicina pK = 2,72, 9,60 | adenosín monofosfato pK = 0,9, 3,8, 6,1 |
Nos dous exemplos (á dereita) o punto isoeléctrico indícase por unha liña vertical verde. Na glicina os valores de pK diferéncianse en case 7 unidades, polo que a concentración de especies neutras, glicina (GlyH), é efectivamente do 100 % da concentración de glicina analítica. A glicina pode existir como un zwitterión no punto isoeléctrico, pero a constante de equilibrio para a reacción de isomerización en solución
- H2NCH2CO2H ⇌ H3N+CH2CO2−
non se coñece.
No outro exemplo, móstrase a adenosín monofosfato para ilustrar o feito de que, en principio, pode estar implicada unha terceira especie. De feito, a concentración de (AMP)H32+ é insignificante no punto isoeléctrico neste caso. Se o pI é maior que o pH, a molécula terá carga positiva.
Punto isoeléctrico de péptidos e proteínas[editar | editar a fonte]
Desenvolvéronse varios algoritmos para estimar os puntos isoeléctricos de péptidos e proteínas. A maioría deles usan a ecuación de Henderson–Hasselbalch con diferentes valores de pK. Por exemplo, no modelo proposto por Bjellqvist e colegas os pK foron determinados entre inmobilinos estreitamente relacionados, enfocando a mesma mostra en gradientes de pH solapantes.[4] Propuxéronse algunhas melloras na metodoloxía (especialmente na determinación dos valores de pK para aminoácidos modificados).[5][6] Os métodos máis avanzados teñen en conta o efecto de aminoácidos adxacentes situados a ±3 residuos dun ácido aspártico ou ácido glutámico cargados, os efectos sobre o C terminal libre, así como a aplicación dun termo de corrección aos valores de pK correspondentes usando o algoritmo xenético.[7] Outras aproximacións recentes están baseadas nun algoritmo de máquina de vector de soporte[8] e a optimización do pKa fronte aos puntos isoeléctricos de proteínas/péptidos coñecidos experimentalmente.[9]
Ademais, agregáronse ás bases de datos os puntos isoeléctricos medidos experimentalmente de proteínas.[10][11] Recentemente, desenvolveuse unha base de datos de puntos isoeléctricos de todas as proteínas preditas usando a maioría dos métodos dispoñibles.[12]
Materiais cerámicos[editar | editar a fonte]
Os puntos isoeléctricos de cerámicas de óxidos metálicos utilízanse amplamente en ciencias dos materiais en varios pasos de procesamento acuosos (síntese, modificación etc.). En ausencia de especies quimiosorbidas ou fisiosorbidas, asúmese xeralmente que as superficies das partículas en suspensión acuosa están cubertas con especies hidroxilo de superficie, M-OH (onde M é un metal como o Al, Si etc.).[13] A valores de pH por riba do punto isoeléctrico, a especie de superficie predominante é M-O−, mentres que a valores de pH por debaixo do punto isoeléctrico, predomina a especie M-OH2+. Algúns valores aproximados das cerámicas comúns son os da seguinte lista:[14][15]
| Material | Punto isoeléctrico | Material | Punto isoeléctrico | Material | Punto isoeléctrico | Material | Punto isoeléctrico | Material | Punto isoeléctrico | Material | Punto isoeléctrico |
|---|---|---|---|---|---|---|---|---|---|---|---|
| WO3[16] | 0,2-0,5 | Ta2O5[16] | 2,7-3,0 | δ-MnO2 | 1,5 | Fe2O3[16] | 3,3-6,7 | Fe2O3[16] | 8,4-8,5 | ZnO[16] | 8,7-10,3 |
| Sb2O5[16] | <0,4-1,9 | SnO2[17] | 4-5,5 (7,3) | β-MnO2[18] | 7,3 | CeO2[16] | 6,7-8,6 | α Al2O3 | 8-9 | NiO[17] | 10-11 |
| V2O5[16][18] | 1-2 (3) | ZrO2[16] | 4-11 | TiO2[16] | 3,9-8,2 | Cr2O3[16][18] | 6,2-8,1 (7) | Si3N4[17] | 9 | PbO[16] | 10,7-11,6 |
| SiO2[16] | 1,7-3,5 | MnO2 | 4-5 | Si3N4 | 6-7 | γ Al2O3 | 7-8 | Y2O3[16] | 7,15-8,95 | La2O3 | 10 |
| SiC[19] | 2-3,5 | ITO[20] | 6 | Fe3O4[16] | 6,5-6,8 | Tl2O[21] | 8 | CuO[17] | 9,5 | MgO[16] | 12-13 (9,8-12,7) |
Nota: Esta lista dá os puntos isoeléctricos a 25 °C para materiais seleccionados en auga. O valor exacto pode variar amplamente, dependendo de factores materiais como pureza e fase así como parámetros físicos como a temperatura. Ademais, a medida precisa de puntos isoeléctricos pode ser difícil, así moitas fontes citan con frecuencia diferentes valores para os pntos isoeléctricos destes materiais.
Os óxidos mixtos poden presentar valores de punto isoeléctrico que son intermedios con respecto aos dos óxidos puros correspondentes. Por exemplo, mediuse inicialmente o punto isoeléctrico dun aluminosilicato amorfo preparado sinteticamente (Al2O3-SiO2), que era de 4,5 (o comportamento electrocinético da superficie estaba dominado pola especie Si-OH de superficie, o que explica o nivel relativamente baixo de punto isoeléctrico).[22] Outros informaron de valores de punto isoeléctrico significativamente maiores (pH 6 a 8) do 3Al2O3-2SiO2.[17] Similarmente, tamén se informou que o punto isoeléctrico do titanato de bario, BaTiO3 é de 5-6,[17] aínda que outros obtiveron un valor de 3.[23] Estudáronse as mesturas de dióxido de titanio (TiO2) e dióxido de circonio (ZrO2) e atopouse que tiñan un punto isoeléctrico entre 5,3 e 6,9, variando de modo non linear coa %(ZrO2).[24] A carga de superficie dos óxidos mixtos foi correlacionada coa acidez. Un maior contido de titania leva a un incremento da acidez de Lewis, mentres que os óxidos ricos en circonio mostraban acidez de Brǿnsted. Os diferfentes tipos de acidez producían diferenzas nas capacidades e taxas de adsorción de ións.
O punto isoeléctrico fronte o punto de carga cero[editar | editar a fonte]
Os termos punto isoeléctrico e punto de carga cero utilízanse xeralmente de forma intercambiable, aínda que en certas circunstancias, pode ser produtivo facer distinción entre eles.
En sistemas nos cales H+/OH− son os ións que determinan o potencial de interface, o punto de carga cero dáse en termos de pH. O pH á cal a superficie mostra unha carga eléctrica neta neutra é o punto de carga cero na superficie. Os fenómenos electrocinéticos miden xeralmente o potencial cero, e un potencial cero ou zeta é interpretado como o punto de carga neta cero no plano de cizalla. Isto é denominado punto isoeléctrico.[25] Así, o punto isoeléctrrico é o valor de pH ao cal a partícula coloidal permanece estacionaria nun campo eléctrrico. O punto isoeléctrico espérase que sexa un pouco diferente do punto de carga cero na superficie da partícula, pero esta diferenza adoita ser ignorada na práctica para as denominadas superficies prístinas, é dicir, as superficies sen cargas positivas ou negativas especificamente adsorbidas.[13] Neste contexto a adsorción específica enténdese como a adsorción que ocorre nunha capa de Stern ou quimiosorción. Así, o punto de carga cero na superficie é tomado como igual ao punto isoeléctrico en ausencia de adsorción específica na superficie.
De acordo con Jolivet,[18] en ausencia de cargas positivas ou negativas, a superficie é descrita mellor polo punto de carga cero. Se as cargas positivas e negativas están á vez presentes en cantidades iguais, entón este é o punto isoeléctrico. Deste xeito, o punto de carga cero refírese á ausencia de calquera tipo de carga superficial, mentres que o punto isoeléctrico refírese ao estado de carga superficial neutra. A diferenza entre os dous, por tanto, é a cantidade de sitios cargados no punto de carga cero neta. Jolivet usa as constantes de equilibrio de superficie intrínsecas, pK− e pK+ para definir as dúas condicións en canto ao número relativo de sitios cargados:
Para grandes ΔpK (>4 segundo Jolivet), a especie predominante é MOH mentres que hai relativamente poucas especies cargadas, polo que o punto de carga cero é relevante. Para valores pequenos de ΔpK, hai moitas especies cargadas en aproximadamente igual número, polo que se fala de punto isoeléctrico.
Notas[editar | editar a fonte]
- ↑ Variantes aceptables de pH(I) son pHI, pHIEP etc.; o esencial é medir o pH suxeito a unha condición determinada.
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) creado por M. Nic, J. Jirat, B. Kosata; actualizacións compiladas por A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook. Last update: 2014-02-24; version: 2.3.3. DOI of this term: doi:10.1351/goldbook.I03275.
- ↑ Dayton, W. R. (1983). "Protein Separation Techniques" (PDF). Reciprocal Meat Conference Proceedings 36: 98–102.
- ↑ Bjellqvist, B.; Hughes, G. J.; Pasquali, C.; Paquet, N.; Ravier, F.; Sanchez, J. C.; Frutiger, S.; Hochstrasser, D. (1993-10-01). "The focusing positions of polypeptides in immobilized pH gradients can be predicted from their amino acid sequences". Electrophoresis 14 (10): 1023–1031. ISSN 0173-0835. PMID 8125050. doi:10.1002/elps.11501401163.
- ↑ Gauci, Sharon; van Breukelen, Bas; Lemeer, Simone M.; Krijgsveld, Jeroen; Heck, Albert J. R. (2008-12-01). "A versatile peptide pI calculator for phosphorylated and N-terminal acetylated peptides experimentally tested using peptide isoelectric focusing". Proteomics 8 (23–24): 4898–4906. ISSN 1615-9861. PMID 19003858. doi:10.1002/pmic.200800295.
- ↑ Gasteiger, Elisabeth; Gattiker, Alexandre; Hoogland, Christine; Ivanyi, Ivan; Appel, Ron D.; Bairoch, Amos (2003-07-01). "ExPASy: the proteomics server for in-depth protein knowledge and analysis". Nucleic Acids Research 31 (13): 3784–3788. ISSN 0305-1048. PMC 168970. PMID 12824418. doi:10.1093/nar/gkg563.
- ↑ Cargile, Benjamin J.; Sevinsky, Joel R.; Essader, Amal S.; Eu, Jerry P.; Stephenson, James L. (2008-07-01). "Calculation of the isoelectric point of tryptic peptides in the pH 3.5-4.5 range based on adjacent amino acid effects". Electrophoresis 29 (13): 2768–2778. ISSN 0173-0835. PMID 18615785. doi:10.1002/elps.200700701.
- ↑ Perez-Riverol, Yasset; Audain, Enrique; Millan, Aleli; Ramos, Yassel; Sanchez, Aniel; Vizcaíno, Juan Antonio; Wang, Rui; Müller, Markus; Machado, Yoan J. (2012-04-03). "Isoelectric point optimization using peptide descriptors and support vector machines". Journal of Proteomics 75 (7): 2269–2274. ISSN 1876-7737. PMID 22326964. doi:10.1016/j.jprot.2012.01.029.
- ↑ Kozlowski, LP. (2016). "IPC - Isoelectric Point Calculator.". Biol Direct 11 (1): 55. PMC 5075173. PMID 27769290. doi:10.1186/s13062-016-0159-9.
- ↑ Hoogland, C.; Mostaguir, K.; Sanchez, JC.; Hochstrasser, DF.; Appel, RD. (2004). "SWISS-2DPAGE, ten years later.". Proteomics 4 (8): 2352–6. PMID 15274128. doi:10.1002/pmic.200300830.
- ↑ Bunkute, E.; Cummins, C.; Crofts, FJ.; Bunce, G.; Nabney, IT.; Flower, DR. (2015). "PIP-DB: the Protein Isoelectric Point database.". Bioinformatics 31 (2): 295–6. PMID 25252779. doi:10.1093/bioinformatics/btu637.
- ↑ Kozlowski, LP. (2016). "Proteome-pI: proteome isoelectric point database.". Nucleic Acids Res 45 (D1): D1112–D1116. PMC 5210655. PMID 27789699. doi:10.1093/nar/gkw978.
- ↑ 13,0 13,1 Hanaor, D.A.H.; Michelazzi, M.; Leonelli, C.; Sorrell, C.C. (2012). "The effects of carboxylic acids on the aqueous dispersion and electrophoretic deposition of ZrO2". Journal of the European Ceramic Society 32 (1): 235–244. arXiv:1303.2754. doi:10.1016/j.jeurceramsoc.2011.08.015.
- ↑ Haruta, M (2004). "Nanoparticulate Gold Catalysts for Low-Temperature CO Oxidation". Journal of New Materials for Electrochemical Systems 7: 163–172.
- ↑ Brunelle JP (1978). 'Preparation of Catalysts by Metallic Complex Adsorption on Mineral Oxides'. Pure and Applied Chemistry vol. 50, pp. 1211-1229.
- ↑ 16,00 16,01 16,02 16,03 16,04 16,05 16,06 16,07 16,08 16,09 16,10 16,11 16,12 16,13 16,14 16,15 Marek Kosmulski, "Chemical Properties of Material Surfaces", Marcel Dekker, 2001.
- ↑ 17,0 17,1 17,2 17,3 17,4 17,5 Lewis, JA (2000). "Colloidal Processing of Ceramics". Journal of the American Ceramic Society 83 (10): 2341–2359. doi:10.1111/j.1151-2916.2000.tb01560.x.
- ↑ 18,0 18,1 18,2 18,3 Jolivet J.P., Metal Oxide Chemistry and Synthesis. From Solution to Solid State, John Wiley & Sons Ltd. 2000, ISBN 0-471-97056-5 (tradución en inglés do textro orixinal en fancés, De la Solution à l'Oxyde, InterEditions et CNRS Editions, Paris, 1994).
- ↑ U.S. Patent 5,165,996
- ↑ Daido, T; Akaike, T (1993). "Electrochemistry of cytochrome c: influence of coulombic attraction with indium tin oxide electrode". Journal of Electroanalytical Chemistry 344 (1–2): 91–106. doi:10.1016/0022-0728(93)80048-m.
- ↑ Kosmulski, M; Saneluta, C (2004). "Point of zero charge/isoelectric point of exotic oxides: Tl2O3". Journal of Colloid and Interface Science 280 (2): 544–545. Bibcode:2004JCIS..280..544K. doi:10.1016/j.jcis.2004.08.079.
- ↑ Jara, A.A.; Goldberg, S.; Mora, M.L. (2005). "Studies of the surface charge of amorphous aluminosilicates using surface complexation models". Journal of Colloid and Interface Science 292 (1): 160–170. Bibcode:2005JCIS..292..160J. doi:10.1016/j.jcis.2005.05.083.
- ↑ Vamvakaki, Maria; Billingham, Norman C.; Armes, Steven P.; Watts, John F.; Greaves, Stephen J. (2001). "Controlled structure copolymers for the dispersion of high-performance ceramics in aqueous media". Journal of Materials Chemistry 11 (10): 2437–2444. ISSN 0959-9428. doi:10.1039/b101728o.
- ↑ Drisko, Glenna L; Luca, Vittorio; Sizgek, Erden; Scales, Nicolas F.; Caruso, Rachel A. (2009). "Template Synthesis and Adsorption Properties of Hierarchically Porous Zirconium Titanium Oxides". Langmuir 25 (9): 5286–5293. ISSN 0743-7463. PMID 19397363. doi:10.1021/la804030h.
- ↑ A.W. Adamson, A.P. Gast, "Physical Chemistry of Surfaces", John Wiley and Sons, 1997.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Nelson DL, Cox MM (2004). Lehninger Principles of Biochemistry. W. H. Freeman; 4th edition (Hardcover). ISBN 0-7167-4339-6
- Kosmulski M. (2009). Surface Charging and Points of Zero Charge. CRC Press; 1st edition (Hardcover). ISBN 978-1-4200-5188-9
Ligazóns externas[editar | editar a fonte]
- IPC – Isoelectric Point Calculator — calcula o punto isoeléctrico das proteínas usando uns 15 métodos
- prot pi - punto isoeléctrico das proteínas — un programa on line para calcular o pI de proteínas (inclúe múltiples subunidades e modificacións postraducionais)
- CurTiPot — unha suite de follas de cálculo para computar os equilibrios ácido-base (gráfico de carga fronte a pH de moléculas anfóteras, por exemplo, aminoácidos)
- SWISS-2DPAGE — unha base de datos de puntos isoeléctricos procedente de electroforese en xel de poliacrilamida bidimensional (~ 2000 proteína)
- PIP-DB — unha base ded datos de puntos isoeléctricos de proteínas (~ 5000 proteínas)
- Proteome-pI — unha base de datos de puntos isoelécrricos do proteoma (predí o punto isoelécrico de todas as proteínas)


![{\displaystyle \mathrm {p} K^{-}-\mathrm {p} K^{+}=\Delta \mathrm {p} K=\log {\frac {\left[\mathrm {MOH} \right]^{2}}{\left[\mathrm {MOH} {_{2}^{+}}\right]\left[\mathrm {MO} ^{-}\right]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e3191d7ab56090ff3c419b53868c6c52134d80a)