Rotavirus
| Rotavirus | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
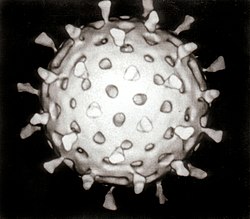 Reconstrución por computador dun rotavirus baseada en varias micrografías electrónicas. Unha partícula deste virus é esférica con protrusións superficiais regularmente espazadas. | |||||||||||
| Clasificación científica | |||||||||||
| |||||||||||
| Especie tipo | |||||||||||
| Rotavirus A | |||||||||||
| Especies | |||||||||||
|
Rotavirus A | |||||||||||
O Rotavirus (do latín rota, 'roda', pola súa forma) é un xénero de virus que son a principal causa de diarreas graves en nenos.[1] Trátase de virus de ARN bicatenario da familia Reoviridae. Practicamente todos os nenos do mundo foron infectados por rotavirus algunha vez antes dos 5 anos de idade.[2] Con cada infección desenvólvese inmunidade, polo que as infeccións posteriores son menos graves; e os adultos raramente se infectan.[3] Hai cinco especies destes virus, denominadas A, B, C, D, e E. O Rotavirus A, que é a especie máis común, causa máis do 90% das infeccións en humanos.
O virus transmítese pola ruta fecal-oral. Infecta e dana as células que tapizan o intestino delgado (enterocitos) causando gastroenterite. Os rotavirus descubríronse en 1973[4] e son responsables do 50% das hospitalizacións por diarreas graves en nenos.[5][6] Ademais do seu impacto na saúde humana, os rotavirus tamén infectan animais, incluído o gando.[7]
A infección por rotavirus é xeralmente unha doenza doada de manexar na infancia, pero, aínda así, no mundo morren pola súa causa 450 000 nenos de menos de 5 anos cada ano,[8] a maioría dos cales viven en países en vías de desenvolvemento económico,[9] e case dous millóns máis caen gravemente enfermos.[6][10] As campañas sanitarias para combater os rotavirus céntranse na terapia de rehidratación oral para nenos infectados e na vacinación para impedir a enfermidade.[11] A incidencia e gravidade das infeccións por rotavirus baixou significativamente nos países que engadiron a vacinación contra os rotavirus ás súas políticas rotineiras de inmunización dos nenos.[12][13]
Viroloxía
[editar | editar a fonte]Tipos de rotavirus
[editar | editar a fonte]Hai cinco especies de rotavirus, denominadas A, B, C, D e E. As infeccións en humanos débense principalmente ás especies A, B e C, pero especialmente á A. As cinco especies poden causar enfermidades noutros animais.[14] O rotavirus A ten varias cepas, chamadas serotipos.[15] Para os rotavirus, de modo similar ao que ocorre co virus da gripe, utilízase un sistema de clasificación dual baseado nas dúas proteínas de superficie do virus. Unha delas é a glicoproteína VP7, que define os serotipos G, e a outra é a proteína VP4 sensible á protease, que define os serotipos P.[16] Como os dous xenes que determinan os tipos G e P poden transmitirse separadamente á proxenie destes virus, poden darse diferentes combinacións delas.[17]
Estrutura
[editar | editar a fonte]O xenoma do rotavirus consta de 11 moléculas de ARN bicatenario distintas, que teñen 18.555 nucleótidos en total. Cada un destes segmentos ou moléculas é un xene, numerados do 1 ao 11 por tamaño decrecente. Cada xene codifica unha proteína, agás o xene 9, que codifica dúas.[18] O ARN está rodeado por unha cápside proteica icosaédrica de tres capas. As partículas virais teñen uns 76,5 nm de diámetro[19][20] e carecen de envoltura.
Proteínas
[editar | editar a fonte]Hai seis proteínas virais (VPs), que forman a partícula vírica (virión). Estas proteínas estruturais denomínanse VP1, VP2, VP3, VP4, VP6 e VP7. Ademais das VPs, hai seis proteínas non estruturais (NSPs), que se producen só nas células infectadas por rotavirus, que son: NSP1, NSP2, NSP3, NSP4, NSP5 e NSP6.[14]

Polo menos seis das doce proteínas codificadas polo xenoma do rotavirus únense ao ARN.[21] A función destas proteínas na replicación do rotavirus non se comprende totalmente; crese que están relacionadas coa síntese de ARN e o seu empaquetamento no virión, o transporte de ARNm ao sitio de replicación do xenoma, e a tradución do ARNm e regulación da expresión xénica.[22]
Proteínas estruturais
[editar | editar a fonte]A VP1 está localizada na parte central (core) do virus e é un encima ARN polimerase.[23] Nunha célula infectada este encima produce transcritos de ARNm para a síntese de proteínas virais e produce copias dos segmentos de ARN que forman o xenoma do rotavirus para a produción de novas partículas víricas.
A VP2 forma a capa central do virión e únese ao xenoma de ARN.[24]
A VP3 forma parte do core interno do virión e é un encima chamado guanilil transferase, o cal cataliza a formación da carapucha 5' durante a modificación postranscricional do ARNm.[25] A carapucha 5' estabiliza o ARNm viral ao protexelo dos encimas que degradan os ácidos nucleicos chamados nucleases.[26]
A VP4 está na superficie do virión e sobresae como unha espícula.[27] Únese a moléculas receptoras da superficie celular e dirixe a entrada do virus na célula.[28] A VP4 ten que ser modificada polo encima tripsina (unha protease), que se encontra no tracto dixestivo, tansformándose en VP5* e VP8* antes de que o virus poida ser infeccioso.[29] Da VP4 depende a maior ou menor virulencia do virus e determina que o virus é do tipo P.[30]
A VP6 forma a masa da cápside. É moi antixénica e pode utilizarse para identificar as especies de rotavirus.[31] Esta proteína utilízase nas probas de laboratorio para as infeccións por rotavirus A.[32]
A VP7 é unha glicoproteína que forma a superficie externa do virión. Ademais das súas funcións estruturais, determina que o virus sexa unha cepa do tipo G e, xunto coa VP4, está implicada na immunidade á infección.[19]
Proteínas virais non estruturais
[editar | editar a fonte]A NSP1 é o produto do xene 5. Trátase dunha proteína non estrutural que se une ao ARN.[33]
A NSP2 é unha proteína de unión ao ARN que se acumula nas inclusións citoplasmáticas (viroplasma) necesaria para a replicación do xenoma.[34][35]
A NSP3 únese ao ARNm viral nas células infectadas e é responsable do bloqueo da síntese de proteínas celulares.[36]
A NSP4 é unha enterotoxina viral que induce diarrea e foi a primeira enterotoxina viral que se descubriu.[37]
A NSP5 está codificada polo segmento xenómico 11 do rotavirus A e en células infectadas polo virus a NSP5 acumúlase no viroplasma.[38]
A NSP6 é unha proteína que se une a ácidos nucleicos,[39] e está codificada no xene 11 a partir dun marco de lectura aberto fóra de fase.[40]
| Segmento de ARN (xene) | Tamaño (pares de bases) | Proteína | Peso molecular (kDa) | Localización | Copias por partícula | Función |
|---|---|---|---|---|---|---|
| 1 | 3302 | VP1 | 125 | Nos vértices da parte central (core) | <25 | ARN polimerase ARN dependente |
| 2 | 2690 | VP2 | 102 | Forma a capa interna do core | 120 | Estimula a ARN replicase viral |
| 3 | 2591 | VP3 | 88 | Nos vértices do core | <25 | encima guanilil transferase que coloca a carapucha 5' ao ARNm |
| 4 | 2362 | VP4 | 87 | Espícula de superficie | 120 | Unión á célula, virulencia |
| 5 | 1611 | NSP1 | 59 | Non estrutural | 0 | unión ao extremo 5' do ARN |
| 6 | 1356 | VP6 | 45 | Cápside interna | 780 | Estrutural e antíxeno específico de especie |
| 7 | 1104 | NSP3 | 37 | Non estrutural | 0 | Aumenta a actividade do ARNm viral e detén a síntese proteica celular |
| 8 | 1059 | NSP2 | 35 | Non estrutural | 0 | NTPase implicada no empaquetamento do ARN |
| 9 | 1062 | VP71 VP72 | 38 e 34 | Superficie | 780 | Estrutural e antíxeno de neutralización |
| 10 | 751 | NSP4 | 20 | Non estrutural | 0 | Enterotoxina |
| 11 | 667 | NSP5 NSP6 | 22 | Non estrutural | 0 | modulador que se une a ARN monocatenario e bicatenario de NSP2 |
Esta táboa está baseada no estudo da cepa de rotavirus simia SA11.[41][42][43] As asignacións de codificación ARN-proteína difiren nalgunhas cepas.
Replicación
[editar | editar a fonte]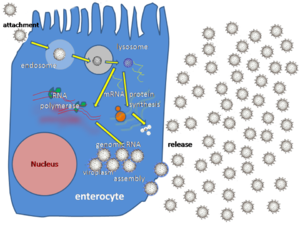
Os rotavirus replícanse principalmente no tracto gastrointestinal,[44] e infectan aos enterocitos que tapizan as vilosidades (villi) do intestino delgado, causando cambios estruturais e funcionais no epitelio.[45] O triplo recubrimento proteico do virus faino resistante ao pH ácido do estómago e aos encimas dixestivos do tracto gastrointestinal.
O virus entra nas células por endocitose mediada por receptor e forma unha vesícula chamada endosoma. As proteínas da terceira capa (VP7 e a espícula VP4) interrompen a membrana do endosoma, orixinando unha diferenza na concentración de calcio. Isto causa a rotura dos trímeros de VP7 en subunidades proteicas separadas, deixando capas das proteínas VP2 e VP6 arredor do ARN bicatenario viral, formando unha partícula de dobre capa (DLP).[46]
As once moléculas de ARN bicatenario permanecen dentro das dúas capas proteicas protectoras e a ARN polimerase ARN dependente viral xera transcritos de ARNm do xenoma viral bicatenario. Ao permanecer dentro do core, o ARN viral consegue evadir as respostas inmunitarias do hóspede que utilizan a interferencia de ARN, que se activan pola presenza de ARN bicatenario na célula.
Durante a infección, o rotavirus produce ARNm tanto para a síntese de proteínas coma para a replicación xénica. A maioría das proteína do rotavirus acumúlanse no viroplasma, onde se replica o ARN e se ensamblan as partículas de dobre capa (DLPs). O viroplasma fórmase arredor do núcleo celular en só dúas horas despois da infección vírica, e consta de factorías de virus que se cre están feitas por dúas das proteínas non estruturais: NSP5 e NSP2. A inhibición de NSP5 por interferencia de ARN dá lugar a un acusado decrecemento na replicación dos rotavirus. As partículas de dobre capa migran ao retículo endoplasmático, onde adquiren a súa terceira capa, a máis externa (formada por VP7 e VP4). Os virus fillos libéranse da célula por lise.[29][47][48]
Infeccións por rotavirus
[editar | editar a fonte]Os rotavirus producen gastroenterites.
Signos e síntomas
[editar | editar a fonte]A gastroenterite producida por rotavirus é unha enfermidade que pode ser leve ou grave caracterizada por vómitos, diarrea acuosa, e febre baixa. Afecta sobre todo a nenos. Unha vez que o neno é infectado polo virus, hai un período de incubación de aproximadamente dous días antes de que aparezan os síntomas.[49] Estes xeralmente empezan con vómitos seguidos por de catro a oito días de diarrea abundante. A deshidración é máis común na infección por rotavirus que na maioría das causadas por patóxenos bacterianos, e é a causa máis común das mortes relacionadas coas infeccións por rotavirus.[50]
As infeccións por rotavirus A poden ocorer durante toda a vida: a primeira vez xeralmente produce síntomas, pero as sucesivas posibles infeccións son normalmente leves ou asintomáticas,[31][51] xa que o sistema inmunitario proporciona certa protección contra o virus.[52][53] En consecuencia, a frecuencia de infeccións sintomáticas é máis alta en nenos de menos de dous anos e decrece progresivamente ata os 45 anos.[54] A infección nos neonatos é común, pero xeralmente produce unha enfermidade asintomática ou leve;[3] a maioría dos síntomas graves adoitan presentarse en nenos entre os seis meses e os dous anos de idade, ou entre as persoas vellas e os que teñen inmunodeficiencia. Debido á inmunidade adquirida durante a infancia, a maioría dos adultos non son susceptibles aos rotavirus; e as gastroenterites que aparecen nos adultos xeralmente teñen outros axentes causantes, pero as infeccións asintomáticas nos adultos poden manter a transmisión da infección na comunidade.[55]
Transmisión
[editar | editar a fonte]
O rotavirus transmítese pola ruta fecal-oral, por contacto con mans contaminadas, superficies e obxectos,[56] e posiblemente pola ruta respiratoria.[1] As feces dunha persoa infectda poden conter máis de 10 trillóns de partículas infecciosas por gramo;[31] e só son necesarias menos de 100 partículas para transmitir a infección a outra persoa.[3]
Os rotavirus son estables no medio ambiente e atopáronse en mostras tomadas de estuarios, e o virus permanece infectivo entre 9 e 19 días.[57] As medidas sanitarias usadas para eliminar bacterias e parasitos parecen non ser efectivas para controlar aos rotavirus, xa que a incidencia de infeccións por rotavirus en países cun alto nivel sanitario é similar á que teñen os de nivel menor.[1]
Mecanismos da doenza
[editar | editar a fonte]
A diarrea é causada por diversas actividades que realiza o virus. A mala absorción prodúcese porque se destrúen as células do epitelio intestinal (enterocitos). A proteína de rotavirus tóxica NSP4 induce unha secreción de cloruro dependente do ión calcio e da idade, que interrompe a reabsorción de auga mediada polo transportador SGLT1, reducindo aparentemente a actividade das disacaridases da membrana do bordo en cepillo dos enterocitos, e posiblemente activando os reflexos secretores dependentes de ión calcio do sistema nervioso entérico.[37] Os enterocitos intactos segregan lactase no intestino delgado; e a intolerancia á lactosa do leite debido á deficiencia de lactase é un síntoma de infección por rotavirus,[58] que pode persistir durante semanas.[59] A miúdo a diarrea reaparece cando se reintroduce o leite na dieta do neno, debido á fermentación bacteriana do azucre disacárido lactosa no intestino.[60]
Diagnose e detección
[editar | editar a fonte]A diagnose das infeccións por rotavirus normalmente se fai unha vez que se diagnostica gastroenterite como a causa dunha diarrea grave. Á maioría dos nenos ingresados en hospitais con gastroenterite fáiselle a proba de detección do rotavirus A[61][62] A diagnose específica da infección por rotavirus A faise procurando o virus nas feces dos nenos por inmunoensaio encimático. Os test son sensibles e específicos e detectan todos os serotipos do rotavirus A.[25] En laboratorios de investigación poden utilizarse outros métodos, como a microscopía electrónica e a PCR.[63] A PCR con reversotranscrición (RT-PCR) pode detectar e identificar todas as especies e serotipos de rotavirus humanos.[64]
Tratamento e prognose
[editar | editar a fonte]O tratamento das infeccións por rotavirus agudas non é específico e implica o tratamento dos síntomas e, o que é máis importante, o mantemento da hidratación.[11] Se non se trata, os nenos poden morrer como resultado dunha grave deshidratación.[65] Dependendo da gravidade da diarrea, o tratamento consiste nunha terapia de rehidratación oral, durante a cal se lle dá ao neno auga extra para beber que contén pequenas cantidades de sales e azucre.[66] En 2004, a OMS e a UNICEF recomendaron o uso de solucións de rehidratación oral de baixa osmolaridade e suplementación de cinc como dobre tratamento da diarrea aguda.[67] Algunhas infeccións son graves dabondo como para requirir hospitalización, durante a cal os fluídos se administran por vía intravenosa ou por tubo nasogástrico, e poden monitorizarse os niveis de electrólitos e glicemia do neno.[61] As infeccións por rotavirus raramente causan outras complicacións, e se o neno recibe o tratamento axeitado o prognóstico é moi bo.[68]
Epidemioloxía
[editar | editar a fonte]
O rotavirus A é o causante de máis do 90% das gastroenterites por rotavirus nos humanos,[69] e é endémico en todo o mundo. Cada ano os rotavirus causan millóns de casos de diarrea nos países vías de desenvolvemento, case 2 millóns requiren hospitalización[6] e estímase que se producen 453.000 mortes de nenos menores de 5 anos por esta causa,[8] o 85% dos cales viven en países non desenvolvidos.[9][70][10] O importante papel dos rotavirus como causante de diarreas non está suficientemente recoñecido pola comunidade sanitaria en todo o mundo,[71] especialmente nos países en vías de desenvolvemento.[6] Pode dicirse que practicamente todos os nenos foron infectados por rotavirus antes dos 5 anos.[72] Entre os nenos pequenos é a principal causa de diarrea grave, e é responsable de aproximadamente do 20% dos casos, e do 50% das hospitalizacións nesa franxa de idade.[6] Os rotavirus causan o 37% das mortes atribuídas a todos os tipos de diarrea e o 5% de todas as mortes infantís por debaixo dos 5 anos de idade.[5][8][73] As infeccións por rotavirus teñen lugar principalmente durante os meses fríos e secos.[74][75] O número de casos que se pode atribuír a comida contaminada non se coñece.[76] Noutra estimación feita pola UNICEF e a OMS indícase o seguinte: "Estímase que o rotavirus causa o 40% de todos os ingresos hospitalarios debido a diarreas entre os nenos por debaixo de 5 anos de idade en todo o mundo e orixina 100 millóns de episodios de diarrea aguda todos os anos, que teñen como resultado a morte de entre 350.000 e 600.000 nenos".[77]
Os estalidos de diarrea por rotavirus A son comúns entre os nenos pequenos hospitalizados, os nenos maiores en garderías, e persoas vellas en residencias da terceira idade.[78][79] En 2005 produciuse en Nicaragua unha grande epidemia diarreica por rotavirus asociada con mutacións no xenoma do rotavirus A, que posiblemente fixeron que o virus evitase a estendida inmunidade da poboación.[80][81]
O rotavirus B, tamén chamado rotavirus da diarrea dos adultos ou ADRV, causou importantes epidemias na China que afectaron a miles de persoas de todas as idades, e que foron resultado da contaminación das augas potables con augas residuais.[82][83] Tamén houbo infeccións por rotavirus B na India en 1998 por unha cepa chamada CAL, que ,a diferenza do ADRV, é endémica.[84][85] Ata agora, as epidemias causadas por rotavirus B están confinadas fundamentalmente na China.[86]
O rotavirus C foi asociado con casos raros e esporádicos de diarrea en nenos, que poden afectar a toda a familia.[87]
Vacina
[editar | editar a fonte]- Artigo principal: Vacina do rotavirus.

Como a mellora das medidas hixiénicas non diminúe a prevalencia das doenzas retrovirais, e a frecuencia de hospitalizacións se mantén alta a pesar do uso de terapia de rehidratación oral, a principal intervención sanitaria que se pode aplicar é a vacinación.[2] Elaboráronse dúas vacinas contra as infeccións por rotavirus A que son seguras e efectivas en nenos:[13] Rotarix de GlaxoSmithKline[88] e RotaTeq de Merck.[89] Ambas as dúas son de administración por vía oral e conteñen virus atenuados vivos.[13] En 2009, a OMS recomendou que se incluíse unha vacina contra os rotavirus en todos os programas nacionais de inmunización.[90] A incidencia e gravidade das infeccións por rotavirus diminuíu significativamente nos países que aplicaron esta recomendación.[12][13] Por exemplo, en México, que en 2006 estaba entre os primeiros países do mundo que introduciu a vacinación contra os rotavirus, as taxas de enfermidades diarreicas caeron durante a temporada de rotavirus de 2009 en máis do 65% entre os nenos de menos de 2 anos.[91] En Nicaragua, que en 2006 se converteu no primeiro país en vías de desenvolvemento en introducir vacina do rotavirus, as infeccións graves por rotavirus reducíronse nun 40% e o ingreso en coidados intensivos á metade.[92] Nos Estados Unidos a vacinación contra os rotavirus desde 2006 fixo reducir as hospitalizacións relacionadas con rotavirus nun 86%. As vacinas puideron tamén servir de prevención da enfermidade en nenos non vacinados ao limitar o número de infeccións circulantes.[93]
Hai licenzas de vacinas contra o rotavirus en máis de 100 países, pero só 28[94] países introduciron nos seus plans de vacinación rotineiros a vacinación contra os rotavirus.[95][96][97] Os ensaios sobre seguridade e eficacia das vacinas Rotarix e RotaTeq en África e Asia encontraron que as vacinas reducían drasticamente as diarreas graves entre os nenos nos países en vías de desenvolvemento, nos cales ocorrían a maioría das mortes por rotavirus.[98] En 2012 a revisión Cochrane de 41 ensaios clínicos nos que participaran 186 263 persoas concluíu que Rotarix e RotaTeq son vacinas efectivas.[99] Estanse desenvolvendo outras vacinas contra os rotavirus.[100] A partir de setembro de 2013, ofrecerase a vacina para todos os nenos no Reino Unido entre dous e tres meses de idade.[101] No Estado Español a vacinación por rotavirus non forma parte do programa xeral de vacinación (ano 2012) nin está financiada pola sanidade pública, pero si recomendada polo Comité Asesor de Vacinas da Asociación Española de Pediatría [102] e pola Sociedade Europea de Gastroenteroloxía, Hepatoloxía e Nutrición Pediátrica (ESPGHAN) e a Sociedade Europea de Infectoloxía Pediátrica (ESPID) e a Organización Mundial da Saúde (OMS).
A organización non gobernamental PATH, a OMS, os Centers for Disease Control and Prevention dos Estados Unidos, e a GAVI Alliance están traballando para levar as vacinas de rotavirus aos países en vías de desenvolvemento, onde se producen a maioría dos casos e mortes en nenos.[103]
Infección noutros animais
[editar | editar a fonte]Os rotavirus infectan as crías de moitas especies de animais e son unha importante causa de diarreas en animais salvaxes e domésticos en todo o mundo.[7] Como son patóxenos do gando, especialmente de cuxos e bácoros, os rotavirus causan perdas económicas aos gandeiros debido aos custos dos tratamentos asociados con altos graos de morbilidade e mortalidade.[104] Estes rotavirus que afectan aos animais son un reservorio potencial para o intercambio xenético cos rotavirus humanos.[104] Hai evidencias de que os rotavirus animais poden infectar aos humanos, quer por transmisión directa do virus quer por ceder un ou varios dos seus segmentos xenómicos de ARN ás cepas humanas (por redistribución ou reassortment).[105][106]
Historia
[editar | editar a fonte]
En 1943, Jacob Light e Horace Hodes probaron que un axente filtrable presente nas feces de nenos con diarrea infecciosa tamén causaba diarrea no gando vacún.[107] Tres décadas despois, probouse que mostras conservadas deste axente eran rotavirus.[108] Nos anos intermedios, atopouse un virus dos ratos[109] que estaba relacionado co virus que causaba diarrea nas vacas.[110] En 1973, Ruth Bishop e colegas describiron varios virus relacionados que se atoparon en nenos con gastroenterite.[4]
En 1974, Thomas Henry Flewett propuxo para eles o nome rotavirus ao observar que, cando se vían por microcopio electrónico, as partículas de rotavirus parecían rodas (rota en latín);[111][112] o nome foi recoñecido oificialmente polo Comité Internacional de Taxonomía de Virus (ICTV) catro anos despois.[113] En 1976, describíronse outros virus relacionados noutras especies animais.[110] Estes virus causaban gastroenterites agudas, e foron recoñecidos como un grupo de patóxenos que afectaban a humanos e animais en todo o mundo.[111] Os serotipos dos rotavirus describíronse en 1980,[114] e no seguinte ano, cultivouse por primeira vez (en cultivo celular de células de ril de mono) un rotavirus de procedencia humana, ao engadir ao medio de cultivo tripsina (un encima que se encontra no duodeno dos mamíferos e que agora se sabe que é esencial para a replicación do rotavirus).[115] A capacidade de cultivar rotavirus en cultivos celulares acelerou o ritmo das investigacións, e a mediados da década de 1980 avaliouse a primeira vacina contra o rotavirus.[116]
En 1998, unha vacina do rotavirus obtivo licenza nos Estados Unidos de América. Os ensaios clínicos con esta vacina realizados nos Estados Unidos, Finlandia, e Venezuela atoparon que tiña unha efectividade do 80% na prevención das diarreas graves causadas polo rotavirus A, e non se detectaron efectos adversos graves estatisticamente significativos.[117][118] Porén, o fabricante retirou a vacina do mercado en 1999, ao descubrirse que a vacina podía ter contribuído a un incremento do risco de invaxinación intestinal (intususcepción), un tipo de obstrución intestinal, nun de cada 12.000 nenos vacinados.[119] A experiencia provocou un intenso debate sobre os beneficios e riscos relativos da vacina do rotavirus.[120] En 2006, demostrouse que dúas novas vacinas contra a infección por rotavirus A eran seguras e efectivas en nenos,[121] e en xuño de 2009 a Organización Mundial da Saúde recomendou que a vacinación contra os rotavirus fose incluída en todos os programas de vacinaciónn nacionais para proporcionar protección contra este virus.[122]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 Dennehy PH (2000). "Transmission of rotavirus and other enteric pathogens in the home". Pediatr. Infect. Dis. J. 19 (10 Suppl): S103–5. PMID 11052397. doi:10.1097/00006454-200010001-00003.
- ↑ 2,0 2,1 Bernstein DI (2009). "Rotavirus overview". The Pediatric Infectious Disease Journal 28 (3 Suppl): S50–3. PMID 19252423. doi:10.1097/INF.0b013e3181967bee. Arquivado dende o orixinal o 11 de maio de 2013. Consultado o 19 de setembro de 2013.
- ↑ 3,0 3,1 3,2 Grimwood K, Lambert SB (2009). "Rotavirus vaccines: opportunities and challenges". Human Vaccines 5 (2): 57–69. PMID 18838873. doi:10.4161/hv.5.2.6924.
- ↑ 4,0 4,1 Bishop R (2009). "Discovery of rotavirus: Implications for child health". Journal of Gastroenterology and Hepatology 24 (Suppl 3): S81–5. PMID 19799704. doi:10.1111/j.1440-1746.2009.06076.x.
- ↑ 5,0 5,1 Rheingans RD, Heylen J, Giaquinto C (2006). "Economics of rotavirus gastroenteritis and vaccination in Europe: what makes sense?". Pediatr. Infect. Dis. J. 25 (1 Suppl): S48–55. PMID 16397429. doi:10.1097/01.inf.0000197566.47750.3d.
- ↑ 6,0 6,1 6,2 6,3 6,4 Simpson E, Wittet S, Bonilla J, Gamazina K, Cooley L, Winkler JL (2007). "Use of formative research in developing a knowledge translation approach to rotavirus vaccine introduction in developing countries". BMC Public Health 7: 281. PMC 2173895. PMID 17919334. doi:10.1186/1471-2458-7-281.
- ↑ 7,0 7,1 Edward J Dubovi; Nigel James MacLachlan (2010). Fenner's Veterinary Virology, Fourth Edition. Boston: Academic Press. p. 288. ISBN 0-12-375158-6.
- ↑ 8,0 8,1 8,2 Tate JE, Burton AH, Boschi-Pinto C, Steele AD, Duque J, Parashar UD (2012). "2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis". Lancet Infect Dis 12 (2): 136–141. PMID 22030330. doi:10.1016/S1473-3099(11)70253-5.
- ↑ 9,0 9,1 World Health Organization (2008). "Global networks for surveillance of rotavirus gastroenteritis, 2001–2008" (PDF). Weekly Epidemiological Record 83 (47): 421–428. Consultado o 3 May 2012.
- ↑ 10,0 10,1 Fischer TK, Viboud C, Parashar U; et al. (2007). "Hospitalizations and deaths from diarrhea and rotavirus among children <5 years of age in the United States, 1993–2003". J. Infect. Dis. 195 (8): 1117–25. PMID 17357047. doi:10.1086/512863.
- ↑ 11,0 11,1 Diggle L (2007). "Rotavirus diarrhoea and future prospects for prevention". Br. J. Nurs. 16 (16): 970–4. PMID 18026034.
- ↑ 12,0 12,1 Giaquinto C, Dominiak-Felden G, Van Damme P, Myint TT, Maldonado YA, Spoulou V, Mast TC, Staat MA (2011). "Summary of effectiveness and impact of rotavirus vaccination with the oral pentavalent rotavirus vaccine: a systematic review of the experience in industrialized countries". Human Vaccines 7 (7): 734–48. PMID 21734466. doi:10.4161/hv.7.7.15511.
- ↑ 13,0 13,1 13,2 13,3 Jiang V, Jiang B, Tate J, Parashar UD, Patel MM (2010). "Performance of rotavirus vaccines in developed and developing countries". Human Vaccines 6 (7): 532–42. PMC 3322519. PMID 20622508. doi:10.4161/hv.6.7.11278.
- ↑ 14,0 14,1 Kirkwood CD (2010). "Genetic and antigenic diversity of human rotaviruses: potential impact on vaccination programs". The Journal of Infectious Diseases 202 (Suppl): S43–8. PMID 20684716. doi:10.1086/653548.
- ↑ O'Ryan M (2009). "The ever-changing landscape of rotavirus serotypes". The Pediatric Infectious Disease Journal 28 (3 Suppl): S60–2. PMID 19252426. doi:10.1097/INF.0b013e3181967c29.
- ↑ Patton JT (2012). "Rotavirus diversity and evolution in the post-vaccine world". Discovery Medicine 13 (68): 85–97. PMID 22284787.
- ↑ Desselberger U, Wolleswinkel-van den Bosch J, Mrukowicz J, Rodrigo C, Giaquinto C, Vesikari T (2006). "Rotavirus types in Europe and their significance for vaccination". Pediatr. Infect. Dis. J. 25 (1 Suppl.): S30–41. PMID 16397427. doi:10.1097/01.inf.0000197707.70835.f3. Arquivado dende o orixinal o 11 de maio de 2013. Consultado o 19 de setembro de 2013.
- ↑ Estes MK, Cohen J (1989). "Rotavirus gene structure and function". Microbiological Reviews 53 (4): 410–49. PMC 372748. PMID 2556635.
- ↑ 19,0 19,1 Pesavento JB, Crawford SE, Estes MK, Prasad BV (2006). "Rotavirus proteins: structure and assembly". Curr. Top. Microbiol. Immunol. 309: 189–219. PMID 16913048. doi:10.1007/3-540-30773-7_7.
- ↑ Prasad BV, Chiu W (1994). "Structure of rotavirus". Curr. Top. Microbiol. Immunol. 185: 9–29. PMID 8050286.
- ↑ Patton JT (1995). "Structure and function of the rotavirus RNA-binding proteins". J. Gen. Virol. 76 (11): 2633–44. PMID 7595370. doi:10.1099/0022-1317-76-11-2633. Arquivado dende o orixinal (PDF) o 09 de decembro de 2012. Consultado o 19 de setembro de 2013.
- ↑ Patton JT (2001). "Rotavirus RNA replication and gene expression". Novartis Found. Symp. 238: 64–77; discussion 77–81. PMID 11444036. doi:10.1002/0470846534.ch5.
- ↑ Vásquez-del Carpió R, Morales JL, Barro M, Ricardo A, Spencer E (2006). "Bioinformatic prediction of polymerase elements in the rotavirus VP1 protein". Biol. Res. 39 (4): 649–59. PMID 17657346. doi:10.4067/S0716-97602006000500008.
- ↑ Arnoldi F, Campagna M, Eichwald C, Desselberger U, Burrone OR (2007). "Interaction of rotavirus polymerase VP1 with nonstructural protein NSP5 is stronger than that with NSP2". J. Virol. 81 (5): 2128–37. PMC 1865955. PMID 17182692. doi:10.1128/JVI.01494-06. Arquivado dende o orixinal o 28 de setembro de 2011. Consultado o 19 de setembro de 2013.
- ↑ 25,0 25,1 Angel J, Franco MA, Greenberg HB (2009). Mahy BWJ; Van Regenmortel MHV, eds. Desk Encyclopedia of Human and Medical Virology. Boston: Academic Press. p. 277-278. ISBN 0-12-375147-0.
- ↑ Cowling VH (2010). "Regulation of mRNA cap methylation". Biochem. J. 425 (2): 295–302. PMC 2825737. PMID 20025612. doi:10.1042/BJ20091352.
- ↑ Gardet A, Breton M, Fontanges P, Trugnan G, Chwetzoff S (2006). "Rotavirus spike protein VP4 binds to and remodels actin bundles of the epithelial brush border into actin bodies". J. Virol. 80 (8): 3947–56. PMC 1440440. PMID 16571811. doi:10.1128/JVI.80.8.3947-3956.2006. Arquivado dende o orixinal o 28 de setembro de 2011. Consultado o 19 de setembro de 2013.
- ↑ Arias CF, Isa P, Guerrero CA, Méndez E, Zárate S, López T, Espinosa R, Romero P, López S (2002). "Molecular biology of rotavirus cell entry". Arch. Med. Res. 33 (4): 356–61. PMID 12234525. doi:10.1016/S0188-4409(02)00374-0.
- ↑ 29,0 29,1 Jayaram H, Estes MK, Prasad BV (2004). "Emerging themes in rotavirus cell entry, genome organization, transcription and replication". Virus Research 101 (1): 67–81. PMID 15010218. doi:10.1016/j.virusres.2003.12.007.
- ↑ Hoshino Y, Jones RW, Kapikian AZ (2002). "Characterization of neutralization specificities of outer capsid spike protein VP4 of selected murine, lapine, and human rotavirus strains". Virology 299 (1): 64–71. PMID 12167342. doi:10.1006/viro.2002.1474.
- ↑ 31,0 31,1 31,2 Bishop RF (1996). "Natural history of human rotavirus infection". Arch. Virol. Suppl. 12: 119–28. PMID 9015109.
- ↑ Beards GM, Campbell AD, Cottrell NR, Peiris JS, Rees N, Sanders RC, Shirley JA, Wood HC, Flewett TH (1 February 1984). "Enzyme-linked immunosorbent assays based on polyclonal and monoclonal antibodies for rotavirus detection". J. Clin. Microbiol. 19 (2): 248–54. PMC 271031. PMID 6321549. Arquivado dende o orixinal (PDF) o 27 de setembro de 2011. Consultado o 19 de setembro de 2013.
- ↑ Hua J, Mansell EA, Patton JT (1993). "Comparative analysis of the rotavirus NS53 gene: conservation of basic and cysteine-rich regions in the protein and possible stem-loop structures in the RNA". Virology 196 (1): 372–8. PMID 8395125. doi:10.1006/viro.1993.1492.
- ↑ Kattoura MD, Chen X, Patton JT (1994). "The rotavirus RNA-binding protein NS35 (NSP2) forms 10S multimers and interacts with the viral RNA polymerase". Virology 202 (2): 803–13. PMID 8030243. doi:10.1006/viro.1994.1402.
- ↑ Taraporewala ZF, Patton JT (2004). "Nonstructural proteins involved in genome packaging and replication of rotaviruses and other members of the Reoviridae". Virus Res. 101 (1): 57–66. PMID 15010217. doi:10.1016/j.virusres.2003.12.006.
- ↑ Poncet D, Aponte C, Cohen J (1 June 1993). "Rotavirus protein NSP3 (NS34) is bound to the 3' end consensus sequence of viral mRNAs in infected cells". J. Virol. 67 (6): 3159–65. PMC 237654. PMID 8388495. Arquivado dende o orixinal (PDF) o 28 de setembro de 2011. Consultado o 19 de setembro de 2013.
- ↑ 37,0 37,1 Hyser JM, Estes MK (2009). "Rotavirus vaccines and pathogenesis: 2008". Current Opinion in Gastroenterology 25 (1): 36–43. PMC 2673536. PMID 19114772. doi:10.1097/MOG.0b013e328317c897. Arquivado dende o orixinal o 11 de maio de 2013. Consultado o 19 de setembro de 2013.
- ↑ Afrikanova I, Miozzo MC, Giambiagi S, Burrone O (1996). "Phosphorylation generates different forms of rotavirus NSP5". J. Gen. Virol. 77 (9): 2059–65. PMID 8811003. doi:10.1099/0022-1317-77-9-2059. Arquivado dende o orixinal o 26 de maio de 2012. Consultado o 19 de setembro de 2013.
- ↑ Rainsford EW, McCrae MA (2007). "Characterization of the NSP6 protein product of rotavirus gene 11". Virus Res. 130 (1–2): 193–201. PMID 17658646. doi:10.1016/j.virusres.2007.06.011.
- ↑ Mohan KV, Atreya CD (2001). "Nucleotide sequence analysis of rotavirus gene 11 from two tissue culture-adapted ATCC strains, RRV and Wa". Virus Genes 23 (3): 321–9. PMID 11778700. doi:10.1023/A:1012577407824.
- ↑ Desselberger U. Rotavirus: basic facts. In Rotaviruses Methods and Protocols. Ed. Gray, J. and Desselberger U. Humana Press, 2000, pp. 1–8. ISBN 0-89603-736-3
- ↑ Patton JT. Rotavirus RNA replication and gene expression. In Novartis Foundation. Gastroenteritis Viruses, Humana Press, 2001, pp. 64–81. ISBN 0-471-49663-4
- ↑ Claude M. Fauquet; J. Maniloff; Desselberger, U. (2005). Virus taxonomy: classification and nomenclature of viruses: 8th report of the International Committee on Taxonomy of Viruses. Amsterdam: Elsevier/Academic Press. pp. 489. ISBN 0-12-249951-4.
- ↑ Greenberg HB, Estes MK (2009). "Rotaviruses: from pathogenesis to vaccination". Gastroenterology 136 (6): 1939–51. PMID 19457420. doi:10.1053/j.gastro.2009.02.076.
- ↑ Greenberg HB, Clark HF, Offit PA (1994). "Rotavirus pathology and pathophysiology". Curr. Top. Microbiol. Immunol. 185: 255–83. PMID 8050281.
- ↑ Baker M, Prasad BV (2010). "Rotavirus cell entry". Current Topics in Microbiology and Immunology 343: 121–48. PMID 20397068. doi:10.1007/82_2010_34.
- ↑ Patton JT, Vasquez-Del Carpio R, Spencer E (2004). "Replication and transcription of the rotavirus genome". Curr. Pharm. Des. 10 (30): 3769–77. PMID 15579070. doi:10.2174/1381612043382620.
- ↑ Ruiz MC, Leon T, Diaz Y, Michelangeli F (2009). "Molecular biology of rotavirus entry and replication". TheScientificWorldJournal 9: 1476–97. PMID 20024520. doi:10.1100/tsw.2009.158.
- ↑ Hochwald C, Kivela L (1999). "Rotavirus vaccine, live, oral, tetravalent (RotaShield)". Pediatr. Nurs. 25 (2): 203–4, 207. PMID 10532018.
- ↑ Maldonado YA, Yolken RH (1990). "Rotavirus". Baillieres Clin. Gastroenterol. 4 (3): 609–25. PMID 1962726. doi:10.1016/0950-3528(90)90052-I.
- ↑ Glass RI, Parashar UD, Bresee JS, Turcios R, Fischer TK, Widdowson MA, Jiang B, Gentsch JR (2006). "Rotavirus vaccines: current prospects and future challenges". Lancet 368 (9532): 323–32. PMID 16860702. doi:10.1016/S0140-6736(06)68815-6.
- ↑ Offit PA (2001). Gastroenteritis viruses. New York: Wiley. pp. 106–124. ISBN 0-471-49663-4.
- ↑ Ward R (2009). "Mechanisms of protection against rotavirus infection and disease". The Pediatric Infectious Disease Journal 28 (3 Suppl): S57–9. PMID 19252425. doi:10.1097/INF.0b013e3181967c16.
- ↑ Desselberger, U.; Gray, James (2000). Desselberger, U.; Gray, James, ed. Rotaviruses: methods and protocols. Totowa, NJ: Humana Press. p. 2 e 217. ISBN 0-89603-736-3.
- ↑ Hrdy DB (1987). "Epidemiology of rotaviral infection in adults". Rev. Infect. Dis. 9 (3): 461–9. PMID 3037675. doi:10.1093/clinids/9.3.461.
- ↑ Butz AM, Fosarelli P, Dick J, Cusack T, Yolken R (1993). "Prevalence of rotavirus on high-risk fomites in day-care facilities". Pediatrics 92 (2): 202–5. PMID 8393172.
- ↑ Rao VC, Seidel KM, Goyal SM, Metcalf TG, Melnick JL (1 August 1984). "Isolation of enteroviruses from water, suspended solids, and sediments from Galveston Bay: survival of poliovirus and rotavirus adsorbed to sediments". Appl. Environ. Microbiol. 48 (2): 404–9. PMC 241526. PMID 6091548. Arquivado dende o orixinal (PDF) o 27 de setembro de 2011. Consultado o 19 de setembro de 2013.
- ↑ Farnworth ER (2008). "The evidence to support health claims for probiotics". The Journal of Nutrition 138 (6): 1250S–4S. PMID 18492865.
- ↑ Ouwehand A, Vesterlund S (2003). "Health aspects of probiotics". IDrugs 6 (6): 573–80. PMID 12811680.
- ↑ Arya SC (1984). "Rotaviral infection and intestinal lactase level". J. Infect. Dis. 150 (5): 791. PMID 6436397.
- ↑ 61,0 61,1 Patel MM, Tate JE, Selvarangan R, Daskalaki I, Jackson MA, Curns AT, Coffin S, Watson B, Hodinka R, Glass RI, Parashar UD (2007). "Routine laboratory testing data for surveillance of rotavirus hospitalizations to evaluate the impact of vaccination". The Pediatric Infectious Disease Journal 26 (10): 914–9. PMID 17901797. doi:10.1097/INF.0b013e31812e52fd.
- ↑ The Pediatric ROTavirus European CommitTee (PROTECT) (2006). "The paediatric burden of rotavirus disease in Europe". Epidemiol. Infect. 134 (5): 908–16. PMC 2870494. PMID 16650331. doi:10.1017/S0950268806006091.
- ↑ Goode, Jamie; Chadwick, Derek (2001). Gastroenteritis viruses. New York: Wiley. p. 14. ISBN 0-471-49663-4.
- ↑ Fischer TK, Gentsch JR (2004). "Rotavirus typing methods and algorithms". Reviews in Medical Virology 14 (2): 71–82. PMID 15027000. doi:10.1002/rmv.411.
- ↑ Alam NH, Ashraf H (2003). "Treatment of infectious diarrhea in children". Paediatr. Drugs 5 (3): 151–65. PMID 12608880.
- ↑ Sachdev HP (1996). "Oral rehydration therapy". Journal of the Indian Medical Association 94 (8): 298–305. PMID 8855579.
- ↑ World Health Organization, UNICEF. "Joint Statement: Clinical Management of Acute Diarrhoea" (PDF). Consultado o 3 May 2012.
- ↑ Ramig RF (2007). "Systemic rotavirus infection". Expert Review of Anti-infective Therapy 5 (4): 591–612. PMID 17678424. doi:10.1586/14787210.5.4.591.
- ↑ Leung AK, Kellner JD, Davies HD (2005). "Rotavirus gastroenteritis". Adv. Ther. 22 (5): 476–87. PMID 16418157. doi:10.1007/BF02849868.
- ↑ Centers for Disease Control and Prevention (CDC) (2009). "Reduction in rotavirus after vaccine introduction—United States, 2000–2009". MMWR. Morbidity and Mortality Weekly Report 58 (41): 1146–9. PMID 19847149. Consultado o 2009-12-20.
- ↑ Rodrigo C, Salman N, Tatochenko V, Mészner Z, Giaquinto C (2010). "Recommendations for rotavirus vaccination: A worldwide perspective". Vaccine 28 (31): 5100–8. PMID 20472032. doi:10.1016/j.vaccine.2010.04.108.
- ↑ Parashar UD, Gibson CJ, Bresse JS, Glass RI (2006). "Rotavirus and severe childhood diarrhea". Emerging Infect. Dis. 12 (2): 304–6. PMID 16494759. doi:10.3201/eid1202.050006.
- ↑ Ryan MJ, Ramsay M, Brown D, Gay NJ, Farrington CP, Wall PG (1996). "Hospital admissions attributable to rotavirus infection in England and Wales". J. Infect. Dis. 174 (Suppl 1): S12–8. PMID 8752285.
- ↑ Atchison CJ, Tam CC, Hajat S, van Pelt W, Cowden JM, Lopman BA (2010). "Temperature-dependent transmission of rotavirus in Great Britain and The Netherlands". Proceedings. Biological Sciences / the Royal Society 277 (1683): 933–42. PMC 2842727. PMID 19939844. doi:10.1098/rspb.2009.1755.
- ↑ Levy K, Hubbard AE, Eisenberg JN (2009). "Seasonality of rotavirus disease in the tropics: a systematic review and meta-analysis". International Journal of Epidemiology 38 (6): 1487–96. PMC 2800782. PMID 19056806. doi:10.1093/ije/dyn260.
- ↑ Koopmans M, Brown D (1999). "Seasonality and diversity of Group A rotaviruses in Europe". Acta Paediatrica Supplement 88 (426): 14–9. PMID 10088906. doi:10.1111/j.1651-2227.1999.tb14320.x.
- ↑ UNICEF/WHO (2009) "Diarrhoea: Why children are still dying and what can be done." Retrieved 23 May 2010
- ↑ Anderson EJ, Weber SG (2004). "Rotavirus infection in adults". The Lancet Infectious Diseases 4 (2): 91–9. PMID 14871633. doi:10.1016/S1473-3099(04)00928-4.
- ↑ Hopkins RS, Gaspard GB, Williams FP, Karlin RJ, Cukor G, Blacklow NR (1984). "A community waterborne gastroenteritis outbreak: evidence for rotavirus as the agent". American Journal of Public Health 74 (3): 263–5. PMC 1651463. PMID 6320684. doi:10.2105/AJPH.74.3.263.
- ↑ Bucardo F, Karlsson B, Nordgren J; et al. (2007). "Mutated G4P[8] rotavirus associated with a nationwide outbreak of gastroenteritis in Nicaragua in 2005". J. Clin. Microbiol. 45 (3): 990–7. PMC 1829148. PMID 17229854. doi:10.1128/JCM.01992-06. Arquivado dende o orixinal o 27 de setembro de 2011. Consultado o 19 de setembro de 2013.
- ↑ Linhares AC, Pinheiro FP, Freitas RB, Gabbay YB, Shirley JA, Beards GM (1981). "An outbreak of rotavirus diarrhea among a non-immune, isolated South American Indian community". Am. J. Epidemiol. 113 (6): 703–10. PMID 6263087.
- ↑ Hung T, Chen GM, Wang CG; et al. (1984). "Waterborne outbreak of rotavirus diarrhea in adults in China caused by a novel rotavirus". Lancet 1 (8387): 1139–42. PMID 6144874. doi:10.1016/S0140-6736(84)91391-6.
- ↑ Fang ZY, Ye Q, Ho MS; et al. (1989). "Investigation of an outbreak of adult diarrhea rotavirus in China". J. Infect. Dis. 160 (6): 948–53. PMID 2555422. doi:10.1093/infdis/160.6.948.
- ↑ Kelkar SD, Zade JK (2004). "Group B rotaviruses similar to strain CAL-1, have been circulating in Western India since 1993". Epidemiol. Infect. 132 (4): 745–9. PMC 2870156. PMID 15310177. doi:10.1017/S0950268804002171.
- ↑ Ahmed MU, Kobayashi N, Wakuda M, Sanekata T, Taniguchi K, Kader A, Naik TN, Ishino M, Alam MM, Kojima K, Mise K, Sumi A (2004). "Genetic analysis of group B human rotaviruses detected in Bangladesh in 2000 and 2001". J. Med. Virol. 72 (1): 149–55. PMID 14635024. doi:10.1002/jmv.10546.
- ↑ Penaranda ME, Ho MS, Fang ZY; et al. (1 October 1989). "Seroepidemiology of adult diarrhea rotavirus in China, 1977 to 1987". J. Clin. Microbiol. 27 (10): 2180–3. PMC 266989. PMID 2479654. Arquivado dende o orixinal (PDF) o 27/09/2011. Consultado o 19/09/2013.
- ↑ Desselberger U, Iturriza-Gomera, Gray JJ (2001). Gastroenteritis viruses. New York: Wiley. pp. 127–128. ISBN 0-471-49663-4.
- ↑ O'Ryan M (2007). "Rotarix (RIX4414): An oral human rotavirus vaccine". Expert review of vaccines 6 (1): 11–9. PMID 17280473. doi:10.1586/14760584.6.1.11.
- ↑ Matson DO (2006). "The pentavalent rotavirus vaccine, RotaTeq". Seminars in paediatric infectious diseases 17 (4): 195–9. PMID 17055370. doi:10.1053/j.spid.2006.08.005.
- ↑ Tate JE, Patel MM, Steele AD, Gentsch JR, Payne DC, Cortese MM, Nakagomi O, Cunliffe NA, Jiang B, Neuzil KM, de Oliveira LH, Glass RI, Parashar UD (2010). "Global impact of rotavirus vaccines". Expert Review of Vaccines 9 (4): 395–407. PMID 20370550. doi:10.1586/erv.10.17.
- ↑ Richardson, V; Hernandez-Pichardo J, Quintanar-Solares M; et al. (2010). "Effect of Rotavirus Vaccination on Death From Childhood Diarrhea in Mexico". The New England Journal of Medicine 362 (4): 299–305. PMID 20107215. doi:10.1056/NEJMoa0905211. Consultado o 8 May 2012.
- ↑ Patel M, Pedreira C, De Oliveira LH; et al. (2012). "Duration of protection of pentavalent rotavirus vaccination in Nicaragua". Pediatrics 130 (2): e365–72. PMID 22753550. doi:10.1542/peds.2011-3478.
- ↑ Patel, MM; Parashar UD, eds. (2011). "Real World Impact of Rotavirus Vaccination". Pediatric Infectious Disease Journal 30 (Supplement). Consultado o 8 May 2012.
- ↑ World Health Organization. "Global Immunization Data, March 2012" (PDF). Consultado o 3 May 2012.
- ↑ Widdowson MA, Steele D, Vojdani J, Wecker J, Parashar U (2009). "Global rotavirus surveillance: determining the need and measuring the impact of rotavirus vaccines". The Journal of Infectious Diseases 200 (Suppl 1): S1–8. PMID 19817589. doi:10.1086/605061.
- ↑ Tate JE, Cortese MM, Payne DC, Curns AT, Yen C, Esposito DH, Cortes JE, Lopman BA, Patel MM, Gentsch JR, Parashar UD (2011). "Uptake, impact, and effectiveness of rotavirus vaccination in the United States: review of the first 3 years of postlicensure data". The Pediatric Infectious Disease Journal 30 (1 Suppl): S56–60. PMID 21183842. doi:10.1097/INF.0b013e3181fefdc0.
- ↑ Waggie Z, Hawkridge A, Hussey GD (2010). "Review of rotavirus studies in Africa: 1976–2006". The Journal of Infectious Diseases 202 (Suppl): S23–33. PMID 20684708. doi:10.1086/653554.
- ↑ World Health Organization (2009). "Rotavirus vaccines: an update" (PDF). Weekly Epidemiological Record. 51–52 (84): 533–540. Consultado o 8 May 2012.
- ↑ Soares-Weiser K, Maclehose H, Bergman H; et al. (2012). "Vaccines for preventing rotavirus diarrhoea: vaccines in use". Cochrane Database Syst Rev 11: CD008521. PMID 23152260. doi:10.1002/14651858.CD008521.pub3.
- ↑ Ward RL, Clark HF, Offit PA (2010). "Influence of potential protective mechanisms on the development of live rotavirus vaccines". The Journal of Infectious Diseases 202 (Suppl): S72–9. PMID 20684721. doi:10.1086/653549.
- ↑ UK Department of Health: New vaccine to help protect babies against rotavirus. Retrieved on 10 November, 2012
- ↑ CAV-AEP El Portal de las vacunas de la Asociación Española de Pediatría [1]
- ↑ Moszynski P (2011). "GAVI rolls out vaccines against child killers to more countries". BMJ (Clinical Research Ed.) 343: d6217. PMID 21957215. doi:10.1136/bmj.d6217.
- ↑ 104,0 104,1 Martella V, Bányai K, Matthijnssens J, Buonavoglia C, Ciarlet M (2010). "Zoonotic aspects of rotaviruses". Veterinary Microbiology 140 (3–4): 246–55. PMID 19781872. doi:10.1016/j.vetmic.2009.08.028.
- ↑ Müller H, Johne R (2007). "Rotaviruses: diversity and zoonotic potential—a brief review". Berl. Munch. Tierarztl. Wochenschr. 120 (3–4): 108–12. PMID 17416132.
- ↑ Cook N, Bridger J, Kendall K, Gomara MI, El-Attar L, Gray J (2004). "The zoonotic potential of rotavirus". J. Infect. 48 (4): 289–302. PMID 15066329. doi:10.1016/j.jinf.2004.01.018.
- ↑ Light JS, Hodes HL (1943). "Studies on epidemic diarrhea of the new-born: Isolation of a Filtrable Agent Causing Diarrhea in Calves". Am. J. Public Health Nations Health 33 (12): 1451–4. PMC 1527675. PMID 18015921. doi:10.2105/AJPH.33.12.1451.
- ↑ Mebus CA, Wyatt RG, Sharpee RL; et al. (1 August 1976). "Diarrhea in gnotobiotic calves caused by the reovirus-like agent of human infantile gastroenteritis". Infect. Immun. 14 (2): 471–4. PMC 420908. PMID 184047. Arquivado dende o orixinal (PDF) o 29 de setembro de 2011. Consultado o 19 de setembro de 2013.
- ↑ Rubenstein D, Milne RG, Buckland R, Tyrrell DA (1971). "The growth of the virus of epidemic diarrhoea of infant mice (EDIM) in organ cultures of intestinal epithelium". British journal of experimental pathology 52 (4): 442–45. PMC 2072337. PMID 4998842.
- ↑ 110,0 110,1 Woode GN, Bridger JC, Jones JM, Flewett TH, Davies HA, Davis HA, White GB (1 September 1976). "Morphological and antigenic relationships between viruses (rotaviruses) from acute gastroenteritis in children, calves, piglets, mice, and foals". Infect. Immun. 14 (3): 804–10. PMC 420956. PMID 965097. Arquivado dende o orixinal (PDF) o 29 de setembro de 2011. Consultado o 19 de setembro de 2013.
- ↑ 111,0 111,1 Flewett TH, Woode GN (1978). "The rotaviruses". Arch. Virol. 57 (1): 1–23. PMID 77663. doi:10.1007/BF01315633.
- ↑ Flewett TH, Bryden AS, Davies H, Woode GN, Bridger JC, Derrick JM (1974). "Relation between viruses from acute gastroenteritis of children and newborn calves". Lancet 2 (7872): 61–3. PMID 4137164. doi:10.1016/S0140-6736(74)91631-6.
- ↑ Matthews RE (1979). "Third report of the International Committee on Taxonomy of Viruses. Classification and nomenclature of viruses". Intervirology 12 (3–5): 129–296. PMID 43850. doi:10.1159/000149081.
- ↑ Beards GM, Brown DW (1988). "The antigenic diversity of rotaviruses: significance to epidemiology and vaccine strategies". European Journal of Epidemiology 4 (1): 1–11. PMID 2833405. doi:10.1007/BF00152685.
- ↑ Urasawa T, Urasawa S, Taniguchi K (1981). "Sequential passages of human rotavirus in MA-104 cells". Microbiol. Immunol. 25 (10): 1025–35. PMID 6273696.
- ↑ Ward RL, Bernstein DI (2009). "Rotarix: a rotavirus vaccine for the world". Clinical Infectious Diseases : an Official Publication of the Infectious Diseases Society of America 48 (2): 222–8. PMID 19072246. doi:10.1086/595702.
- ↑ "Rotavirus vaccine for the prevention of rotavirus gastroenteritis among children. Recommendations of the Advisory Committee on Immunization Practices (ACIP)". MMWR Recomm Rep 48 (RR–2): 1–20. 1999. PMID 10219046.
- ↑ Kapikian AZ (2001). "A rotavirus vaccine for prevention of severe diarrhoea of infants and young children: development, utilization and withdrawal". Novartis Found. Symp. 238: 153–71; discussion 171–9. PMID 11444025. doi:10.1002/0470846534.ch10.
- ↑ Bines JE (2005). "Rotavirus vaccines and intussusception risk". Curr. Opin. Gastroenterol. 21 (1): 20–5. PMID 15687880. Arquivado dende o orixinal o 11 de maio de 2013. Consultado o 19 de setembro de 2013.
- ↑ Bines J (2006). "Intussusception and rotavirus vaccines". Vaccine 24 (18): 3772–6. PMID 16099078. doi:10.1016/j.vaccine.2005.07.031.
- ↑ Dennehy PH (2008). "Rotavirus vaccines: an overview". Clin. Microbiol. Rev. 21 (1): 198–208. PMC 2223838. PMID 18202442. doi:10.1128/CMR.00029-07. Arquivado dende o orixinal o 28 de setembro de 2011. Consultado o 19 de setembro de 2013.
- ↑ "Meeting of the immunization Strategic Advisory Group of Experts, April 2009—conclusions and recommendations". Relevé Épidémiologique Hebdomadaire / Section D'hygiène Du Secrétariat De La Société Des Nations = Weekly Epidemiological Record / Health Section of the Secretariat of the League of Nations 84 (23): 220–36. 2009. PMID 19499606.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Páxina web dos rotavirus da OMS
- Páxina do CDC sobre Rotavirus
- Viralzone: Rotavirus
- Vaccine Resource Library: Rotavirus
- DefeatDD.org
- Centers for Disease Control and Prevention (2012). "Ch. 18: Rotavirus". En Atkinson W, Wolfe S, Hamborsky J. Epidemiology and Prevention of Vaccine-Preventable Diseases (12th ed.). Washington DC: Public Health Foundation. pp. 263–274. Arquivado dende o orixinal o 12 de xuño de 2012. Consultado o 19 de setembro de 2013.
- Estruturas macromoleculares tridimensionais de Rotavirus no EM Data Bank(EMDB)
