ELISA

O ELISA, siglas do inglés enzyme-linked immunosorbent assay (ensaio inmunosorbente de encima ligado), é unha técnica de laboratorio que utiliza anticorpos e cambios de cor orixinados encimaticamente para identificar unha substancia.
O ELISA é un formato moi común de ensaio bioquímico analítico do tipo laboratorio húmido (wet-lab), que utiliza un inmunoensaio encimático (EIA) en fase sólida para detectar a presenza dunha substancia, xeralmente un antíxeno, nunha mostra líquida ou mostra húmida.
O ELISA foi utilizado como ferramenta para o diagnóstico médico e en patoloxía de plantas, e como unha comprobación do control de calidade en varias industrias.
Nesta técnica os antíxenos dunha mostra son unidos a unha superficie. Despois, aplícase un anticorpo sobre a superficie para que se una ao antíxeno. Este anticorpo está ligado a un encima, e, no paso final, engádese unha substancia que contén o substrato do encima. A reaccion que se produce orixina un sinal detectable, xeralmente un cambio de cor no substrato.
A realización dun ELISA implica normalmente utilizar polo menos un anticorpo con especificidade para un determinado antíxeno. A mostra que contén unha cantidade indeterminada de antíxeno é inmobilizada sobre un soporte sólido (xeralmente unha placa microtituladora de polistireno) que pode ser capturado non especificamente (por medio de adsorción á superficie) ou ben especificamente (por medio de captura por outro anticorpo específico do mesmo antíxeno, nun ELISA "sandwich"). Unha vez que o antíxeno é inmobilizado, engádese o anticorpo de detección, formando un complexo co antíxeno. O anticorpo de detección pode estar enlazado covalentemente a un encima, ou pode el mesmo ser detectado por un anticorpo secundario, que está enlazado a un encima por bioconxugación. Entre un paso e o seguinte, a placa é normalmente lavada cunha solución deterxente suave para eliminar calquera proteína ou anticorpo que non se unira especificamente. Despois do último paso de lavado, a placa revélase engadindo un substrato encimático para producir un sinal visibe, que indica a cantidade de antíxeno na mostra.
Hai que sinalar, que coa técnica ELISA poden realizarse tamén outras formas de ensaios de unión de ligandos e non só inmunoensaios, aínda que o nome leva o termo orixinal "immuno" debido ao uso común e á historia do desenvolvemento deste método. A técnica require esencialmente un axente ligante calquera que poida ser inmobilizado na fase sólida xunto cun axente de detección que se una especificamente e usa un encima para xerar un sinal que poida ser identificado axeitadamente. Entre lavado e lavado, só o ligando e a molécula á que se une especificamente permanecen unidos ou "inmunoadsorbidos" polas interaccións antíxeno-anticorpo á fase sólida, mentres que os compoñentes non específicos ou non unidos son arrastrados polo lavado. A diferenza doutros formatos de ensaios de laboratorio húmido espectrofotométricos no que pode reutilizarse o mesmo pozo de reacción (por exemplo unha cubeta) despois do lavado, as placas de ELISA teñen os produtos inmunoadsorbidos sobre a fase sólida, que é parte da placa, polo que non son facilmente reutilizables.
Principios
[editar | editar a fonte]Como o ELISA é un ensaio bioquímico, implica a detección dun "analito" (é dicir, a substancia específica cuxa presenza se quere analizar cuantitativa ou cualitativamente) nunha mostra líquida por un método que usa reactivos líquidos durante a "análise" (é dicir, unha secuencia controlada de reaccións bioquímicas que xeran un sinal que pode ser cuantificado doadamente e interpretado como unha medida da cantidade de analito na mostra) que permanece en estado líquido e dentro da cámara de reacción ou pozo necesario para conter os reactivos. Este tipo de técnicas son o contrario dun método de "laboratorio seco" (dry lab), o cal pode usar tiras secas, e mesmo no caso de que a mostra sexa líquida (por exemplo, unha pequena pinga medida), o paso final de detección na análise "seca" implica a lectura dos resultados nunha tira seca por métodos como a reflectometría e non necesita unha cámara para conter a reacción para impedir que se verta ou se mesturen as mostras.
Como o ELISA é un ensaio heteroxéneo, separa algún compoñente da mestura de reacción analítica ao adsorber certos compoñentes sobre unha fase sólida que está inmobilizada fisicamente. No ELISA, engádese unha mostra líquida sobre unha fase estacionaria sólida con propiedades de unión especiais e ito vai seguido da adición secuencial de moitos reactivos líquidos, que son incubados e lavados producindo algún cambio óptico (por exemplo, unha reacción encimática que orixina unha cor) no líquido final do pozo de reacción no cal se mide a cantidade de analito. A "lectura" cualitativa está xeralmente baseada na detección da intensidade de luz transmitida por espectrofotometría, o cal implica a cuantitación da transmisión dalgunha lonxitude de onda de luz específica a través do líquido (e tamén do fondo transparente do pozo no formato de placa de pozos múltiples). A sensibilidade da detección depende da amplificación do sinal durante as reaccións analíticas. Dado que as reaccións encimáticas son procesos de amplificación ben coñecidos, o sinal xérano encimas que están ligados a axentes reactivos en proporcións fixadas para permitir unha cuantificación precisa, de onde vén o nome de "ligado a encima" do proceso.
O analito tamén se chama ligando porque se une ou liga especificamente a un reactivo de detección, polo que o ELISA entra dentro da categoría máis ampla dos ensaios de unión de ligandos. O reactivo de unión específico de ligando é "inmobilizado", é dicir, normalmente cuberto e secado no fondo transparente e ás veces tamén na parede lateral do pozo (a "fase sólida"/"substrato sólido" estacionario aquí oponse a micopartículas sólidas/esferas doutras técnicas que poden ser retiradas polo lavado), e dita fase sólida normalmente é construída como unha placa de pozos múltiples coñecida como "placa de ELISA". Convencionalmente, igual que noutras formas de inmunoensaios, utilízase a especificidade da reacción de tipo antíxeno-anticorpo porque é doado utilizar como reactivo un anticorpo específico contra un antíxeno en masa. Alternativamente, se o propio analito é un anticorpo, pode utilizarse o seu antíxeno diana como o reactivo de unión.
Historia
[editar | editar a fonte]Antes do desenvolvemento do ELISA, a única opción para realizar un inmunoensaio era o radioinmunoensaio, unha técnica que usaba anticorpos ou antíxenos marcados radioactivamente. No radioinmunoensaio, o sinal era proporcionado pola radioactividade, a cal indicaba se estaba presente na mostra un antíxeno ou anticorpo específico. O radioinmunoensaio foi descrito primeiro nun artigo científico de Rosalyn Sussman Yalow e Solomon Berson publicado en 1960.[1]
Como a radioactividade supón unha ameaza potencial para a saúde, procurouse idear outra alternativa máis segura. Unha alternativa axeitada ao radioinmunoensaio sería aquela que substituíse o sinal radioactivo por outro non radioactivo. Cando certos encimas (como a peroxidase do ravo picante) reaccionan cos substratos apropiados (como ABTS ou TMB), prodúcese un cambio de cor, o cal se pode usar como sinal. Porén, o sinal ten que estar asociado coa presenza do anticorpo ou o antíxeno, o cal é a razón pola cal o encima ten que estar ligado a un anticorpo adecuado. Este proceso de ligamento foi desenvolvido independentemente por Stratis Avrameas e G. B. Pierce.[2] Como é necesario eliminar calquera anticorpo ou antíxeno non unido mediante lavados, o anticorpo ou antíxeno ten que estar fixado á superficie dun recipiente contedor (para que non sexa tamén el arrastrado polo lavado); é dicir, debe prepararse o inmunosorbente. Leif Wide e Jerker Porath publicaron unha técnica que servía para conseguir iso en 1966.[3]

En 1971, Peter Perlmann e Eva Engvall na Universidade de Estocolmo, Suecia, e Anton Schuurs e Bauke van Weemen nos Países Baixos publicaron artigos independentemente nos que sintetizaban este coñecemento nos métodos para realizar o EIA/ELISA.[4][5]
O método tradicional do ELISA implica tipicamente reporteiros cromoxénicos e substratos que producen algún tipo de cambio de cor observable que indique a presenza do antíxedno ou analito. Técnicas máis novas similares ao ELISA usan reporteiros fluoroxénicos, electroquimioluminescentes, e de PCR cuantitativa para xerar sinais cuantificables. Estes novos reporteiros poden ter varias vantaxes, incluíndo maiores sensibilidades e a posibilidade de facer ensaios múltiples.[6][7] En termos técnicos, estes novos tipos de ensaios non son estritramente ELISAs, xa que non están "ligados a encima", senón que están ligados a un reporteiro non encimático. Porén, como os principios xerais destes ensaios son basicamenrte similares, con frecuencia son agrupados na mesma categoría dos ELISAs.
En 2012 unha proba de ELISA baseado en encima ultrasensible que usaba nanopartículas como reporteiro cromoxénico conseguiu producir un sinal de cor visible a simple vista a partir da detección de simples attogramos (10−18g) do analito. Nos resultados positivos aparecía unha cor azul e nos negativos cor vermella. Esta detección só pode confirmar a presenza ou a ausencia de analito pero non a súa concentración real.[8]
Tipos
[editar | editar a fonte]ELISA directo
[editar | editar a fonte]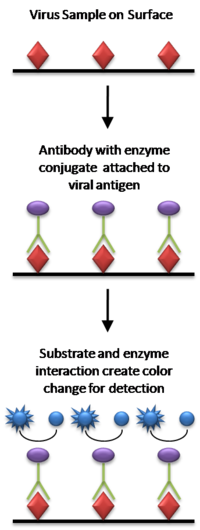
Os pasos para realizar un ELISA directo son os seguintes:
- Engádese unha solución tamponada do antíxeno que vai ser probado a cada pozo dunha placa de microtitradora (xeralmente úsanse placas de 96 pozos), e agárdase un tempo para que o antíxeno se adhira ao plástico por medio de interaccións de carga.
- Engádese ao pozo de reacción unha solución de proteínas non reactivas, como a albumina sérica bovina ou a caseína, para cubrir calquera superficie plástica no pozo que permaneza non recuberta de antíxeno.
- Adiciónase o anticorpo primario que leva un encima unido (conxugado), o cal se une especificamente ao antíxeno da proba que recobre o pozo.
- Engádese un substrato dese encima. Xeralmente é un substrato que cambia de cor cando se produce a reacción co encima.
- Canto maior é a concentración do anticorpo primario presente no soro, máis forte é o cambio de cor. Xeralmente utilízase un espectrómetro para dar os valores cuantitativos da forza da cor.
O encima actúa como un amplificador, xa que as moléculas de encima producirán moitas moléculas sinal aínda que só permanezan unidos uns poucos anticorpos ligados a encima. Coas limitación de sentido común, o encima pode continuar producindo cor indefinidamente, pero canto máis anticorpo haxa unido, máis rápido se producirá a cor. Unha importante desvantaxe do ELISA directo é que o método de inmobiliación do antíxeno non é específico, polo que cando se usa soro sanguíneo como fonte de antíxeno, todas as proteínas da mostra poden adherirse ao pozo da placa microtitradora, polo que pequenas concentracións de analito no soro deben competir con outras proteínas do soro á hora de unirse á superficie do pozo. O ELISA indirecto ou sandwich dá unha solución a este problema, ao usar un anticorpo de "captura" específico para o antíxeno que vai ser comprobado para retiralo da mestura molecular do soro.
O ELISA pode realizarse en formato cualitativo ou cuantitativo. Os resultados cualitativos proporcionan simplemente un resultado positivo ou negativo (de si ou non) para a mostra. O límite para discernir entre un positivo e un negativo é determinado polo analista e pode ser un límite estatístico. A miúdo utilízase un límite que está en dúas ou tres veces a desviación típica (erro inherent nunha proba) para distinguir entre mostras positivas e negativas. No ELISA cuantitativo, a densidade óptica da mostra compárase cunha curva estándar, que é normalmente unha dilución seriada dunha solución de concentración coñecida da molécula diana. Por exemplo, se unha proba dunha mostra dá unha densidade óptica de 1,0, o punto na curva estándar que dá unha densidade óptica de 1,0 debe ter a mesma concentración de analito que a mostra.
O uso e significado das denominacións "ELISA directo" e "ELISA indirecto" difiren na literatura e en sitios web dependendo do contexto do experimento. Cando se analiza a presenza dun antíxeno, o nome "ELISA directo" significa un ELISA no cal se usou só un anticorpo primario etiquetado, e o termo "ELISA indirecto" indica un ELISA no cal o antíxeno está unido ao anticorpo primario que se detecta despois por medio dun anticorpo secundario etiquetado. Neste último caso un ELISA sandwich é claramente distinto dun ELISA indiecto. Cando interesa o anticorpo "primario", por exemplo no caso de análises de inmunizacion, este anticorpo detéctase directamente polo anticorpo secundario e o termo "ELISA directo" aplícase a un escenario con dous anticorpos.
ELISA sandwich
[editar | editar a fonte]
O ELISA "sandwich" utilízase para detectar un antíxeno nunha mostra seguindo os seguintes pasos:
- Prepárase unha superficie á cal se une unha cantidade coñecida de anticorpo de captura.
- Bloquéanse todos os sitios de unión non específicos na superficie.
- Engádese á placa a mostra que contén o antíxeno, que é capturado polo anticorpo.
- Lávase a placa para eliminar o antíxeno non unido.
- Engádese un anticorpo específico, que se une ao antíxeno (velaquí o "sandwich": o antíxeno queda en medio dos dous anticorpos). Este anticorpo primario podería estar tamén no soro dun doante para comprobar a súa reactividade cara ao antíxeno.
- Aplícanse os anticorpos secundarios ligados a encima como anticorpos de detección que tamén se unen especificamente á rexión Fc do anticorpo (unión non específica).
- Lávase a placa para eliminar os conxugados anticorpo-encima non unidos.
- Engádese un composto químico que vai ser convertido polo encima nun sinal electroquímico, de cor ou fluorescente.
- Mídese a absorbancia ou sinal electroquimico ou fluorescente (por exemplo, corrente eléctrica) dos pozos da placa para determinar a presenza e cantidade do antíxeno.
A imaxe da dereita inclúe o uso dun anticorpo secundario conxugado a un encima, aínda que, en sentido técnico, este non é necesario se o anticorpo primario está conxugado a un encima (o cal sería un ELISA directo). Porén, o uso dun conxugado do anticorpo secundario evita o custoso proceso de crear anticorpos ligados a encimas para cada antíxeno que se queira detectar. Usando un anticorpo ligado a encima que se una á rexión Fc doutros anticorpos, pode utilizarse este mesmo anticorpo ligado a encima en diversas situacións. Sen a primeira capa do anticorpo de "captura", calquera proteína da mostra (incluíndo as proteínas séricas) pode adsorberse competitivamente á superficie da placa, o que diminúe a cantidade de antíxeno inmobilizado. O uso dun anticorpo específico purificado para adherir o antíxeno ao plástico elimina a necesidade de purificar o antíxeno de complicadas mesturas antes da medida, o que simplifica o ensaio, e incrementa a especificidade e a sensibilidade do ensaio.
ELISA competitivo
[editar | editar a fonte]Un terceiro modo de usar o ELISA é por medio de unión competitiva. Os pasos destes ELISA son algo diferentes dos dous primeiros métodos explicados, e consisten no seguinte:
- Incúbase o anticorpo non marcado en presenza do seu antíxeno (mostra).
- Despois engádense estes complexos antíxeno/anticorpo unido a un pozo cuberto de antíxeno.
- Lávase a placa para eliminar os anticorpos non unidos. (Canto máis antíxeno haxa na mostra, máis complexos antíxeno-anticorpo se formarán e así hai menos anticorpos unidos dispoñibles para unirse ao antíxeno no pozo de reacción, de aí que se produza "competición").
- Engádese o anticorpo secundario, específico do anticorpo primario. Este segundo anticorpo está acoplado ao encima.
- Engádese un substrato, e os encimas que permanecen orixinan un sinal cromoxénico ou fluorescente.
- Detense a reacción para impedir unha saturación do sinal.
Algúns kits de ELISA competitivo inclúen antíxenos ligados a encima en troques de anticorpos ligados a encima. O antíxeno etiquetado compite polos sitios de unión do anticorpo primario cos antíxenos da mostra (non etiquetados). Canto menos antíxeno haxa na mostra, máis antíxeno marcado se retén no pozo e máis forte é o sinal.
Normalmente, non se coloca primeiro o antíxeno no pozo.
Para a detección de anticorpos contra o VIH, recóbrense os pozos da placa microtitradora co antíxeno de VIH. Utilízanse dous anticorpos específicos, un conxugado co encima e o outro presente no soro (se o soro é positivo para o anticorpo). Ten lugar unha competición acumulativa entre os dous anticorpos polo mesmo antíxeno, o que fai que se vexa un sinal máis forte. Engádense os soros que teñen que ser comprobados a estes pozos e incúbanse a 37 °C, e despois lávanse. Se están presentes os anticorpos, ocorre a reacción antíxeno-anticorpo. Non queda antíxeno para os anticorpos de VIH específicos etiquetados co encima. Estes anticorpos permanecen libres despois da súa adición e son retirados polo lavado. Engádese o substrato, pero este non atopa encima que actúe sobre el, polo que un resultado positivo non mostra cambio de cor.
Aplicacións
[editar | editar a fonte]
Como o ELISA pode realizarse para avaliar a presenza de antíxeno ou a presenza de anticorpo na mostra, é unha ferramenta útil para determinar as concentracións séricas de anticorpo (como se fai na proba do VIH[9] ou co virus do Nilo Occidental). Tamén atopou aplicacións na industria alimentaria para detectar posibles alérxenos en alimentos, como o leite, cacahuetes, abelás, améndoas, e ovos[10] e como test sanguíneo serolóxico para a enfermidade celíaca.[11][12] O ELISA pode usarse tamén en toxicoloxía como un exame (screen) rápido da presenza de certa clase de drogas.

O ELISA foi o primeiro test de screening que se usou xeneralizadamente para o VIH debido á súa alta sensibilidade. Nun ELISA, o soro sanguíneo dunha persoa dilúese 400 veces e é aplicado a unha placa á cal están unidos os antíxeno do VIH. Se os anticorpos do VIH están presentes no soro, poden unirse a estes antíxenos de VIH. Despois, lávase a placa para eliminar todos os outros compoñentes do soro. Despois aplícase á placa un "anticorpo secundario" especialmente preparado (é dicir, un anticorpo que se une a outro anticorpo), seguido doutro lavado. Previamente este anticorpo secundario lígase quimicamente a un encima.
Así, a placa contén encima en proporción á cantidade de anticorpo secundario unido á placa. Aplícase un substrato para o encima, e a catálise ralizada polo encima produce un cambio de cor ou fluorescencia. Os resultados do ELISA indícanse numericamente. O aspecto máis controvertido desta proba é determinar o punto límite para distinguir os resultados positivos dos negativos.
O punto límite pode determinarse comparándoo cun estándar coñecido. Se se utiliza unha proba de ELISA para un screening de drogas no lugar de traballo, establécese unha concentración límite de 50 ng/ml, por exemplo, e prepárase unha mostra que contén a concentración estándar de analito. Os descoñecidos que xeran un sinal máis forte que a mostra coñecida son considerados "positivos", e os que xeran un sinal máis feble son "negativos".
O Dr. Dennis E. Bidwell e Alister Voller crearon probas de ELISA para detectar varios tipos de doenzas, como a malaria, enfermidade de Chagas, e a enfermidade de Johne.[13] As probas de ELISA tamén se usan como diagnósticos in vitro en laboratorios médicos. Outros usos do ELISA son:
- detección de anticorpos para o Mycobacterium na tuberculose.
- detección e rotavirus nas feces.
- detección de marcadores de hepatite B no soro.
- detección de enterotoxina de Escherichia coli nas feces.
- detección de anticorpos para o VIH en mostras de sangue.
Notas
[editar | editar a fonte]- ↑ Yalow, Rosalyn S.; Berson, Solomon A. (1960). "Immunoassay of endogenous plasma insulin in man". The Journal of Clinical Investigation 39: 1157–75. PMC 441860. PMID 13846364. doi:10.1172/JCI104130.
- ↑ Lequin, R. M. (2005). "Enzyme Immunoassay (EIA)/Enzyme-Linked Immunosorbent Assay (ELISA)". Clinical Chemistry 51 (12): 2415–8. PMID 16179424. doi:10.1373/clinchem.2005.051532.
- ↑ Wide, Leif; Porath, Jerker (1966). "Radioimmunoassay of proteins with the use of Sephadex-coupled antibodies". Biochimica et Biophysica Acta 130 (1): 257–60. doi:10.1016/0304-4165(66)90032-8.
- ↑ Engvall, Eva; Perlmann, Peter (1971). "Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G". Immunochemistry 8 (9): 871–4. PMID 5135623. doi:10.1016/0019-2791(71)90454-X.
- ↑ Van Weemen, B.K.; Schuurs, A.H.W.M. (1971). "Immunoassay using antigen—enzyme conjugates". FEBS Letters 15 (3): 232–236. PMID 11945853. doi:10.1016/0014-5793(71)80319-8.
- ↑ Leng, S. X.; McElhaney, J. E.; Walston, J. D.; Xie, D.; Fedarko, N. S.; Kuchel, G. A. (2008). "ELISA and Multiplex Technologies for Cytokine Measurement in Inflammation and Aging Research". The Journals of Gerontology Series A: Biological Sciences and Medical Sciences 63 (8): 879–84. PMC 2562869. PMID 18772478. doi:10.1093/gerona/63.8.879.
- ↑ Adler, Michael; Schulz, Sven; Spengler, Mark (2009). "Cytokine Quantification in Drug Development: A comparison of sensitive immunoassay platforms". Chimera Biotech. Arquivado dende o orixinal o 22 de decembro de 2015. Consultado o 10 de decembro de 2015.
- ↑ de la Rica, Roberto; Stevens, Molly M. (2012). "Plasmonic ELISA for the ultrasensitive detection of disease biomarkers with the naked eye". Nature Nanotechnology 7 (12): 821–4. PMID 23103935. doi:10.1038/nnano.2012.186.
- ↑ MedlinePlusEncyclopedia 003538 ELISA/Western blot tests for HIV
- ↑ "Food Allergen Partnership" (Nota de prensa). FDA. January 2001. Consultado o August 20, 2015.
- ↑ Sblattero, D.; Berti, I.; Trevisiol, C.; Marzari, R.; Tommasini, A.; Bradbury, A.; Fasano, A.; Ventura, A.; Not, T. (2000). "Human recombinant tissue transglutaminase ELISA: an innovative diagnostic assay for celiac disease". The American Journal of Gastroenterology 95 (5): 1253–7. PMID 10811336. doi:10.1111/j.1572-0241.2000.02018.x.
- ↑ Porcelli, Brunetta; Ferretti, Fabio; Vindigni, Carla; Terzuoli, Lucia (2014). "Assessment of a Test for the Screening and Diagnosis of Celiac Disease". Journal of Clinical Laboratory Analysis. PMID 25385391. doi:10.1002/jcla.21816.
- ↑ Griffin, J. F. T.; Spittle, E.; Rodgers, C. R.; Liggett, S.; Cooper, M.; Bakker, D.; Bannantine, J. P. (2005). "Immunoglobulin G1 Enzyme-Linked Immunosorbent Assay for Diagnosis of Johne's Disease in Red Deer (Cervus elaphus)". Clinical and Vaccine Immunology 12 (12): 1401–9. PMC 1317074. PMID 16339063. doi:10.1128/CDLI.12.12.1401-1409.2005.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Máis publicacións sobre kits de ELISA
- Ilustración animada dun ensaio ELISA
- A técnica do ELISA ilustrada Arquivado 22 de decembro de 2015 en Wayback Machine.
- Titorial animado noque se compara os métodos de ELISA directoe indirectoArquivado 15 de marzo de 2012 en Wayback Machine.
- "Introdución á ELISA Activity – guía para principiantes da proba de ELISA usadoa para detectar o VIH, con animacións da Universidade de Arizona
- Animación descritiva da aplicación do ELISA sandwich nunha proba de embarazo
- Vídeo animado sobre os formatos de ELISA competitivo
- ELISA Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
