Receptor acoplado á proteína G
| Receptor acoplado á proteína G | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identificadores | |||||||||
| Símbolo | 7tm_1 | ||||||||
| Pfam | PF00001 | ||||||||
| InterPro | IPR000276 | ||||||||
| PROSITE | PDOC00210 | ||||||||
| OPM superfamily | 6 | ||||||||
| OPM protein | 1gzm | ||||||||
| |||||||||
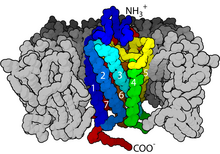
Os receptores acoplados á proteína G (GPCRs), tamén chamados receptores de dominio de sete transmembrana, receptores 7TM, receptores heptahélice, receptores serpentina, e receptores ligados á proteína G (GPLR), forman unha grande familia de proteínas de receptores de membrana que detectan moléculas procedentes de fóra da célula e activan vías de transdución de sinais internas, que orixinan respostas celulares. Son receptores transmembrana porque abranguen todo o grosor da membrana dun lado a outro, e ademais, son receptores do tipo "sete transmembrana" porque a súa cadea polipeptídica pasa dun lado a outro da membrana sete veces.
Os receptores acoplados á proteína G encóntranse só en eucariotas, incluíndo a lévedos, coanoflaxelados,[2] e animais. Entre os ligandos que se unen e activan estes receptores están compostos sensibles á luz, compostos olorosos, feromonas, hormonas, e neurotransmisores, e poden variar en tamaño desde pequenas moléculas ata péptidos ou proteínas grandes. Os receptores acoplados á proteína G están implicados en moitas doenzas, e son tamén a diana de aproximadamente o 40% de todas as drogas medicinais modernas.[3][4] Brian Kobilka e Robert Lefkowitz recibiron o Premio Nobel de Química de 2012 polos seus traballos neste campo que foron "cruciais para comprender como funcionan os receptores acoplados á proteína G."[5]
Hai dúas vías principais de transdución de sinais que implican aos receptores acoplados á proteína G (GPCR), que son: a vía de sinalización do AMP cíclico (AMPc) e a vía de sinalización do fosfatidilinositol.[6] Cando se une un ligando ao GPCR isto causa un cambio de conformación no GPCR, que lle permite actuar como un factor de intercambio de nucleótidos de guanina (GEF). O GPCR pode despois activar unha proteína G asociada a el ao intercambiar o GDP unido por un GTP. A subunidade α da proteína G, xunto co GTP unido, pode despois disociarse das subunidades β e γ para despois afectar a proteínas de sinalización intracelulares ou proteínas funcionais diana directamente dependendo do tipo de subunidade α de que se trate (Gαs, Gαi/o, Gαq/11, Gα12/13).[7]páx. 1160
Clasificación[editar | editar a fonte]

Non se sabe o tamaño exacto da superfamilia dos GPCR, pero prediciuse que hai case 800 xenes humanos distintos (ou ≈4% de todo o xenoma que codifica proteínas) a partir de análises de secuencia xenómicos.[8] Aínda que se propuxeron moitos esquemas de clasificación, a superfamilia é dividida clasicamente en tres clases principais (A, B, e C) entre as que non hai homoloxía de secuencia compartida detectable. A clase máis grande con diferenza é a clase A, que supón case o 85% de todos os xenes GPCR. Dos GPCR da clase A, predícese que arredor da metade codifican receptores olfactorios, mentres que os receptores restantes teñen ligandos endóxenos descoñecidos ou son clasificados como receptores orfos. Malia a falta de homoloxía de secuencia entre as clases, todos os GPCRs teñen unha estrutura terciaria común e un mesmo mecanismo de transdución de sinais.
Os GPCRs poden gruparse en 6 clases baseándose na homoloxía de secuencia e semellanza funcional, que son:[9][10][11][12]
- Clase A (ou 1) (tipo rodopsina)
- Clase B (ou 2) (familia do receptor de secretina)
- Clase C (ou 3) (glutamato metabotrópico/feromona)
- Clase D (ou 4) (receptor de feromonas do apareamento de fungos)
- Class E (ou 5) (receptor do AMP cíclico)
- Clase F (ou 6) (Crepitado/Suavizado (Frizzled/Smoothened)).
O grande grupo A da rodopsina foi subdividido en 19 subgrupos (de A1 a A19).[13] Máis recentemente, propúxose un sistema de clasificación alternativo chamado GRAFS (Glutamato, Rodopsina, Adhesión, Crepitado/Gusto2 (Frizzled/Taste2), Secretina).[8]
O xenoma humano codifica miles de receptores acoplados á proteína G,[14] e uns 350 deles detectan hormonas, factores de crecemento, e outros ligandos endóxenos. Aproximadamente 150 dos GPCRs que se encontran no xenoma humano teñen funcións descoñecidas.
Utilizáronse algúns servidores web[15] e métodos de predición bioinformáticos[16][17] para predicir a clasificación dos GPCRs utilizando só a súa secuencia de aminoácidos, por medio dun enfoque baseado na composición de pseudo aminoácidos.
Funcións fisiolóxicas[editar | editar a fonte]
Os GPCRs están implicados en moitos procesos fisiolóxicos. Algúns exemplos dos seus papeis fisiolóxicos son:
- Sentido da vista: As opsinas usan unha reacción de fotoisomerización para traducir a radiación electromagnética en sinais celulares. A rodopsina, por exemplo, usa a conversión de 11-cis-retinal a todo-trans-retinal para este propósito.
- Sentido do gusto: Os GPCRs das células gustativas median a liberación de gustducina en resposta a substancias amargas ou doces.
- Sentido do olfacto: Os receptores do epitelio olfactorio líganse a substancias olorosas (nos receptores olfactorios) e feromonas (nos receptores vomeronasais).
- Regulación do comportamento e estado de ánimo: Os receptores do cerebro de mamíferos líganse a varios neurotransmisores, como a serotonina, dopamina, GABA, e glutamato.
- Regulación da actividade do sistema inmunitario e inflamación: Os receptores de quimiocina únense a ligandos que median a comunicación intercelular entre células do sistema inmunitario; receptores como os receptores de histamina únense a mediadores inflamatorios e implican ás células diana na resposta inflamatoria.
- Transmisión no sistema nervioso autónomo: Tanto o sistema nervioso simpático coma o parasimpático son regulados polas vías dos GPCR, responsables do control de moitas funcións automáticas do corpo como a presión sanguínea, frecuencia cardíaca, e procesos dixestivos.
- Detección da densidade celular: Un novo papel descuberto dos GPCR é a regulación da percepción da densidade de células.
- Modulación da homeostase (por exemplo, o equilibrio hídrico).[18]
- Implicación no crecemento e metástases dalgúns tipos de tumores.[19]
Estrutura do receptor[editar | editar a fonte]
Os GPCRs son proteínas integrais de membrana que posúen sete dominios que abranguen todo o grosor da membrana ou hélices transmembrana.[20][21] As partes extracelulares do receptor poden estar glicosiladas. Estes bucles extracelulares tamén conteñen dous residuos de cisteína moi conservados que forman pontes disulfuro para estabilizar a estrutura do receptor. Algunhas proteínas de tipo hélice sete transmembrana (canalrodopsina) que lembran a GPCRs poden conter canles iónicas dentro das súas proteínas.
Similares aos GPCRs son os receptores de adiponectina 1 e 2 (ADIPOR1 e ADIPOR2) que tamén posúen 7 dominios transmembrana. Porén, ADIPOR1 e ADIPOR2 están orientados na membrana de forma oposta aos GPCRs (é dicir, o N-terminal é extracelular e o C-terminal é citoplasmático) e non se asocian con proteínas G.[22]
Os modelos estruturais iniciais dos GPCRs estaban baseados na súa feble analoxía coa bacteriorrodopsina, da cal se determinou a estrutura por difracción electrónica (PDB 2BRD, 1AT9)[23][24] e cristalografía de raios X (1AP9).[25] En 2000, resolveuse a primeira estrutura cristalina dun GPCR de mamífero, o da rodopsina bovina (1F88).[26] Aínda que está conservada a principal característica, que son as sete hélices transmembrana, a orientación relativa das hélices difire significativamente da propia da bacteriorrodopsina. En 2007, resolveuse a primeira estrutura dun GPCR humano (2R4R, 2R4S).[27] Isto foi seguido inmediatamente pola obtención dunha estrutura a maior resolución do mesmo receptor (2RH1).[28][29] Esta estrutura do GPCR receptor β2-adrenérxico humano, era moi similar á da rodopsina bovina en termos da orientación relativa das hélices sete transmembrana. Porén, a conformación do segundo bucle extracelular é totalmente diferente entre as dúas estruturas. Como este bucle constitúe a "tapa" que cobre a parte superior do sitio de unión do ligando, esta diferenza conformacional ilustra as dificultades de construír modelos de homoloxía doutros GPCRs baseándose só na estrutura da rodopsina.
Tamén se determinaron as estruturas de GPCRs unidos a agonistas ou activados.[30][31][32][33] Estas estruturas indican como a unión do ligando ao lado extracelular do receptor orixina cambios conformacionais no lado citoplasmático do receptor. O maior cambio é un movemento cara a fóra da parte citoplasmática das 5ª e 6ª hélices transmembrana (TM5 e TM6). A estrutura do receptor beta-2 adrenérxico activado en complexo con Gs confirmou que o Gα se une nunha cavidade creada por este movemento.[34]
Relacións estrutura-función[editar | editar a fonte]

En termos de estrutura, os GPCRs caracterízanse por teren un N-terminal extracelular, seguido dun dominio de hélices alfa de tipo sete transmembrana (7-TM) (denominadas de TM-1 a TM-7) conectadas por tres bucles intracelulares (de IL-1 a IL-3) e outros tres extracelulares (de EL-1 a EL-3), e finalmente un dominio intracelular C-terminal. O GPCR presenta unha estrutura terciaria que lembra a un barril, no que as sete hélices transmembrana forman unha cavidade na membrana plasmática que serve como dominio para a unión do ligando, que está xeralmente cuberto por EL-2. Non obstante, os ligandos poden unirse tamén noutra parte, como no caso de ligandos máis masivos (por exemplo, proteínas ou péptidos relativamente grandes), os cales interaccionan cos bucles extracelulares, ou, como se ilustra co receptor de glutamato metabotrópico de clase C (mGluRs), coa cola N-terminal. Os GPCRs de clase C distínguense polas súas grandes colas N-terminais, que tamén conteñen un dominio de unión ao ligando. Despois da unión do glutamato a un mGluR, a cola N-terminal sofre un cambio conformacional que orixina a súa interacción cos residuos dos bucles extracelulares e dominios TM. O efecto eventual de todos estes tres tipos de activación inducida por agonista é un cambio nas orientacións relativas das hélices TM (comparables a un movemento de torsión) que dá lugar a que se forme unha superficie intracelular máis ampla e que queden expostos residuos das hélices intracelulares e dominios TM cruciais para a función de transdución de sinais (por exemplo, o acoplamento dunha proteína G). Os agonistas inversos e antagonistas poden tamén unirse a varios sitios diferentes, pero o efecto final debe ser impedir esta reorientación da hélice TM.
As estruturas das colas N- e C-terminais dos GPCRs poden tamén realizar importantes funcións máis alá da unión de ligandos. En particular, o C-terminal a miúdo contén residuos de serina (Ser) ou treonina (Thr) que, cando se fosforilan, incrementan a afinidade da superficie intracelular para a unión de proteínas de armazón chamadas β-arrestinas (β-arr).[35] Unha vez unidas, as β-arrestinas impiden estericamente o acoplamento da proteína G e poden recrutar outras proteínas, o que dá lugar á creación de complexos de sinalización implicados na activación das vías das quinases reguladas por sinal extracelular (ERK) ou endocitose de receptor (internalización). Como a fosforilación destes residuos de Ser e Thr a miúdo ocorren como resultado da activación de GPCR, o desacoplamento da proteína G mediada por β-arr e a internalización de GPCRs son mecanismos importantes de desensibilización.[36]
Un tema estrutural común entre os GPCRs é a palmitoilación dun ou máis sitios da cola C-terminal ou dos bucles intracelulares. A palmitoilación é a modificación covalente de residuos de cisteína (Cys) por medio da adición de grupos acilo hidrofóbicos, e ten o efecto de dirixir o receptor a microdominios ricos en colesterol e esfingolípidos da membrana plasmática chamados balsas lipídicas. Como moitos dos transdutores situados augas abaixo das vías e moléculas efectoras dos GPCRs (incluídas as que están implicadas nas vías de retroalimentación negativa) son tamén dirixidas a balsas lipídicas, isto ten o efecto de facilitar unha sinalización do receptor rápida.
Os GPCRs responden a sinais extracelulares mediados por unha grande diversidade de agonistas, que van desde proteínas a aminas bioxénicas ou a protóns, pero todos transducen este sinal por medio dun mecanismo de acoplamento cunha proteína G. Isto faino posible un dominio do factor de intercambio de nucleótidos de guanina (GEF) formado principalmente por unha combinación de IL-2 e IL-3 xunto con residuos adxacentes de hélices TM asociadas.
Mecanismo[editar | editar a fonte]
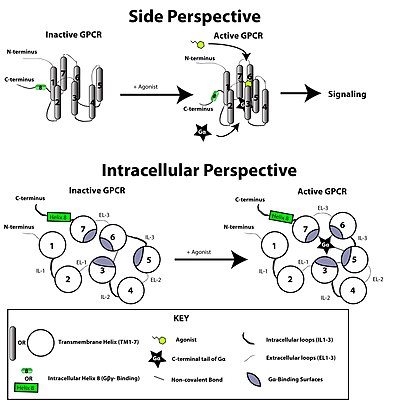
O receptor acoplado á proteína G é activado por un sinal externo en forma dun ligando ou outro mediador de sinais. Isto crea un cambio conformacional no receptor, causando a activación dunha proteína G. O efecto posterior depende do tipo de proteína G.
Unión de ligandos[editar | editar a fonte]
Entre os GPCRs hai receptores para mediadores de sinais sensoriais (por exemplo, luz e moléculas que estimulan o olfacto); adenosina, bombesina, bradicinina, endotelina, ácido γ-aminobutírico (GABA), factor de crecemento do hepatocito (HGF), melanocortinas, neuropéptido Y, péptidos opioides, opsinas, somatostatina, GH, taquicininas, membros da familia do péptido intestinal vasoactivo, e vasopresina; aminas bioxénicas (por exemplo, dopamina, epinefrina, norepinefrina, histamina, glutamato (efecto metabotrópico), glicagón, acetilcolina (efecto muscarínico), e serotonina); quimiocinas; mediadores lípidos da inflamación (por exemplo, prostaglandinas, prostanoides, factor activador de plaquetas, e leucotrienos); e hormonas peptídicas (por exemplo, calcitonina, anafilotoxina C5a, hormona estimmulante dos folículos (FSH), hormona liberadora da gonadotropina (GnRH), neuroquinina, hormona liberadora da tirotropina (TRH), cannabinoides, e oxitocina). Os GPCRs que actúan como receptores de estímulos que aínda non foron identificados denomínanse receptores orfos.
Porén, noutros tipos de receptores que foron estudados, nos que os ligandos se unen externamente á membrana, o ligando dos GPCRs únese tipicamente a un dominio transmembrana. Non obstante, os receptores activados por protease son activados por clivaxe de parte do seu dominio extracelular.[38]
Cambio conformacional[editar | editar a fonte]

A transdución de sinais a través da membrana polo receptor non se coñece completamente. Sábese que a proteína G inactiva únese ao receptor no seu estado inactivo. Unha vez que se recoñece ao ligando, o receptor cambia de conformación e, así, activa mecanicamente a proteína G, a cal se separa do receptor. O receptor pode agora activar a outra proteína G ou ben volver ao seu estado inactivo. Esta é unha explicación global simplificada pero suficiente para expresar o conxunto de acontecementos.
Crese que existe unha molécula receptora que está en equilibrio conformacional entre os estados biofísicos activo e inactivo.[39] A unión de ligandos ao receptor pode desprazar o equilibrio cara aos estados activos do receptor.[40] Hai tres tipos de ligandos: Os agonistas son ligandos que desprazan o equilibrio en favor de estados activos; os agonistas inversos son ligandos que desprazan o equilibrio en favor dos estados inactivos; e os antagonistas neutros son ligandos que non afectan ao equilibrio. Non se sabe polo momento a forma exacta na que se diferencian os estados activos e inactivos.
Ciclo de activación/desactivación da proteína G[editar | editar a fonte]

- Véxase tamén: Proteína G.
Cando o receptor está inactivo, o dominio do GEF pode estar unido a unha tamén inactiva subunidade α dunha proteína G heterotrimérica. Estas "proteínas G" son un trímero das subuinidades α, β, e γ (coñecidas como Gα, Gβ, e Gγ, respectivamente) que se volve inactivo cando se une reversiblemente á guanosina difosfato (GDP) (ou, alternativamente, a ningún nucleótido de guanina) pero activo cando se une á guanosina trifosfato (GTP). Coa activación do receptor, o dominio GEF, á súa vez, activa alostericamente a proteína G ao facilitar o intercambio dunha molécula de GDP por outra de GTP na subunidade α da proteína G. A célula mantén unha proporción 10:1 de GTP:GDP citosólico polo que o intercambio por GTP está asegurado. Neste punto, as subunidades da proteína G disócianse do receptor, e unhas doutras, para render un monómero Gα-GTP e un dímero Gβγ que interacciona estreitamente, os cales agora son libres para modular a actividade doutras proteínas intracelulares. Porén, o grao en que poden difundir é limitado debido á palmitoilación de Gα e a presenza dun resto isoprenoide que se engadiu covalentemente ao extremo C-terminal de Gγ.
Como Gα tamén ten unha lenta capacidade de hidrólise GTP→GDP, a forma inactiva da subunidade α (Gα-GDP) rexenérase finalmente, permitindo así a reasociación cun dímero Gβγ para formar a proteína G "en repouso", a cal pode agora unirse ao GPCR e esperar a activación. O grao de hidrólise de GTP é a miúdo acelerada debido ás accións doutra familia de proteínas moduladoras alostéricas chamadas reguladores da sinalización por proteína G, ou proteínas RGS, que son un tipo de proteínas activadoras das GTPases, ou GAP. De feito, moitas das principais proteínas efectoras (por exemplo, as adenilato ciclases) que son activadas/inactivadas pola interacción con Gα-GTP tamén teñen unha actividade GAP. Así, mesmo neste estado temperán do proceso, a sinalización iniciada polo GPCR ten capacidade de autoterminación.
Interaccións[editar | editar a fonte]

Os sinais augas abaixo da vía dos GPCRs posiblemente interaccionan cos sinais das integrinas, como a FAK (quinase de adhesión focal).[41] A sinalización por integrinas fosforila as FAK, o cal pode despois facer diminuír a actividade Gαs do GPCR.
Sinalización do GPCR[editar | editar a fonte]

Se un receptor está no seu estado activo e se encontra cunha proteína G, pode activala. Algunhas evidencias suxiren que os receptores e as proteínas G están en realidade preacoplados. Por exemplo, a unión de proteínas G aos receptores afecta á afinidade do receptor polos ligandos. As proteínas G están unidas á GTP.
A transdución de sinais posterior depende do tipo de proteína G. O encima adenilato ciclase é un exemplo dunha proteína celular que pode ser regulada por unha proteína G, neste caso a proteína G Gs. A actividade de adenilato ciclase é activada cando se une a unha subunidade da proteína G activada. A activación da adenilato ciclase finaliza cando a proteína G volve ao seu estado con GDP unido.
A adenilato ciclase (da cal se coñecen en humanos 9 formas unidas a membrana e unha forma citosólica) pode tamén ser activada ou inhibida por outras vías (por exemplo, unión de Ca2+/calmodulina), as cales poden modificar a actividade destes encimas de xeito aditivo ou sinérxico xunto coas proteínas G.
As vías de sinalización activadas por medio dun GPCR están limitadas pola secuencia primaria e estrutura terciaria do propio GPCR, pero finalmente está determinado pola súa conformación particular estabilizada por un determinado ligando, e pola dispoñibilidade de moléculas transdutoras. Actualmente, considérase que os GPCRs utilizan dous tipos principais de transdutores: as proteínas G e as β-arrestinas. Como as β-arr só teñen alta afinidade pola forma fosforilada da maioría dos GPCRs, a maioría da sinalización depende finalmente da activación da proteína G. Porén, a posibilidade de interacción permite que poida ocorrer unha sinalización independente da proteína G.
Sinalización dependente da proteína G[editar | editar a fonte]
Hai tres vías principais de sinalización mediada por proteína G, que son mediadas por catro subclases de proteínas G que se distinguen unhas das outras pola homoloxía de secuencia e son: Gαs, Gαi/o, Gαq/11, e Gα12/13. Cada subclase de proteína G consta de moitas proteínas, cada unha delas é o produto de varios xenes e/ou de variantes de splicing que poden darlles certas diferenzas nas súas propiedades de sinalización que van desde sutís a distintivas, pero en xeral parece razoable agrupalas en catro clases. Como as propiedades de transdución de sinais de varias posibles combinacións βγ non parecen diferir radicalmente dunha a outra, estas clases defínense de acordo coa isoforma da súa subunidade α.[7]
Aínda que a maioría dos GPCRs poden activar máis dun subtipo de Gα, tamén mostran unha preferencia por un subtipo sobre outro. Cando o subtipo activado depende do ligando que está unido ao GPCR, isto denomínase selectividade funcional (tamén coñecida como tráfico dirixido por agonista, ou agonismo específico de conformación). Porén, a unión dun único agonista determinado pode tamén iniciar a activación de moitas proteínas G diferentes, xa que pode ser capaz de estabilizar máis dunha conformación do dominio GEF do GPCR, mesmo durante o curso dunha soa interacción. Ademais, unha conformación que activa preferentemente unha isoforma de Gα pode activar outra se a prerferida está menos dispoñible. Ademais, as vías de retroalimentación poden dar lugar a modificacións do receptor (por exemplo, por fosforilación) que alteran a preferencia pola proteína G. Independentemente destes matices, o ligando de acoplamento preferido polo GPCR defínese xeralmente de acordo coa proteína G activada máis claramente polo ligando endóxeno baixo a maioría das condicións fisiolóxicas e experimentais.
Sinalización Gα[editar | editar a fonte]
- O efector das vías de Gαs e Gαi/o é o encima que xera AMP cíclico (AMPc) adenilato ciclase ou AC. Hai 10 produtos xénicos de AC distintos nos mamíferos, cada un con sutís diferenzas na súa función ou distribución nos tecidos, pero todos catalizan a conversión de ATP citosólico a AMPc, e todos son estimulados directamente por proteínas G da clase Gαs. Porén, ao contrario, a interacción con subunidades Gα do tipo Gαi/o inhibe a AC e non se xera AMPc. Así, un GPCR acoplado á Gαs contrarresta as accións do GPCR acoplado a Gαi/o, e viceversa. O nivel de AMPc citosólico pode despois determinar a actividade de varios canles iónicas e de membros da familia da proteína quinase A (PKA) específica de ser/thr. Así, o AMPc considérase un segundo mensaxeiro e a PKA un efector secundario.
- O efector da vía Gαq/11 é a fosfolipase C-β (PLCβ), a cal cataliza a clivaxe do fosfatidilinositol 4,5-bisfosfato (PIP2) unido a membranas orixinando o segundo mensaxeiro inositol (1,4,5)-trisfosfato (IP3) e diacilglicerol (DAG). O IP3 actúa sobre os receptores IP3 que se encontran na membrana do retículo endoplasmático para causar a liberación de Ca2+ do retículo endoplasmático, mentres que o DAG difunde ao longo da membrana plasmática onde pode activar calquera forma localizada en membranas dun segundo mensaxeiro de quinase específica de ser/thr chamado proteína quinase C (PKC). Como moitas isoformas de PKC son tamén activadas por incrementos no Ca2+ intracelular, ambas as vías poden tamén converxer para sinalizar a través do mesmo efector secundario. Con niveis elevados intracelulares de Ca2+ este ión tamén se une e activa alostericamente a proteínas chamadas calmodulinas, as cales á súa vez únense e activan alostericamente encimas como as quinases dependentes de Ca2+/calmodulina (CAMKs).
- Os efectores da vía Gα12/13 son tres RhoGEFs (p115-RhoGEF, PDZ-RhoGEF, e LARG), que, cando se unen a Gα12/13 activan alostericamente á pequena GTPase citosólica, Rho. Unha vez unida ao GTP, Rho pode despois seguir activando varias proteínas responsables da regulación do citoesqueleto como as quinases Rho (ROCK). A maioría dos GPCRs que se acoplan a Gα12/13 tamén se acoplan a outras subclases, a miúdo Gαq/11.
Sinalización Gβγ[editar | editar a fonte]
As descricións anteriores ignoran os efectos da sinalización polo Gβγ, a cal pode ser tamén importante, en especial no caso dos GPCRs acoplados a Gαi/o activado. Os efectores primarios de Gβγ son varias canles iónicas, como as canles de potasio GIRKs (G-protein-regulated inwardly rectifying K+ channels), canles de Ca2+ reguladas por voltaxe de tipo P/Q e N, e algunhas isoformas da adenilato ciclase e a PLC, xunto con algunhas isoformas da fosfoinosítido-3-quinase (PI3K).
Sinalización independente da proteína G[editar | editar a fonte]
Aínda que clasicamente se pensaba que os GPCR e a proteína G só podían funcionar xuntos, os GPCRs poden sinalizar tamén por medio de mecanismos independentes da proteína G, e as proteínas G heterotriméricas poden funcionar independentemente dos GPCRs. Os GPCRs poden sinalizar independentemente por medio de moitas das proteínas xa mencionadas na sinalización dependente da proteína G, como as β-arrs, GRKs, e Srcs. Ademais, outras proteínas armazón implicadas na localización subcelular dos GPCRs (por exemplo, as proteínas que conteñen o dominio PDZ) poden tamén actuar como transdutores de sinais. O máis común é que o efector sexa membro da familia MAPK.
Exemplos[editar | editar a fonte]
A finais da década de 1990, empezaron a acumularse evidencias que suxerían quen algúns GPCRs son capaces de sinalizar sen a intervención de proteínas G. A proteína quinase activada por mitóxeno ERK2, que é un mediador de transducións de sinais clave augas abaixo da activación do receptor en moitas vías, actívase en resposta á activación do receptor mediada por AMPc en Dictyostelium discoideum a pesar da ausencia de subunidades asociadas α e β da proteína G.[42]
En células de mamífero, demostrouse que o moi estudado adrenorreceptor β2 activa a vía ERK2 unha vez que se desacopla por mediación da arrestina da sinalización mediada pola proteína G. Por tanto, parece probable que algúns mecanismos que antes se cría que estaban relacionados só coa desensibilización do receptor son exemplos actualmente de receptores que cambian a súa vía de sinalización, en vez de simplemente "apagarse".
Nas células renais, o receptor da bradicinina B2 interacciona directamente cunha proteína tirosina fosfatase. A presenza dunha secuencia ITIM (motivo inhibitorio baseado na tirosina inmunorreceptor) fosforilada na tirosina no receptor B2 é necesaria para mediar esta interacción e subseguintemente os efectos antiproliferativos da bradicinina.[43]
Sinalización por proteínas G heterotriméricas independente de GPCR[editar | editar a fonte]
Aínda que é unha área de investigación inmatura, parece que as proteínas G heterotriméricas poden tamén tomar parte en sinalizacións idependentes de GPCR. Hai probas do seu funcionamento como transdutores de sinais en case todos os outros tipos de sinalización mediada por receptor, incluíndo integrinas, receptor tirosina quinases (RTKs), receptores de citocinas (JAK/STATs), e na modulación doutras proteínas "accessorias" como o GEFs, inhibidores da disociación dos nucleótidos de guanosina (GDIs) e proteína fosfatases. Pode haber mesmo proteínas específicas destas clases cuxa función primaria é ser parte de vías independentes de GPCR, denominadas Activadores da Sinalización pola proteína G (AGS). Non está aínda clara nin a ubicuidade destas interaccións nin a importancia da subunidade Gα fronte ao Gβγ para estes procesos.
Detalles das vías do AMPc e o PIP2[editar | editar a fonte]



Hai dúas vías de transdución de sinais principais nas que están implicados os GPCRs, que son: vía de sinalización do AMPc e vía de sinalización do fosfatidilinositol.[6]
Vía de sinalización do AMPc[editar | editar a fonte]
- Artigo principal: vía dependente do AMPc.
A vía de transdución de sinais do AMPc ten 5 protagonistas principais: receptores de horomoas estimulantes (Rs) ou inhibitorios (Ri); proteína G reguladora estimulante (Gs) ou inhibitoria (Gi); adenilato ciclase; Proteína quinase A (PKA); e AMPc fosfodiesterase.
O receptor de hormonas estimulante (Rs) é un receptor que pode unirse con moléculas de sinalización estimulantes, mentres que o receptor de hormonas inhibitorio (Ri) pode unirse con moléculas de sinalización inhibitorias.
A proteína G reguladora estimuladora é unha proteína G ligada a un receptor de hormonas estimulante (Rs), e a súa subunidade α unha vez activada pode estimular a actividade dun encima ou outro proceso do metabolismo intracelular. Ao contrario, a proteína G reguladora inhibitoria está ligada a un receptor de hormonas inhibitorio e a súa subunidade α unha vez activada pode inhibir a actividade dun encima ou outro proceso do metabolismo intracelular.
A adenilato ciclase é unha glicoproteína 12-transmembrana que cataliza ATP para formar AMPc coa axuda do cofactor Mg2+ ou Mn2+. O AMPc producido é un segundo mensaxeiro no metabolismo celular e é un activador alostérico da proteína quinase A (PKA).
A proteína quinase A é un importante encima no metabolismo celular debido á súa capacidade de regular o metabolismo celular ao fosforilar encimas específicos implicados na vía metabólica. Tamén pode regular a expresión de xenes específicos, a secreción celular, e a permeabilidade de membranas. O encima contén dúas subunidades catalíticas e dúas subunidades reguladoras. Cando non hai AMPc, o complexo está inactivo. Cando o AMPc se une ás subunidades reguladoras, as súas conformacións altéranse, causando a disociación de ditas subunidades reguladoras, o cal activa a proteína quinase A e permite os efectos biolóxicos poosteriores.
A AMPc fosfodiesterase é un encima que pode degradar o AMPc a 5'-AMP, o cal finaliza o sinal.
Vía de sinalización do fosfatidilinositol[editar | editar a fonte]
Na vía de sinalización do fosfatidilinositol, a molécula de sinalización extracelular únese ao receptor da proteína G (Gq) na superficie da célula e activa a fosfolipase C, a cal está localizada na membrana plasmática. A lipase hidroliza o fosfatidilinositol 4,5-bisfosfato (PIP2) en dous segundos mensaxeiros: Inositol 1,4,5-trisfosfato (IP3) e diacilglicerol (DAG). O IP3 únese co receptor na membrana do retículo endoplasmático liso e mitocondrias, e axuda a abrir a canle de Ca2+. O DAG axuda a activar a Proteína quinase C (PKC), a cal fosforila moitas outras proteínas, cambiando as súas actividades catalíticas, o que dá lugar ás respostas celulares. Os efectos do Ca2+ son tamén salientables: Coopera co DAG na activación da PKC e pode activar a vía da quinase CaM, na cal a proteína calmodulina modulada polo calcio (CaM) únese ao Ca2+, sofre un cambio de conformación, e activa a quinase CaM II, a cal ten a capacidade singular de incrementar a súa afinidade de unión coa CaM por autofosforilación, facendo que a CaM non estea dispoñible para a activación doutros encimas. A quinase despois fosforila encimas diana, regulando as súas actividades. As dúas vías de sinalización están conectadas entre si pola Ca2+-CaM, a cal é tamén a subunidade reguladora da adenilato ciclase e a fosfodiesterase na vía de sinalización do AMPc.
Regulación do receptor[editar | editar a fonte]
Os GPCRs desensibilízanse cando se expoñen ao seu ligando durante un período prolongado de tempo. Hai dúas formas recoñecidas de desensibilización: 1) desensibilización homóloga, na cal os GPCR activados son regulados á baixa; e 2) desensibilización heteróloga, na que os GPCR activados causan a regulación á baixa dun GPCR diferente. A reacción clave desta regulación á baixa é a fosforilación do dominio receptor intracelular (ou citoplasmático) realizado por proteína quinases.
Fosforilación por proteína quinases dependentes de AMPc[editar | editar a fonte]
As proteína quinases dependentes do AMP cíclico (proteína quinase A) son activadas pola cadea de sinais que procede da proteína G (que foi activada polo receptor) por medio da adenilato ciclase e o AMP cíclico (AMPc). Nun mecanismo de retroalimentación, estas quinases activadas fosforilan o receptor. Canto máis tempo permanece activo o receptor máis quinases son activadas e máis receptores son fosforilados. Nos β2-adrenoceptores, esta fosforilación dá lugar a un cambio de acoplamento, xa que inicialmente se acoplaba a clase Gs da proteína G e despois pasa a acoplarse a clase Gi.[44] A fosforilación mediada por PKA dependente de AMPc pode causar a desensibilización heteróloga noutros receptores distintos dos activados.[45]
Fosforilación por GRKs[editar | editar a fonte]
As quinases do receptor acoplado á proteína G (GRKs) son proteína quinases que fosforilan só os GPCRs activos. As GRKs son moduladores clave da sinalización dos GPCR. Constitúen unha familia de sete serina-treonina proteína quinases de mamífero que fosforilan o receptor unido a agonista. A fosforilación do receptor mediado por GRKs inicia rapidamente unha profunda deficiencia na sinalización do receptor e desensibilización. A actividade das GRKs e os seus destinos subcelulares están estreitamente reguladas pola interacción con dominios receptores, as subunidades da proteína G, lípidos, proteínas de ancoraxe e proteínas sensibles ao calcio.[46]
A fosforilación do receptor pode ter dúas consecuencias:
- Translocación: O receptor, xunto coa parte da membrana na que está integrado, é levado ao interior da célula, onde é desfosforilado no ambiente ácido vesicular [47] e despois levado de volta. Este mecanismo utilízase para regular a exposición a longo prazo, por exemplo, a unha hormona, ao permitir a resensibilización despois da desensibilización. Alternativamente, o receptor pode sufrir unha degradación nos lisosomas, ou permanecer internalizado, onde se cre que participa nos eventos de iniciación da sinalización, cuxa natureza depende da localización subcelular da vesícula internalizada.[45]
- Ligamento a arrestinas: O receptor fosforilado pode ligarse a moléculas de arrestinas que lle impiden unirse (e activar) a proteínas G, o que "apaga" o receptor durante un período curto de tempo. Este mecanismo utilízase, por exemplo, coa rodopsina nas células da retina para compensar a exposición á luz brillante. En moitos casos, a unión de arrestinas ao receptor é un prerrequisito para a translocación. Por exemplo, a beta-arrestina unida a β2-adrenorreceptores actúa como un adaptador para a unión coa clatrina, e coa subuinidade beta de AP2 (moléculas adaptadoras da clatrina); deste xeito, a arrestina actúa aquí como un armazón na ensamblaxe de compoñentes necesarios para a endocitose mediada por clatrina dos β2-adrenorreceptores.[48][49]
Mecanismos de terminación do sinal do GPCR[editar | editar a fonte]
Como xa se mencionou, as proteínas G poden terminar a súa propia activación debido á súa capacidade intrínseca de hidrólise GTP→GDP. Porén, esta reacción é moi lenta (≈0,02 veces/segundo), polo que a unha proteína G lle levaría uns 50 segundos desactivarse se non enrran en xogo outros factores. Hai arredor de 30 isoformas de proteínas RGS que, cando se unen a Gα por medio do seu dominio GAP, aceleran a velocidade de hidrólise en ≈30 veces/segundo. Este incremento de 1500 veces da velocidade permite que a célula responda a sinais externos con alta velocidade, e tamén serve como unha resolución espacial debido á limitada cantidade de segundo mensaxeiro que pode xerarse e a distancia limitada á que unha proteína G pode difundir en 0,03 segundos. Na súa maior parte, as proteínas RGS son promiscuas na súa capacidade de activaren as proteínas G, mentres que a RGS concreta que está implicada nunha vía de sinalización dada parece que é algo que está máis determinado polo tecido e o GPCR implicado que por calquera outra cousa. Ademais, as proteínas RGS teñen a función adicional de incrementar o grao de intercambio GTP-GDP no GPCRs, (é dicir, un tipo de co-GEF) contribuíndo adicionalmente ao tempo de resolución da sinalización do GPCR.
Ademais, o GPCR pode ser desensibilizado por si mesmo. Isto ocorre como:
- resultado directo da ocupación do ligando, no que o cambio de conformación permite o recrutamento de quinases que regulan o GPCR (GRKs), as cales seguen fosforilando varios residuos serina/treonina do IL-3 e a cola C-terminal. Despois da fosforilación polas GRK, increméntase a afinidade do GPCR pola β-arrestina (β-arrestina-1/2 na maioría dos tecidos), e nese momento a β-arrestina pode unirse e actuar dificultando estericamente o acoplamento da proteína G e iniciando o proceso de internalización do receptor por medio de endocitose mediada por clatrina. Como soamente o receptor ligado está desensibilizado por este mecanismo, denomínase desensibilización homóloga;
- a afinidade pola β-arrestina pode incrementarse dun modo independente de GRK e da ocupación do ligando por medio da fosforilación de diferentes sitios ser/thr (pero tamén de IL-3 e a cola C-terminal) por PKC e a PKA. Estas fosforilacións son a miúdo suficientes para desestabilizar o acoplamento de proteínas G;
- a PKC/PKA pode, en lugar do anterior, fosforilar as GRKs, o cal pode tamén levar a unha fosforilación do GPCR e a unión de β-arrestinas dunha maneira independente da ocupación. Estes dous últimos mecanismos permiten a desensibilización dun GPCR debido ás actividades doutros GPCRs, ou desensibilización heteróloga. Os GRKs poden tamén ter dominios GAP e así poden contribuír á inactivación por medio de mecanismos distintos das quinases. Tamén pode darse unha combinación destes mecanismos.
Unha vez que se uniu a β-arrestina ao GPCR, sofre un cambio conformacional que lle permite funcionar como unha proteína armazón para un complexo adaptador chamado AP-2, o cal á súa vez recruta outra proteína chamada clatrina. Se hai suficiente número de receptores na área local que recrutan clatrina desta maneira, agréganse e a membrana plasmática invaxínase como resultado das interaccións entre as moléculas de clatrina, nun proceso chamado opsonización. Unha vez que a invaxinación formada se desprende no interior, a súa membrana, debido ás accións doutras dúas proteínas chamadas anfisina e dinamina, convértese nunha vesícula endocítica. Neste punto, as moléculas adaptadoras e a clatrina disócianse, e o receptor é levado de volta á membrana plasmática ou dirixido aos lisosomas para a súa degradación proteolítca.
En calquera momento deste proceso, as β-arrestinas poden tamén recrutar outras proteínas, como a non receptor tirosina quinase (nRTK), ou c-SRC, as cales poden activar a ERK1/2, ou outras proteína quinases activadas por mitóxeno (MAPK) sinalizando por medio de, por exemplo, a fosforilación de pequenas GTP-ases, ou por Ras, ou recrutar as proteínas da fervenza ERK directamente (é dicir, Raf-1, MEK, ERK-1/2) e nese momento a sinalización iníciase debido á estreita proximidade de ambos. Outras dianas do c-SRC son as moléculas dinamina implicadas na endocitose. As dinaminas polimerízanse arredor do colo dunha vesícula que se está a invaxinar, e a súa fosforilación por parte de c-SRC proporciona a enerxía necesaria para o cambio conformacional que permite que a vesícula en invaxinación se desprenda finalmente da membrana.
Regulación celular do GPCR[editar | editar a fonte]
A desensibilización do receptor está mediada por medio dunha combinación de fosforilación, unión de β-arr, e endocitose como se describiu antes. A regulación á baixa ocorre cando o receptor endocitado está integrado nun endosoma que se traslada para fusionarse cun orgánulo chamado lisosoma. Como as membranas do lisosoma son ricas en bombas de protóns, o interior deste orgánulo ten un pH baixo (≈4,8 comparado co pH≈7,2 do citosol), o cal actúa desnaturalizando os GPCRs. Ademais, os lisosomas conteñen moitos encimas degradativos, como proteases, as cales poden funcionar só a eses pHs baixos, e así os enlaces peptídicos que unen os residuos do GPCR poden ser clivados. O feito de que un receptor dado sexa levado a un lisosoma ou non, quede detido en endosomas, ou levado de volta á membrana plasmática depende de varios factores, como o tipo de receptor e a magnitude do sinal. A regulación GPCR é mediada adicionalmente por factores de transcrición de xenes. Estes factores poden incrementar ou facer decrecer a transcrición xénica e así incrementan ou diminúen a xeración de novos receptores (regulación á baixa ou á alza) que viaxan á membrana da célula.
Oligomerización do receptor[editar | editar a fonte]
A oligomerización do receptor acoplado á proteína G é un fenómeno moi estendido. Un dos exemplos mellor estudados é o receptor GABAB metabolotrópico. Este receptor denominado constitutivo está formado por heterodimerización das subunidades GABABR1 e GABABR2. A expresión de GABABR1 sen o GABABR2 en sistemas heterólogos causa a retención da subunidade no retículo endoplasmático. A expresión da subunidade GABABR2 soa orixina a expresión na superficie da subunidade, aínda que sen actividade funcional (é dicir, o receptor non se une ao agonista e non pode iniciar a resposta despois dunha exposición ao agonista). A expresión das dúas subunidades xuntas leva a que se exprese na membrana plasmática o receptor funcional. Demostrouse que a unión de GABABR2 a GABABR1 causa o enmascaramento do sinal de retención[50] dos receptores funcionais.[51]
Orixe e diversificación da superfamilia[editar | editar a fonte]
A transdución de sinais mediada pola superfamilia dos GPCRs remóntase na súa orixe á orixe da multicelularidade. Os GPCRs de tipo mamífero encóntranse tamén en fungos, e foron clasificados polo sistema de clasificación GRAFS baseado en datos xenéticos dos GPCR.[52] A identificación de membros da superfamilia no dominio dos eucariotas, e a comparación dos motivos específicos de familia, mostraron que a superfamilia dos GPCRs ten unha orixe común.[53] Os motivos característicos indican que tres das cinco familias GRAFS, Rodopsina, Adhesión, e Crepitado (Frizzled), evolucionaron a partir de receptores de AMPc de Dictyostelium discoideum antes da separación dos Opisthokonta. Posteriormente, a familia Secretina evolucionou a partir da familia Adhesion de receptores GPCR antes de que se separasen os nematodos.
Dictyostelium discoideum[editar | editar a fonte]
Descubriuse recentemente un novo GPCR que contén un dominio de lípido quinase en Dictyostelium discoideum, que regula a sensibilidade á densidade celular.[54]
Notas[editar | editar a fonte]
- ↑ Wu H, Wacker D, Mileni M, Katritch V, Han GW, Vardy E, Liu W, Thompson AA, Huang XP, Carroll FI, Mascarella SW, Westkaemper RB, Mosier PD, Roth BL, Cherezov V, Stevens RC (maio de 2012). "Structure of the human κ-opioid receptor in complex with JDTic". Nature 485 (7398): 327–32. PMC 3356457. PMID 22437504. doi:10.1038/nature10939.
- ↑ King N, Hittinger CT, Carroll SB (2003). "Evolution of key cell signaling and adhesion protein families predates animal origins". Science 301 (5631): 361–3. PMID 12869759. doi:10.1126/science.1083853.
- ↑ Filmore D (2004). "It's a GPCR world". Modern Drug Discovery (American Chemical Society) 2004 (novembro): 24–28.
- ↑ Overington JP, Al-Lazikani B, Hopkins AL (decembro de 2006). "How many drug targets are there?". Nat Rev Drug Discov 5 (12): 993–6. PMID 17139284. doi:10.1038/nrd2199.
- ↑ Royal Swedish Academy of Sciences (10 de outubro de 2012). "The Nobel Prize in Chemistry 2012 Robert J. Lefkowitz, Brian K. Kobilka". Consultado o 10 de outubro de 2012.
- ↑ 6,0 6,1 Gilman AG (1987). "G proteins: transducers of receptor-generated signals". Annu. Rev. Biochem. 56: 615–49. PMID 3113327. doi:10.1146/annurev.bi.56.070187.003151.
- ↑ 7,0 7,1 Wettschureck N, Offermanns S (outubro de 2005). "Mammalian G proteins and their cell type specific functions". Physiol. Rev. 85 (4): 1159–204. PMID 16183910. doi:10.1152/physrev.00003.2005.
- ↑ 8,0 8,1 8,2 Bjarnadóttir TK, Gloriam DE, Hellstrand SH, Kristiansson H, Fredriksson R, Schiöth HB (setembro de 2006). "Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse". Genomics 88 (3): 263–73. PMID 16753280. doi:10.1016/j.ygeno.2006.04.001.
- ↑ Attwood TK, Findlay JB (1994). "Fingerprinting G-protein-coupled receptors". Protein Eng 7 (2): 195–203. PMID 8170923. doi:10.1093/protein/7.2.195.
- ↑ Kolakowski LF Jr (1994). "GCRDb: a G-protein-coupled receptor database". Receptors Channels 2 (1): 1–7. PMID 8081729.
- ↑ Foord SM, Bonner TI, Neubig RR, Rosser EM, Pin JP, Davenport AP, Spedding M, Harmar AJ (2005). "International Union of Pharmacology. XLVI. G protein-coupled receptor list". Pharmacol Rev 57 (2): 279–88. PMID 15914470. doi:10.1124/pr.57.2.5.
- ↑ InterPro
- ↑ Joost P, Methner A (2002). "Phylogenetic analysis of 277 human G-protein-coupled receptors as a tool for the prediction of orphan receptor ligands". Genome Biol 3 (11): research0063.1–0063.16. PMC 133447. PMID 12429062. doi:10.1186/gb-2002-3-11-research0063.
- ↑ Vassilatis DK, Hohmann JG, Zeng H, Li F, Ranchalis JE; et al. (2003). "The G protein-coupled receptor repertoires of human and mouse". Proc Natl Acad Sci USA 100 (8): 4903–4908. PMC 153653. PMID 12679517. doi:10.1073/pnas.0230374100. Arquivado dende o orixinal o 28 de agosto de 2020. Consultado o 05 de abril de 2014.
- ↑ Xiao X, Wang P, Chou KC (2009). "A cellular automaton image approach for predicting G-protein-coupled receptor functional classes". Journal of Computational Chemistry 30 (9): 1414–1423. PMID 19037861. doi:10.1002/jcc.21163.
- ↑ Qiu JD, Huang JH, Liang RP, Lu XQ (xullo de 2009). "Prediction of G-protein-coupled receptor classes based on the concept of Chou's pseudo amino acid composition: an approach from discrete wavelet transform". Anal. Biochem. 390 (1): 68–73. PMID 19364489. doi:10.1016/j.ab.2009.04.009.
- ↑ Gu Q, Ding YS, Zhang TL (maio de 2010). "Prediction of G-Protein-Coupled Receptor Classes in Low Homology Using Chou's pseudo amino acid composition with Approximate Entropy and Hydrophobicity Patterns". Protein Pept. Lett. 17 (5): 559–67. PMID 19594431. doi:10.2174/092986610791112693.
- ↑ Hazell GG, Hindmarch CC, Pope GR, Roper JA, Lightman SL, Murphy D, O'Carroll AM, Lolait SJ (xullo de 2011). "G protein-coupled receptors in the hypothalamic paraventricular and supraoptic nuclei - serpentine gateways to neuroendocrine homeostasis". Front Neuroendocrinol 33 (1): 45–66. PMC 3336209. PMID 21802439. doi:10.1016/j.yfrne.2011.07.002.
- ↑ Dorsam RT, Gutkind JS. (Feb 2007). "G-protein-coupled receptors and cancer". Nat Rev Cancer 7 (2): 79–94. PMID 17251915. doi:10.1038/nrc2069.
- ↑ Venkatakrishnan AJ, Deupi X, Lebon G, Tate CG, Schertler GF, Babu MM (2013). "Molecular signatures of G-protein-coupled receptors". Nature 494 (7436): 185–194. PMID 23407534. doi:10.1038/nature11896.
- ↑ Hollenstein K, de Graaf C, Bortolato A, Wang MW, Marshall FH, Stevens RC (2014). "Insights into the structure of class B GPCRs". Trends Pharmacol Sci 35 (1): 12–22. PMID 24359917. doi:10.1016/j.tips.2013.11.001.
- ↑ Yamauchi T, Kamon J, Ito Y, Tsuchida A, Yokomizo T, Kita S, Sugiyama T, Miyagishi M, Hara K, Tsunoda M, Murakami K, Ohteki T, Uchida S, Takekawa S, Waki H, Tsuno NH, Shibata Y, Terauchi Y, Froguel P, Tobe K, Koyasu S, Taira K, Kitamura T, Shimizu T, Nagai R, Kadowaki T (xuño de 2003). "Cloning of adiponectin receptors that mediate antidiabetic metabolic effects". Nature 423 (6941): 762–9. PMID 12802337. doi:10.1038/nature01705.
- ↑ Grigorieff N, Ceska TA, Downing KH, Baldwin JM, Henderson R (1996). "Electron-crystallographic refinement of the structure of bacteriorhodopsin". J. Mol. Biol. 259 (3): 393–421. PMID 8676377. doi:10.1006/jmbi.1996.0328.
- ↑ Kimura Y, Vassylyev DG, Miyazawa A, Kidera A, Matsushima M, Mitsuoka K, Murata K, Hirai T, Fujiyoshi Y (1997). "Surface of bacteriorhodopsin revealed by high-resolution electron crystallography". Nature 389 (6647): 206–11. PMID 9296502. doi:10.1038/38323.
- ↑ Pebay-Peyroula E, Rummel G, Rosenbusch JP, Landau EM (1997). "X-ray structure of bacteriorhodopsin at 2.5 angstroms from microcrystals grown in lipidic cubic phases". Science 277 (5332): 1676–81. PMID 9287223. doi:10.1126/science.277.5332.1676.
- ↑ Palczewski K, Kumasaka T, Hori T, Behnke CA, Motoshima H, Fox BA, Trong IL, Teller DC, Okada T, Stenkamp RE, Yamamoto M, Miyano M (2000). "Crystal structure of rhodopsin: A G protein-coupled receptor". Science 289 (5480): 739–45. PMID 10926528. doi:10.1126/science.289.5480.739.
- ↑ Rasmussen SG, Choi HJ, Rosenbaum DM, Kobilka TS, Thian FS, Edwards PC, Burghammer M, Ratnala VR, Sanishvili R, Fischetti RF, Schertler GF, Weis WI, Kobilka BK (2007). "Crystal structure of the human β2-adrenergic G-protein-coupled receptor". Nature 450 (7168): 383–7. PMID 17952055. doi:10.1038/nature06325.
- ↑ Cherezov V, Rosenbaum DM, Hanson MA, Rasmussen SG, Thian FS, Kobilka TS, Choi HJ, Kuhn P, Weis WI, Kobilka BK, Stevens RC (2007). "High-resolution crystal structure of an engineered human β2-adrenergic G protein-coupled receptor". Science 318 (5854): 1258–65. PMC 2583103. PMID 17962520. doi:10.1126/science.1150577.
- ↑ Rosenbaum DM, Cherezov V, Hanson MA, Rasmussen SG, Thian FS, Kobilka TS, Choi HJ, Yao XJ, Weis WI, Stevens RC, Kobilka BK (2007). "GPCR engineering yields high-resolution structural insights into β2-adrenergic receptor function". Science 318 (5854): 1266–73. PMID 17962519. doi:10.1126/science.1150609.
- ↑ Rasmussen SG, Choi HJ, Fung JJ, Pardon E, Casarosa P, Chae PS, Devree BT, Rosenbaum DM, Thian FS, Kobilka TS, Schnapp A, Konetzki I, Sunahara RK, Gellman SH, Pautsch A, Steyaert J, Weis WI, Kobilka BK (xaneiro de 2011). "Structure of a nanobody-stabilized active state of the β(2) adrenoceptor". Nature 469 (7329): 175–80. PMC 3058308. PMID 21228869. doi:10.1038/nature09648.
- ↑ Rosenbaum DM, Zhang C, Lyons JA, Holl R, Aragao D, Arlow DH, Rasmussen SG, Choi HJ, Devree BT, Sunahara RK, Chae PS, Gellman SH, Dror RO, Shaw DE, Weis WI, Caffrey M, Gmeiner P, Kobilka BK (xaneiro de 2011). "Structure and function of an irreversible agonist-β(2) adrenoceptor complex". Nature 469 (7329): 236–40. PMC 3074335. PMID 21228876. doi:10.1038/nature09665.
- ↑ Warne T, Moukhametzianov R, Baker JG, Nehmé R, Edwards PC, Leslie AG, Schertler GF, Tate CG (xaneiro de 2011). "The structural basis for agonist and partial agonist action on a β(1)-adrenergic receptor". Nature 469 (7329): 241–4. PMC 3023143. PMID 21228877. doi:10.1038/nature09746.
- ↑ Xu F, Wu H, Katritch V, Han GW, Jacobson KA, Gao ZG, Cherezov V, Stevens RC (abril de 2011). "Structure of an agonist-bound human A2A adenosine receptor". Science 332 (6027): 322–7. PMC 3086811. PMID 21393508. doi:10.1126/science.1202793.
- ↑ Rasmussen SG, Devree BT, Zou Y, Kruse AC, Chung KY, Kobilka TS, Thian FS, Chae PS, Pardon E, Calinski D, Mathiesen JM, Shah ST, Lyons JA, Caffrey M, Gellman SH, Steyaert J, Skiniotis G, Weis WI, Sunahara RK, Kobilka BK (xullo de 2011). "Crystal structure of the β(2) adrenergic receptor-Gs protein complex". Nature 477 (7366): 549–55. PMC 3184188. PMID 21772288. doi:10.1038/nature10361.
- ↑ Lohse MJ, Benovic JL, Codina J, Caron MG, Lefkowitz RJ (xuño de 1990). "β-Arrestin: a protein that regulates β-adrenergic receptor function". Science 248 (4962): 1547–1550. PMID 2163110. doi:10.1126/science.2163110.
- ↑ Luttrell LM, Lefkowitz RJ (febreiro de 2002). "The role of beta-arrestins in the termination and transduction of G-protein-coupled receptor signals". J. Cell. Sci. 115 (Pt 3): 455–65. PMID 11861753.
- ↑ Millar RP, Newton CL (xaneiro de 2010). "The year in G protein-coupled receptor research". Mol. Endocrinol. 24 (1): 261–74. PMID 20019124. doi:10.1210/me.2009-0473.
- ↑ Brass LF (setembro de 2003). "Thrombin and platelet activation". Chest 124 (3 Suppl): 18S–25S. PMID 12970120. doi:10.1378/chest.124.3_suppl.18S.
- ↑ Rubenstein, Lester A. and Lanzara, Richard G. (1998). "Activation of G protein-coupled receptors entails cysteine modulation of agonist binding". Journal of Molecular Structure (Theochem) 430: 57–71. doi:10.1016/S0166-1280(98)90217-2.
- ↑ http://www.bio-balance.com/
- ↑ Chun Ming Teoh, John Kit Chung Tam, Thai Tran. Integrin and GPCR Crosstalk in the Regulation of ASM Contraction Signaling in Asthma. J Allergy (Cairo). 2012; 2012: 341282. Publicado en liña o 29 de setembro de 2012. doi 10.1155/2012/341282
- ↑ Kim JY, Haastert PV, Devreotes PN (abril de 1996). "Social senses: G-protein-coupled receptor signaling pathways in Dictyostelium discoideum". Chem. Biol. 3 (4): 239–43. PMID 8807851. doi:10.1016/S1074-5521(96)90103-9.
- ↑ Duchene J, Schanstra JP, Pecher C, Pizard A, Susini C, Esteve JP, Bascands JL, Girolami JP (2002). "A novel protein-protein interaction between a G protein-coupled receptor and the phosphatase SHP-2 is involved in bradykinin-induced inhibition of cell proliferation". J Biol Chem 277 (43): 40375–83. PMID 12177051. doi:10.1074/jbc.M202744200.
- ↑ Chen-Izu Y, Xiao RP, Izu LT, Cheng H, Kuschel M, Spurgeon H, Lakatta EG (novembro de 2000). "G(i)-dependent localization of beta(2)-adrenergic receptor signaling to L-type Ca(2+) channels". Biophys. J. 79 (5): 2547–56. PMC 1301137. PMID 11053129. doi:10.1016/S0006-3495(00)76495-2.
- ↑ 45,0 45,1 Tan CM, Brady AE, Nickols HH, Wang Q, Limbird LE (2004). "Membrane trafficking of G protein-coupled receptors". Annu. Rev. Pharmacol. Toxicol. 44: 559–609. PMID 14744258. doi:10.1146/annurev.pharmtox.44.101802.121558.
- ↑ Penela P, Ribas C, Mayor F (novembro de 2003). "Mechanisms of regulation of the expression and function of G protein-coupled receptor kinases". Cell. Signal. 15 (11): 973–81. PMID 14499340. doi:10.1016/S0898-6568(03)00099-8.
- ↑ Krueger KM, Daaka Y, Pitcher JA, Lefkowitz RJ (1997). "The role of sequestration in G protein-coupled receptor resensitization. Regulation of β2-adrenergic receptor dephosphorylation by vesicular acidification". J. Biol. Chem. 272 (1): 5–8. PMID 8995214. doi:10.1074/jbc.272.1.5.
- ↑ Laporte SA, Oakley RH, Holt JA, Barak LS, Caron MG (2000). "The interaction of β-arrestin with the AP-2 adaptor is required for the clustering of β2-adrenergic receptor into clathrin-coated pits". J. Biol. Chem. 275 (30): 23120–6. PMID 10770944. doi:10.1074/jbc.M002581200.
- ↑ Laporte SA, Oakley RH, Zhang J, Holt JA, Ferguson SS, Caron MG, Barak LS (1999). "The beta2-adrenergic receptor/betaarrestin complex recruits the clathrin adaptor AP-2 during endocytosis". Proc. Natl. Acad. Sci. U.S.A. 96 (7): 3712–7. PMC 22359. PMID 10097102. doi:10.1073/pnas.96.7.3712.
- ↑ Margeta-Mitrovic M, Jan YN, Jan LY (2000). "A trafficking checkpoint controls GABA(B) receptor heterodimerization". Neuron 27 (1): 97–106. PMID 10939334. doi:10.1016/S0896-6273(00)00012-X.
- ↑ White JH, Wise A, Main MJ, Green A, Fraser NJ, Disney GH, Barnes AA, Emson P, Foord SM, Marshall FH (1998). "Heterodimerization is required for the formation of a functional GABA(B) receptor". Nature 396 (6712): 679–82. PMID 9872316. doi:10.1038/25354.
- ↑ Krishnan A, Alme´n MS, Fredriksson R, Schiöth HB (2012). Xue, Chaoyang, ed. "The Origin of GPCRs: Identification of Mammalian like Rhodopsin, Adhesion, Glutamate and Frizzled GPCRs in Fungi". PLoS ONE 7 (1): e29817. PMC 3251606. PMID 22238661. doi:10.1371/journal.pone.0029817.
- ↑ Nordström KJ, Sällman Almén M, Edstam MM, Fredriksson R, Schiöth HB (2011). "Independent HHsearch, Needleman–Wunsch-Based, and Motif Analyses Reveal the Overall Hierarchy for Most of the G Protein-Coupled Receptor Families". Mol Biol Evol 28 (9): 2471–80. PMID 21402729. doi:10.1093/molbev/msr061.
- ↑ Bakthavatsalam D, Brazill D, Gomer RH, Eichinger L, Rivero F, Noegel AA (2007). "A G protein-coupled receptor with a lipid kinase domain is involved in cell-density sensing". Curr Biol 17 (10): 892–7. PMID 17481898. doi:10.1016/j.cub.2007.04.029.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
- Receptor metabolotrópico
- Receptor orfo
- Pepducinas, unha clase de drogas candidatas a ser ligandos de GPCRs
Ligazóns externas[editar | editar a fonte]
| Commons ten máis contidos multimedia sobre: Receptor acoplado á proteína G |
- G-protein-coupled receptors Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- "GPCR Database". IUPHAR Database. International Union of Basic and Clinical Pharmacology. Arquivado dende o orixinal o 15 de setembro de 2008. Consultado o 2008-08-11.
- Vriend G, Horn F (2006-06-29). "GPCRDB: Information system for G protein-coupled receptors (GPCRs)". proxecto Molecular Class-Specific Information System (MCSIS). Arquivado dende o orixinal o 25 de abril de 2019. Consultado o 2008-08-11.
- "G Protein-Coupled Receptors on the NET". Consultado o 2010-11-10.
unha clasificación dos GPCRs
- "PSI GPCR Network Center". Arquivado dende o orixinal o 25 de xullo de 2013. Consultado o 2013-07-11.
unha Protein Structure Initiative:Biology Network Center dedioada a determinar as estruturas en 3D de proteínas da familia dos GPCR representativas
Bibliografía[editar | editar a fonte]
- "The Nobel Prize in Chemistry 2012" (PDF). Arquivado dende o orixinal (PDF) o 08 de outubro de 2014. Consultado o 2014-04-11.
- Vassilatis DK, Hohmann JG, Zeng H, Li F, Ranchalis JE, Mortrud MT, Brown A, Rodriguez SS, Weller JR, Wright AC, Bergmann JE, Gaitanaris GA (2003). "The G protein-coupled receptor repertoires of human and mouse". Proc Natl Acad Sci USA 100 (8): 4903–8. PMC 153653. PMID 12679517. doi:10.1073/pnas.0230374100.
- "GPCR Reference Library". Consultado o 2008-08-11.
Referencia para modelos matemáticos e moleculares para a resposta receptora inicial
- estruturas dos GPCR no PDB
