Dictyostelium discoideum
| Dictyostelium discoideum | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Corpos frutíferos de D. discoideum
| |||||||||||||||||
| Clasificación científica | |||||||||||||||||
| |||||||||||||||||
| Nome binomial | |||||||||||||||||
| Dictyostelium discoideum Raper, 1935[1] | |||||||||||||||||
Dictyostelium discoideum é unha especie de ameba que vive no solo pertencente ao filo Amoebozoa, infrafilo Mycetozoa. Considerado un mofo mucoso, D. discoideum é un eucariota que durante o seu ciclo de vida pasa de ser un conxunto de amebas unicelulares separadas a unha masa multicelular e despois a un corpo frutífero. O seu peculiar ciclo de vida asexual consta de catro fases: vexetativa, agregación, migración e culminación. O ciclo vital de D. discoideum é relativamente curto, o que permite observar sucesivamente as catro etapas de maneira doada. As células implicadas no ciclo de vida realizan movementos, sinalización química e desenvolvemento, o que é aplicable á investigación do cancro humano. A simplicidade do seu ciclo vital fai que D. discoideum sexa un valioso organismo modelo para estudos de procesos xenéticos, celulares e bioquímicos aplicables a outros organismos.
Hábitat natural e dieta[editar | editar a fonte]
Na natureza D. discoideum pode encontrarse no solo e na capa de follas caídas húmidas dos bosques temperados caducifolios. A súa dieta primaria consiste en bacterias que encontran no solo e materia orgánica en descomposición.[2]
Ciclo vital e reprodución[editar | editar a fonte]
O ciclo vital de D. discoideum empeza como esporas que son liberadas dun sorocarpo (corpo frutífero) maduro. As mixoamebas saen das esporas cando as condicións son cálidas e húmidas. Durante a súa fase vexetativa, as mixoamebas divídense por mitose e aliméntanse de bacterias. A bacteria segrega ácido fólico, que atrae mixoamebas. Cando as bacterias escasean, as mixoamebas entran na fase de agregación.
Durante a agregación, a falta de alimento inicia a creación dunha maquinaria bioquímica que inclúe glicoproteínas e adenilil ciclase.[3] As glicoproteínas permiten a adhesión célula-célula e a adenilil ciclase xera AMP cíclico. O AMP cíclico é segregado polas amebas para atraer céllas veciñas a unha localización central. A medida que se moven cara ao sinal, chocan unhas con outras e péganse utilizando as moléculas glicoproteicas de adhesión, formando o agregado.

A fase de migración empeza unha vez que as amebas formaron un apertado agregado e a morea alongada de células derrúbase formando unha capa plana no chan. As amebas traballan xuntas como un pseudoplasmodio móbil, parecido a unha masa que lembra unha "lesma" duns 2 a 4 mm de longo, composta de ata 100 000 células,[4] e pode moverse ao producir unha vaíña de celulosa nas súas células anteriores a través da cal se move a masa.[5] Parte desta vaíña queda atrás como un rastro mucoso a medida que o pseudoplasmodio se move cara a atractores como a luz, calor e humidade, sempre cara a adiante.[5] O AMP cíclico e unha substancia chamada factor indutor da diferenciación, axuda a formar diferentes tipos celulares.[5] A masa ou "lesma" diferénciase en células prepedúnculo e células preespora que se moven aos extremos anterior e posterior, respectivamente. Unha vez que o pseudoplasmodio encontra un ambiente axeitado, o seu extremo anterior forma o pedúnculo ou talo do corpo frutífero e o posterior forma as esporas do corpo frutífero.[5] Só recentemente se descubriu que existen tamén unhas células similares ás anteriores, que se dispersan pola rexión posterior da "lesma". Estas células similares ás anteriores forman a parte inferior do corpo frutífero e as cubertas das esporas.[5] Unha vez que o pseudoplasmodio se establece nun lugar, o extremo posterior esténdese e o o extremo anterior queda elevado no aire, formando o chamado "sombreiro mexicano" e empeza a fase de culminación.
As células prepedúnculo e as preespora cambian as súas posicións na fase de culminación para formar o corpo frutífero maduro.[5] O extremo anterior do "sombreiro mexicano" forma un tubo de celulosa, que permite que as células máis posteriores se movan por fora do tubo ata a parte superior, e as células prepedúnculo móvense cara a abaixo.[5] Este rearranxo forma o pedúnculo ou talo do corpo frutífero feito de células do extremo anterior da masa, e as células do extremo posterior da masa están na parte superior e agora forman as esporas do corpo frutífero. Ao final deste proceso de 8 a 10 horas de duración, o corpo frutífero maduro está completamente formado.[5] Este corpo frutífero mide de 1 a 2 mm de alto e pode agora comezar de novo un ciclo completo ao liberar esporas maduras que se converten en mixoamebas.
Reprodución sexual[editar | editar a fonte]
En xeral, aínda que D. discoideum xeralmente se reproduce asexualmente, pode tamén realizar a reprodución sexual se se dan certas condicións. D. discoideum ten tres tipos de apareamento diferentes (~"sexos") e identificouse o locus sexual que especifica estes tres tipos. As cepas de tipo I están especificadas polo xene chamado MatA, as cepas de tipo II teñen tres xenes: MatB (homólogo de Mat A), Mat C e Mat D, e as capas de tipo III teñen os xenes Mat S e Mat T (que son homólogos de Mat C e Mat D).[6] Estes sexos só se poden aparear cos dous sexos que son diferentes ao propio (dos tres que hai) e non co seu mesmo sexo.[6]
Cando se incuban con bacterias que lles serven de alimento, pode ocorrer un desenvolvemento sexual heterotálico ou homotálico, o que ten como resultado a formación dun cigoto diploide.[7][8] O apareamento heterotálico acontece cando dúas amebas de diferentes tipos de apareamento están presentes nun ambiente escuro e húmido, onde poden fusionarse durante a agregación para formar unha célula cigótica xigante. A célula xigante libera despois AMPc para atraer outras células, despois fagocita as outras células canibalmente no agregado. As células consumidas serven para encaixar o agregado completo nunha grosa parede de celulosa para protexelo. Isto denomínase macrocisto. Dentro do macrocisto, a célula xigante divídese primeiro por meiose, e despois por mitose para producir moitas amebas haploides, que serán liberadas para que se alimenten como farían as amebas normais. As cepas homotálicas de D. discoideum AC4 e ZA3A poden tamén producir macrocistos.[9] Cada unha destas cepas, a diferenza das cepas heterotálicas, probablemente expresa ambos os alelos de tipo de apareamento (matA e mata). Aínda que a reprodución sexual é posible, é moi raro ver a xerminación con éxito dun macrocisto de D. discoideum en condicións de laboratorio. Non obstante, a recombinación é común nas poboacións naturais de D. discoideum, o que indica que o sexo é probablemente un aspecto importante do seu ciclo vital.[8]
Uso como organismo modelo[editar | editar a fonte]
Como moitos dos seus xenes son homólogos dos xenes humanos e o seu ciclo de vida é simple, D. discoideum utilízase frecuentemente como organismo modelo. Pode observarse a nivel molecular, celular ou de organismo principalmente porque ten un número restrinxido de tipos celulares e comportamentos e polo seu rápido crecemento.[5] Utilízase para estudar procesos celulares normais como a diferenciación celular, quimiotaxe e morte celular programada. Tamén se usa para estudar outros aspectos do desenvolvemento, como a selección celular, formación de padróns, fagocitose, motilidade e transdución de sinais.[10] Estes procesos e aspectos do desenvolvemento están ausentes ou son difíciles de observar noutros organismos modelo. D. discoideum está estreitamente relacionado cos metazoos superiores. Ten xenes e vías similares, o que o fai un bo candidato para os knockout de xenes.[11]
Os procesos de diferenciación celular occorren cando unha célula se fai máis especializada durante o desenvolvemento nun organismo multicelular. Os cambios de tamaño, forma, actividades metabólicas e capacidade de resposta poden ocorrer como resultado de axustes na expresión xénica. Nesta especie a diversidade celular e a diferenciación implican decisións feitas por medio de interaccións célula-célula en vías que formarán células do pedúnculo ou células das esporas.[12] Este destino final das células depende do seu ambiente e formación de padróns. Por tanto, o organismo é un excelente modelo para estudar a diferenciación celular.
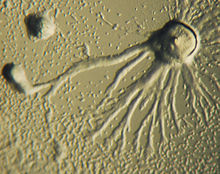
A quimiotaxe é o movemento dun organismo cara a ou afastándose dun estímulo químico ao longo dun gradiente químico de concentración. Certos organismos mostran quimiotaxe cando se moven cara a unha fonte de nutrientes. En D. discoideum, a ameba segrega un sinal, o AMPc, fóra da célula, que atrae outras amebas, que migran cara a fonte do sinal. Cada ameba móvese cara a unha ameba central, que está producindo a maior cantidade de secrecións de AMPc. A secreción de AMPc pasan despois a facela todas as amebas e funciona como unha chamada para que se empecen a agregar. Estas emisións químicas e o movemento das amebas ocorren cada seis minutos. As amebas móvense cara ao gradiente de concentración durante 60 segundos e detéñense ata que se envía a seguinte secreción. Este comportamento de células individuais tende a causar oscilacións nun grupo de células e propáganse ondadas químicas de diversas concentracións de AMPc a través do grupo en espirais.[13]:174–175
Os biólogos matemáticos Thomas Höfer e Martin Boerlijst descubriron un elegante conxunto de ecuacións matemáticas que reproducen as espirais e os padróns de fluxo de D. discoideum. O biólogo matemático Cornelis J. Weijer probou que ecuacións similares poden modelar os seus movementos. As ecuacións destes padróns están infuenciadas principalmente pola densidade da poboación de amebas, a taxa de produción de AMPc e a sensibilidade das amebas individuais ao AMPc. O padrón en espirais está formado polas amebas do centro dunha colonia, que rotan a medida que envían ondadas de AMPc.[14][15]
O uso do AMPc como axente quimiotáctico non se estableceu en ningún outro organismo. Na bioloxía do desenvolvemento, este é un exemplo ben comprensible de quimiotaxe, que é importante para comprender a inflamación humana, artrite, asma, tráfico de linfocitos e guía dos axóns. A fagocitose utilízase na vixilancia inmunitaria e a presentación de antíxenos, mentres que a determinación do tipo celular, selección de células e formación de padróns son características básicas da embrioxénese, que poden ser estudadas con este organismo.[5]
Nótese, porén, que as oscilacións de AMPc poden non ser necesarias para a migración celular colectiva nos estadios multicelulares. Un estudo atopou cambios na sinalización mediada polo AMPc desde ondas propagantes a un estado estable na fase multicelular de D. discoideum.[16]
A termotaxe é o movemento ao longo dun gradiente de temperatura. No estadio de "lesma" este organismo migra ao longo de gradientes extremadamente pequenos de só 0,05 °C/cm, pero a dirección elixida é complicada; parece ser que se dirixen lonxe dunha temperatura duns 2 °C por debaixo da temperatura á cal se aclimataron. Este complicado comportamento foi analizado por modelización por computadora do comportamento e padrón períodico de cambios de temperatura no solo causados polos cambios diarios na temperatura do aire. A conclusión é que este comportamento fai que se mova a "lesma" desde uns poucos centímetros por debaixo da superficie do chan ata a superficie. Este comportamento é sorprendentemente sofisticado para un organismo primitivo sen un aparente sentido que detecte a gravidade.[13]:108–109
A morte celular programada (apoptose) é unha parte normal do desenvolvemento da especie.[3] A apoptose é necesaria para facer espazo e esculpir órganos complexos. Arredor do 20% das células de D. discoideum sacrifícanse altruistamente para a formación do corpo frutífero maduro. Durante o estadio de pseudoplasmodio (a masa informalmente chamada "lesma" ou grex) do seu ciclo vital, o organismo formou tres tipos celulares: células prepedúnculo, células preespora e células similares ás da parte anterior. Durante a culminación, as células prepedúnculo segregan unha cuberta celulósica e esténdense como un tubo a través da "lesma".[3] A medida que se diferencian, forman vacúolos e agrándanse, elevando as células preespora. As células do pedúnculo ou talo sofren apoptose e morren a medida que as células preespora son elevadas por encima do substrato. As células preespora convértense despois en esporas, e cada unha delas orixinará unha mixoameba unha vez que se disperse.[5] Este é un exemplo de como se usa a apoptose na formación dun órgano reprodutor, o corpo frutífero maduro.
Unha contribución importante recente á investigación de Dictyostelium veu da aplicación de novas técnicas que permiten visualizar a actividade de xenes concretos nas células vivas.[17] Isto viuse que a transcrición ocorre en "explosións" ou "pulsos" (explosión transcricional) en vez de seguindo un comportamento simple probabilístico ou continuo. A transcrición explosiva agora parece que está conservada entre bacterias e humanos. Outra característica salientable do organismo é que ten conxuntos de enzimas de reparación do ADN que se encontran tamén en células humanas, dos que carecen moitos outros sistemas modelos de metazoos habituais.[18] Os defectos na reparación do ADN orixinan cancros humanos devastadores, polo que a capacidade de estudar as proteínas de reparación humanas nun modelo simple manexable é moi valiosa.
Cultivo no laboratorio[editar | editar a fonte]
A capacidade deste organismo de poder ser cultivado doadamente no laboratorio[5] é outra vantaxe que ten como organismo modelo. Aínda que D. discoideum pode crecer en cultivo líquido, crece xeralmente en placa de Petri que contén ágar nutriente e coa superficie mantida húmida. Os cultivos medran mellor a 22–24 °C. D. discoideum aliméntase principalmente de Escherichia coli no laboratorio, que é un alimento adecuado en todos os estadios do seu ciclo de vida. Cando a fonte de comida diminúe, as mixamebas agréganse para formar o pseudoplasmodio. Rapidamente, a placa queda cuberta con varios estadios do ciclo vital. A comprobación da placa adoita permitir observacións detalladas do desenvolvemento. As células poden ser recollidas en calquera estadio do desenvolvemento e crecen rapidamente.
Cando se cultiva D. discoidium no laboratorio é importante ter en conta as súas respostas de comportamento. Por exemplo, ten unha afinidade pola luz, temperaturas maiores, alta humidade, concentracións iónicas baixas e polo lado ácido do gradiente de pH. A miúdo fanse experimentos para ver como as manipulacións destes parámetros alteran, deteñen ou aceleran o desenvolvemento. As variacións destes parámetros poden alterar a taxa de viabilidade do crecemento do cultivo. Ademais, os corpos frutíferos, como son o estado de maior altura sobre o substrato de todo o desenvolvemento, son moi sensibles ás correntes de aire e aos estímulos físicos. Non se coñece se hai un estímulo que estea implicado na liberación das esporas.
Estudos de expresión de proteínas[editar | editar a fonte]
As análises detalladas da expresión de proteínas en Dictyostelium foron obstaculizadas polas grandes variacións no perfil de expresión de proteínas entre diferentes estadios de desenvolvemento e unha falta xeral de anticorpos comercialmente dispoñibles para os antíxenos de Dictyostelium.[19] En 2013, un grupo do Beatson West of Scotland Cancer Centre informou dun estándar de visualización de proteínas sen anticorpos para inmunoblotting baseado na detección de MCCC1 usando conxugados de estreptavidina.[20]
Enfermidade do lexionario[editar | editar a fonte]
O xénero de bacterias Legionella inclúe a especie que causa en humanos a enfermidade do lexionario. D. discoideum é tamén un hóspede de Legionella e é un modelo axeitado para estudar o seu proceso de infección.[21] Concetamente, D. discoideum comparte coas células hóspede de mamíferos un citoesqueleto similar e procesos celulares relevantes para a infección por Legionella, como a fagocitose, tráfico nas membranas, endocitose, selección de vesículas e quimiotaxe.
"Cultivo" de bacterias para a súa alimentación[editar | editar a fonte]
Un artigo de 2011 publicado en Nature demostraba a existencia dun "primitivo comportamento de cultivo" de bacterias en colonias de D. discoideum, que o organismo utilizaba para a súa alimentación.[22][23] O comportamento foi descrito como unha "simbiose" entre D. discoideum e as súas presas bacterianas, e aproximadamente un terzo das colonias recollidas na natureza de D. discoideum realizaban esta "crianza" ou cultivo de bacterias unha vez que as bacterias eran incluídas dentro dos corpos frutíferos do mofo mucoso.[23] A incorporación das bacterias nos corpos frutíferos permite "sementar" a fonte de alimento na parte desde onde se van dispersar as esporas, o cal é especialmente valioso se a nova localización é pobre en alimentos.[23] As colonias priducidas a partir das esporas "cultivadoras" mostran tamén tipicamente o mesmo comportamento cando esporulan. Esta incorporación ten un custo asociado: as bacterias que non consomen todas as presas bacterianas producen esporas máis pequenas que non se poden dispersar tan amplamente. Ademais, hai menos beneficios para as esporas que conteñen bacterias que caen nunha rexión rica en alimentos. Este equilibrio de custos e beneficios deste comportamento pode contribuír a que sexa unha minoría de colonias de D. discoideum a que realice esta práctica.[22][23] D. discoideum aliméntase tanto de bacterias grampositivas coma de gramnegativas, pero algunhas das bacterias fagocitadas, incluíndo algúns patóxenos humanos,[24] poden vivir na ameba e despois saír dela sen matar a célula. Non se sabe cando entran na célula e cando a abandonan. As investigacións non son aínda concluíntes, mais é posible esquematizar un ciclo de vida xeral de D. discoideum adaptado ao cultivo de bacterias para comprender mellor este proceso simbiótico.

Na imaxe poden verse diferentes estadios. primeiro, no estadio de activación, as bacterias están encerradas dentro de D. discoideum,[24] despois de entrar nas amebas están nun fagosoma e a fusión cos lisosomas está bloqueada; estes fagosomas inmaturos están rodeados por orgánulos da célula hóspede como mitocondrias, vesículas e membranas multicapa derivadas do retículo endoplasmático rugoso (RER) das amebas. O papel do RER na infección intracelular non se coñece, pero o RER non é necesario como fonte de proteínas para a bacteria.[25] A bacteria vive dentro deses fagosomas durante a agregación e os estadios de desenvolvemento multicelular. As amebas conservan a súa individualidade e cada ameba ten a súa propia bacteria. Durante o estadio de culminación, cando se producen as esporas, as bacterias pasan da célula ao soro coa axuda de estruturas citoesqueléticas que impiden a destrución da célula hóspede.[26] Algúns resultados suxiren que as bacterias sérvense da exocitose sen matar a célula.[26] As amebas de vida libre parecen xogar un papel crucial para a persistencia e dispersión dalgúns patóxenos no ambiente. A asociación transitoria coas amebas observouse en diferentes bacterias, como Legionella pneumophila, moitas especies de Mycobacterium, Francisella tularensis e Escherichia coli, entre outras.[25] Este cultivo parece xogar un papel fundamental na supervivencia de patóxenos, xa que poden vivir e replicarse dentro de D. discoideum. O informe de Nature supuxo un importante avance no coñecemento do comportamento das amebas, que son un excelente exemplo de comportamento social cunha sorprendente coordinación e sentido do sacrificio para o beneficio da especie.
Células sentinelas[editar | editar a fonte]
As células sentinelas de Dictyostelium discoideum son células fagocíticas responsables de eliminar o material tóxico no estado de pseudoplasmodio (a "lesma") do seu ciclo. Son células xeralmente arredondadas que están presentes na vaíña da masa psuedoplasmodial, onde están circulando libremente. O proceso de detoxificación ocorre cando estas células fagocitan toxinas e patóxenos que hai no pseudoplasmodio. Despois, as células xúntanse en grupos de cinco a dez células, que despois se unen á vaíña interna do pseudoplasmodio. A vaíña vaise desprendendo a medida que a "lesma" migra a un novo lugar na procura de bacterias.
As células sentinela constitúen aproximadamente o 1% do número total das células do pseudoplasmodio, e o número de células sentinela permanece constante mesmo se son liberadas. Isto indica que hai unha constante rexeneración de células sentinela no pseudoplasmodio, xa que estas son eliminadas xunto coas toxinas e patóxenos. As células sentinela están presentes tamén incluso se non hai toxinas ou patóxenos que eliminar. Foron localizadas células sentinela noutras cinco especies do xénero Dictyostelia, o que suxire que estas células poden constituír unha característica xeral dun sistema inmunitario innato en amebas sociais.[27]
Células sentinela en colonias cultivadoras e non cultivadoras[editar | editar a fonte]
O número de células sentinela varía dependendo se a colonia silvestre de D. discoideum cultiva bacterias simbióticas ou non. Cando son expostas a ambientes tóxicos creados polo uso de bromuro de etidio, obsérvase que o número de células sentinelas por milímetro é menor nas colonias cultivadoras que nas non cultivadoras. Chegouse a esta conclusión observando os rastros que deixan detrás os pseudoplasmodios que migran e contando o número de células sentinela presentes nun milímetro. Porén, o número de células sentinela non afecta a produción de esporas e a viabilidade nas cultivadoras. As cultivadoras expostas a un ambiente tóxico producen o mesmo número de esporas que as cultivadoras nun ambiente non tóxico e a viabilidade das esporas era a mesma en cultivadoras e non cultivadoras. Cando bacterias do Clado 2 de Burkholderia ou bacterias asociadas a colonias cultivadoras son retiradas dos Dictyostelium cultivadores, a produción de esporas e a viailidade eran similares ás dos non cultivadores. Suxeriuse que as bacterias que portan os cultivadores proporcionan un papel adicional de protección para os cultivadores contra o dano potencial debido a toxinas ou patóxenos.[28]
Clasificación e filoxenia[editar | editar a fonte]
Nas vellas clasificacións Dictyostelium estaba situado na defunta clase polifilética dos Acrasiomycetes. Esta era unha clase de mofos mucosos celulares, que se caracterizaba pola agregación de amebas individuais nun corpo frutífero multicelular, o que era un importante aspecto que relacionaba os acrásidos cos dictiostélidos.[29]
Estudos xenómicos máis recentes mostraron que Dictyostelium mantivo maior proporción da súa diversidade xenómica que plantas e animais, aínda que a filoxenia baseada no proteoma confirma que os amebozoos diverxeron da liñaxe animal-fúnxica despois da separación plantas-animais.[30] A subclase Dictyosteliidae, orde Dictyosteliales é unha ensamblxe monofilética en Mycetozoa, un grupo que inclúe os mofos mucosos protostélidos, dictiostélidos e mixogástridos. As análises de datos do factor de elongación-1α (EF-1α) apoian que Mycetozoa é un grupo monofilético, aínda que as árbores de ARNr sitúano como grupo polifilético. Ademais, estes datos apoian a idea de que os dictiostélidos e mixogástridos están máis estreitamente emparentados entre si que cos protostélidos. As análises de EF-1α tamén sitúa a Mycetozoa como o grupo externo (outgroup) inmediato do clado animal-fúnxico.[31] Os datos filoxenéticos máis recentes sitúan os dictiostéliidos firmemente dentro do supergrupo Amoebozoa, xunto cos mixomicetos. Por outra parte, os protostélidos pasan a considerarse polifiléticos, e os seus corpos frutíferos pedunculados son unha característica converxente de múltiples liñaxes non relacionadas.[32]
Xenoma[editar | editar a fonte]
O proxecto de secuenciación do xenoma de D. discoideum completouse e publicouse en 2005 por unha colaboración internacional de institutos. Este foi o primeiro xenoma dun protozoo de vida libre en ser secuenciado completamente. D. discoideum contén un xenoma haploide de 34 Mb cunha composición de bases de 77% [A+T] e consta de seis cromosomas que codifican unhas 12 500 proteínas.[2] A secuenciación do xenoma de D. discoideum proporciona datos para un estudo máis detallado da súa bioloxía celular e do desenvolvemento.
No seu xenoma abundan as repeticións en tándem de trinucleótidos; unha clase do xenoma está agrupado, o que levou a pensar que serve como centrómero. As repeticións corresponden a secuencias repetidas de aminoácidos e crese que foron expandidas por expansión de nucleótidos.[2] A expansión de repeticións de trinucleótidos tamén ocorre en humanos, causando en xeral moitas enfermidades. Aprender como as células de D. discoideum resisten estas repeticións de aminoácidos pode proporcionar pistas de mecanismos que permitan aos humanos toleralas.
Cada xenoma que se secuencia desempeña un importante papel na identificación de xenes que se perderon ou gañaron co tempo. Os estudos xenómicos comparativos permiten comparar os xenomas eucariotas. Unha filoxenia baseada no proteoma mostrou que os amebozoos se desviaron da liñaxe animal-fúnxica despois da separación plantas-animais.[2] O xenoma de D. discoideum é digno de atención polas moitas proteínas que codifica que se encontran comunmente en fungos, plantas e animais.[2]
Bases de datos[editar | editar a fonte]
- DictyBase - base de datos xenómicos xerais sobre Dictyostelium discoideum.
- Membranome database proporciona información sobre proteínas transmembrana dun só paso de Dictyostelium e outros organismos.
Notas[editar | editar a fonte]
- ↑ Raper, K.B. (1935). "Dictyostelium discoideum, a new species of slime mold from decaying forest leaves". Journal of Agricultural Research 50: 135–147. Arquivado dende o orixinal o 08 de decembro de 2017. Consultado o 15 de abril de 2019.
- ↑ 2,0 2,1 2,2 2,3 2,4 Eichinger L; Noegel, AA (2003). "Crawling in to a new era – the Dictyostelium genome project". The EMBO Journal 22 (9): 1941–1946. PMC 156086. PMID 12727861. doi:10.1093/emboj/cdg214.
- ↑ 3,0 3,1 3,2 Gilbert S.F. 2006. Developmental Biology. 8th ed. Sunderland (MA):Sinauer p. 36-39.
- ↑ Cooper, Geoffrey M (2000). "Chapter 1. An Overview of Cells and Cell Research". The Cell (Work in NCBI Bookshelf). Part I. Introduction (2nd ed.). Sunderland, Massachusetts: Sinauer Associates. Cells As Experimental Models. ISBN 978-0-87893-106-4.
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 5,11 Tyler M.S. 2000. Developmental Biology: A guide for experimental study. 2nd ed. Sunderland (MA): Sinauer. p. 31-34. ISBN 0-87893-843-5
- ↑ 6,0 6,1 Bloomfield, Gareth; Skelton, Jason; Ivens, Alasdair; Tanaka, Yoshimasa; Kay, Robert R. (2010-12-10). "Sex Determination in the Social Amoeba Dictyostelium discoideum". Science (en inglés) 330 (6010): 1533–1536. ISSN 0036-8075. PMC 3648785. PMID 21148389. doi:10.1126/science.1197423.
- ↑ O'Day DH, Keszei A (May 2012). "Signalling and sex in the social amoebozoans". Biol Rev Camb Philos Soc 87 (2): 313–29. PMID 21929567. doi:10.1111/j.1469-185X.2011.00200.x.
- ↑ 8,0 8,1 Flowers JM, Li SI, Stathos A, Saxer G, Ostrowski EA, Queller DC, Strassmann JE, Purugganan MD (July 2010). "Variation, sex, and social cooperation: molecular population genetics of the social amoeba Dictyostelium discoideum". PLoS Genet. 6 (7): e1001013. PMC 2895654. PMID 20617172. doi:10.1371/journal.pgen.1001013.
- ↑ Robson GE, Williams KL (April 1980). "The mating system of the cellular slime mould Dictyostelium discoideum". Curr. Genet. 1 (3): 229–32. PMID 24189663. doi:10.1007/BF00390948.
- ↑ Dictybase, About Dictyostelium. [Online] (1, May, 2009). http://dictybase.org/
- ↑ Dilip K. Nag, Disruption of Four Kinesin Genes in Dictyostelium. [Online] (22, April, 2008). http://ukpmc.ac.uk/articlerender.cgi?artid=1529371 Arquivado 29 de xullo de 2012 en Archive.is
- ↑ Kay R.R.; Garrod D.; Tilly R. (1978). "Requirements for cell differentiation in Dictyostelium discoideum". Nature 211 (5640): 58–60. doi:10.1038/271058a0.
- ↑ 13,0 13,1 Dusenbery, David B. (1996). Life at Small Scale. Scientific American Library. New York. ISBN 978-0-7167-5060-4.
- ↑ Ian Stewart (November 2000). "Biomathematics Patterns: Spiral Slime. MATHEMATICAL RECREATIONS by Ian Stewart. Finding mathematics in creatures great and small". Scientific American.
- ↑ Ian Stewart (2000). What Shape is a Snowflake? [Over sneeuwkristallen en zebrastrepen. De wereld volgens de wiskunde] (en Dutch). Uitgeverij Uniepers; Davidsfonds; Natuur & Techniek. pp. 96–97.
- ↑ Ueda, Masahiro; Masato Yasui; Morimoto, Yusuke V.; Hashimura, Hidenori (2019-01-24). "Collective cell migration of Dictyostelium without cAMP oscillations at multicellular stages". Communications Biology (en inglés) 2 (1): 34. ISSN 2399-3642. doi:10.1038/s42003-018-0273-6.
- ↑ Chubb, JR; Trcek, T; Shenoy, SM; Singer, RH (2006). "Transcriptional pulsing of a developmental gene". Current Biology 16 (10): 1018–25. PMC 4764056. PMID 16713960. doi:10.1016/j.cub.2006.03.092.
- ↑ Hudson J. J.; Hsu D. W.; Guo K.; Zhukovskaya N.; Liu P. H.; Williams J. G.; Pears C. J.; Lakin N. D. (2005). "DNA-PKcs-dependent signaling of DNA damage in Dictyostelium discoideum". Curr Biol 15 (20): 1880–5. PMID 16243037. doi:10.1016/j.cub.2005.09.039.
- ↑ "Immunoblotting: Equality for slime molds!". BioTechniques (paper) 55 (1): 9. July 2013.
- ↑ Davidson, Andrew J.; King, Jason S.; Insall, Robert H. (July 2013). "The use of strepavidin conjugates as immunoblot loading controls of mitrochondrial markers for use with Dictyostelium discoidium". Benchmarks. BioTechniques (paper) 55 (1): 39–41.
- ↑ Bruhn H. 2008. Dictyostelium, a tractable model host organism for Legionella. In: Heuner K, Swanson M, editors. Legionella: Molecular Microbiology. Norwich (UK): Caister Academic Press. ISBN 978-1-904455-26-4
- ↑ 22,0 22,1 "Amoebas show primitive farming behaviour as they travel", BBC News, 19 January 2011
- ↑ 23,0 23,1 23,2 23,3 Brock DA, Douglas TE, Queller DC, Strassmann JE (20 January 2011). "Primitive agriculture in a social amoeba". Nature 469 (7330): 393–396. PMID 21248849. doi:10.1038/nature09668.
- ↑ 24,0 24,1 Clarke, Margaret (2010). "Recent insights into host-pathogen interactions from Dyctiostelium". Cellular Microbiology 12 (3): 283–291. doi:10.1111/j.1462-5822.2009.01413.x.
- ↑ 25,0 25,1 Molmeret M., Horn, M., Wagner, M., Abu Kwaik, Y (January 2005). "Primitive Amoebae as Training Grounds for Intracellular Bacterial Pathogens". Appl Environ Microbiol 71 (1): 20–28. PMC 544274. PMID 15640165. doi:10.1128/AEM.71.1.20-28.2005.
- ↑ 26,0 26,1 Grant P.Ottom Mary Y.Wu; Margaret Clarke; Hao Lu; O.Roger Anderson; Hubert Hilbi; Howard A. Shuman; Richard H. Kessin (11 November 2003). "Macroautophagy is dispensable for intracellular replication of Legionella pneumophila in Dictyostelium discoideum". Molecular Microbiology 51 (1): 63–72. PMID 14651611. doi:10.1046/j.1365-2958.2003.03826.x.
- ↑ Chen, Guokai; Zhuchenko, Olga; Kuspa, Adam (2007-08-03). "Immune-like Phagocyte Activity in the Social Amoeba". Science (New York, NY) 317 (5838): 678–681. ISSN 0036-8075. PMC 3291017. PMID 17673666. doi:10.1126/science.1143991.
- ↑ Brock, Debra A.; Callison, W. Éamon; Strassmann, Joan E.; Queller, David C. (2016-04-27). "Sentinel cells, symbiotic bacteria and toxin resistance in the social amoeba Dictyostelium discoideum". Proc. R. Soc. B (en inglés) 283 (1829): 20152727. ISSN 0962-8452. PMC 4855374. PMID 27097923. doi:10.1098/rspb.2015.2727.
- ↑ Cavender J.C.; Spiegl F.; Swanson A. (2002). "Taxonomy, slime molds, and the questions we ask". The Mycological Society of America 94 (6): 968–979. PMID 21156570.
- ↑ Eichenger L.; et al. (2005). "The genome of the social amoeba Dictyostelium discoideum". Nature 435 (7038): 34–57. PMC 1352341. PMID 15875012. doi:10.1038/nature03481.
- ↑ Baldauf S.L.; Doolittle W.F. (1997). "Origin and evolution of the slime molds (Mycetozoa)". PNAS 94 (22): 12007–12012. PMC 23686. PMID 9342353. doi:10.1073/pnas.94.22.12007.
- ↑ Shadwick, LL; Spiegel, FW; Shadwick, JD; Brown, MW; Silberman, JD (2009). "Eumycetozoa = Amoebozoa?: SSUrDNA Phylogeny of Protosteloid Slime Molds and Its Significance for the Amoebozoan Supergroup". PLoS ONE 4 (8): e6754. PMC 2727795. PMID 19707546. doi:10.1371/journal.pone.0006754.
Véxase tamén[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Mary S. Tyler (2000). Developmental Biology: A Guide for Experimental Study.2nd ed. Sinauer Associates. pp. 31–34. ISBN 978-0-87893-843-8.
- Scott F. Gilbert (2006). Developmental Biology. 8th ed. Sinauer. pp. 36–39. ISBN 978-0-87893-250-4.
Ligazóns externas[editar | editar a fonte]
| Commons ten máis contidos multimedia sobre: Dictyostelium discoideum |
