Hemo A
| Hemo A | |
|---|---|
|
|
Outros nomes Ferro citoporfirina IX, formilporfirina | |
| Identificadores | |
| Número CAS | 18535-39-2 |
| PubChem | 5288529 |
| ChemSpider | 21106444 |
| MeSH | Heme+a |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C49H56O6N4Fe |
| Masa molecular | 852,837 |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
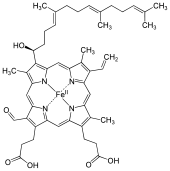
O hemo A é un complexo de coordinación de tipo hemo, que consta dun ligando macrocíclico chamado porfirina, quelado a un ión ferro. O hemo A é unha biomolécula producida por moitos organismos. Está presente, por exemplo, na citocromo c oxidase. Os detalles dos substituítes colgados do anel diferénciano doutros hemos.
Relación con outros hemos
[editar | editar a fonte]O hemo A difire do hemo B en que o grupo metilo que ten este último unido ao anel na posición 8 está oxidado a grupo formilo no hemo A, e en que ten un grupo hidroxietilfarnesil (unha cadea isoprenoide) unida á cadea lateral vinilo na posición 2 do anel do tetrapirrol. O hemo A parécese ao hemo O en que ten igual ca el esta adición farnesilo na posición 2, pero o hemo O carece do grupo formilo en posición 8 (conserva o metilo). A estrutura correcta do hemo A, baseada en experimentos de Resonancia Magnética nuclear (NMR) e IR da forma reducida, con Fe(II), do hemo, foi publicada en 1975.[1]
Historia
[editar | editar a fonte]O hemo A foi illado por primeira vez polo bioquímico alemán Otto Warburg en 1951, que demostrou que era un activo compoñente da metaloproteína integral de membrana citocromo c oxidase.[2]
Estereoquímica
[editar | editar a fonte]A resolución da cuestión estrutural final sobre a configuración xeométrica exacta no primeiro carbono na posición 3 do anel I, que é o carbono unido ao grupo hidroxilo, publicouse recentemente, e tratábase dunha configuración S quiral.[3]
Igual ca o hemo B, o hemo A está a miúdo unido a unha apoproteína por medio de enlaces coordinados entre o ferro hémico e unha cadea lateral de aminoácido conservada. Na importante proteína respiratoria citocromo c oxidase (CCO) este ligando 5 do hemo A no centro de reacción co oxíxeno é un grupo histidil.[4] Este é un ligando común en moitas hemoproteínas, como a hemoglobina e a mioglobina.

Un exemplo de metaloproteína que conteña hemo A é a citocromo c oxidase. Esta proteína enormemente complicada contén hemo A en dous sitios diferentes, cada un cunha función distinta. O ferro do hemo A do citocromo a está hexacoordinado, é dicir, unido a outros seis átomos. O ferro do hemo A do citocromo a3 (que tamén forma parte do complexo) está ás veces unido a cinco átomos e deixa o sesto sitio dispoñible para que se una alí o oxíxeno molecular (O2).[5] Ademais, este encima únese a tres ións cobre, magnesio, cinc, e varios ións potasio e sodio. Crese que os dous grupos hemo A na citocromo c oxidase intercambian doadamente electróns entre eles, e os ións cobre e a proteína fortemente asociada citocromo c.
Tanto o grupo formilo coma a cadea lateral isoprenoide pénsase que xogan importantes papeis na conservación da enerxía da redución do oxíxeno molecular pola citocromo c oxidase, seguramente ao bombear protóns no espazo mitocondrial interno. Crese que tanto o grupo formilo coma o hidroxietilfarnesil do hemo A xogan un importante papel neste proceso crucial como publicou o grupo de S. Yoshikawa.[6]
Notas
[editar | editar a fonte]- ↑ Caughey, W.S.; et al. (1975). "Heme A of Cytochrome c Oxidase". Journal of Biological Chemistry 250: 7602–7622.
- ↑ Warburg, O and Gewitz H S. (1951). "Cytohämin aus Herzmuskel". Zeitschrift für Physiologische Chemie (en alemán) 288: 1–4.
- ↑ Yamashita E, Aoyama H, Yao M, Muramoto K, Shinzawa-Itoh K, Yoshikawa S, Tsukihara T. (2005). "Absolute configuration of the hydroxyfarnesylethyl group of heme A, determined by X-ray structural analysis of bovine heart cytochrome c oxidase using methods applicable at 2.8 Angstrom resolution". Acta Crystallographica D 61 (10): 1373–1377. doi:10.1107/S0907444905023358.
- ↑ Tsukihara T, Shimokata K, Katayama Y, Shimada H, Muramoto K, Aoyama H, Mochizuki M, Shinzawa-Itoh K, Yamashita E, Yao M, Ishimura Y, Yoshikawa S. (2003). "The low-spin heme of cytochrome c oxidase as the driving element of the proton-pumping process". PNAS 100 (26): 15304–15309. PMC 307562. PMID 14673090. doi:10.1073/pnas.2635097100.
- ↑ 5,0 5,1 Yoshikawa, S.; Shinzawa-Itoh, K.; Nakashima, R.; Yaono, R.; Yamashita, E.; Inoue, N.; Yao, M.; Fei, M. J.; Peters Libeu, C. (1998). "Redox-Coupled Crystal Structural Changes in Bovine Heart Cytochrome c Oxidase". Science 280 (5370): 1723–1729. PMID 9624044. doi:10.1126/science.280.5370.1723.
- ↑ Shimokata K, Katayama Y, Murayama H, Suematsu M, Tsukihara T, Muramoto K, Aoyama H, Yoshikawa S, Shimada H. (2007). "The proton pumping pathway of bovine heart cytochrome c oxidase". PNAS 104 (10): 4200–4205. PMC 1820732. PMID 17360500. doi:10.1073/pnas.0611627104.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Hemo, Hemo B, Hemo C, Hemo O
- Hemoproteína
- Citocromo c oxidase (Complexo IV da respiración celular)
