Uroporfirinóxeno III
| Uroporfirinóxeno III | |
|---|---|
 | |
| Identificadores | |
| Número CAS | 1976-85-8 |
| PubChem | 1179 |
| MeSH | Uroporphyrinogen+III |
| Propiedades | |
| Fórmula molecular | C40H44N4O16 |
| Masa molecular | 836,795 g/mol |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O uroporfirinóxeno III é un tetrapirrol, o primeiro intermediario macrocíclico na biosíntese do hemo, clorofila, vitamina B12 e sirohemo. É un composto incoloro, igual que outros porfirinóxenos.[1]
Estrutura
[editar | editar a fonte]A estrutura molecular do uroporfirinóxeno III pode describirse como un núcleo de hexahidroporfina, no que todos os aneis pirrólicos teñen os átomos de hidróxeno dos seus carbonos máis externos substituídos por un grupo de ácido acético (−CH
2−COOH, "A") e un grupo de ácido propiónico (−CH
2−CH
2−COOH, "P"). Os grupos están unidos de forma asimétrica: arredor do macrociclo a orde é: AP-AP-AP-PA.
Biosíntese e metabolismo
[editar | editar a fonte]Na vía xeral da biosíntese da porfirina o uroporfirinóxeno III deriva do tetrapirrol linear preuroporfirinóxeno (un hidroximetilbilano substituído) pola acción do encima uroporfirinóxeno-III cosintase.[2][3]
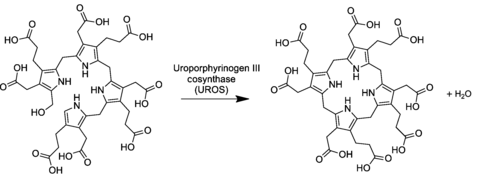
A conversión supón a inversión da última unidade de pirrol (intercambiando así os grupos acético e propiónico) e unha reacción de condensación que pecha o macrociclo eliminando o hidroxilo final −OH cun átomo de hidróxeno do primeiro anel.
Na biosíntese dos hemos e clorofilas o uroporfirinóxeno III convértese en coproporfirinóxeno III polo encima uroporfirinóxeno III descarboxilase. Na biosíntese dos sirohemos o uroporfirinóxeno III convértese por acción de dúas metil transferases en dihidrosirohidroclorina, que seguidamente se oxida a sirohidroclorina, un precursor do grupo prostético sirohemo.
Importancia médica
[editar | editar a fonte]Se a uroporfirinóxeno-III sintase non está presente ou está inactiva, o hidroximetilbilano cíclase espontaneamente no isómero estrutural uroporfirinóxeno I, que difire do isómero III en que os grupos de ácido acético ("A") e propiónico ("P") están situados en orde rotacionalmente simétrica, AP-AP-AP-AP. Neste caos, o seguinte paso produce coproporfirinóxeno I, que se acumula, orixinando unha condición patolóxica chamada porfiria eritropoética conxénita[3]
Notas
[editar | editar a fonte]- ↑ Dalton, J (1969). "Formation of the Macrocyclic Ring in Tetrapyrrole Biosynthesis". Nature 223 (5211): 1151–1153. Bibcode:1969Natur.223.1151D. PMID 5810686. doi:10.1038/2231151a0.
- ↑ Paul R. Ortiz de Montellano (2008). "Hemes in Biology". Wiley Encyclopedia of Chemical Biology. John Wiley & Sons. ISBN 978-0470048672. doi:10.1002/9780470048672.wecb221.
- ↑ 3,0 3,1 S. Sassa and A. Kappas (2000): "Molecular aspects of the inherited porphyrias". Journal of Internal Medicine, volume 247, número 2, páxinas 169-178. doi 10.1046/j.1365-2796.2000.00618.x
