Hemo C
| Hemo C | |
|---|---|
 | |
| Identificadores | |
| Número CAS | 26598-29-8 |
| PubChem | 444125 |
| MeSH | heme+C |
| Propiedades | |
| Fórmula molecular | C34H36O4N4S2Fe |
| Masa molecular | 684,64904 g/mol |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
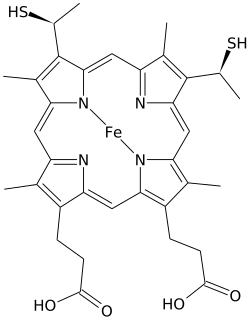
O hemo C é un complexo de coordinación de tipo hemo formado por un átomo de ferro e un anel de porfirina, que se asocia a proteínas.
Historia[editar | editar a fonte]
A estrutura correcta do hemo C publicouna a mediados do século XX o bioquímico sueco K.-G. Paul.[1] O seu traballo confirmou a estrutura que fora inferida previamente polo bioquímico sueco Hugo Theorell. A estrutura do hemo C foi confirmada en 1975 baseándose en experimentos de NMR e IR coa forma reducida, con Fe(II), do hemo.[2] A estrutura do hemo C que incluía a configuración estereoquímica absoluta dos enlaces tioéter presentouse primeiro para a proteína de vertebrados [3] e agora estendeuse a moitas outras proteínas que conteñen o hemo C.
Propiedades[editar | editar a fonte]
O hemo C difire do hemo B en que as dúas cadeas laterais vinilo que ten o hemo B son substituídas por enlaces covalentes tioéter coa apoproteína. Nótese que os dous grupos tiol son cedidos tipicamente por residuos de cisteína da proteína, e así o peso molecular adicional neto do hemo C cando está incorporado na holoproteína[4], coa perda de dous átomos de hidróxeno para formar o enlace, é de 616,5 Da. Estes enlaces non permiten que o hemo C se disocie doadamente da súa holoproteína, o citocromo c, a diferenza do hemo B, que se disocia máis facilmente da súa holoproteína (complexo hemo-proteína), mesmo en condicións suaves. Isto permite que o citocromo c teña variadas estruturas e funcións, e que exista unha gran cantidade de citocromos de tipo c, que funcionan principalmente como transportadores de electróns.
O número de unidades de hemo C unidas á holoproteína é moi variable. Nas células de vertebrados a regra é un hemo por proteína, pero para as bacterias este número é con frecuencia de 2, 4, 5, 6 ou mesmo 16 grupos hemo C por holoproteína. Considérase xeralmente que o número e disposición axeitadas dos grupos hemo C están relacionadas e mesmo son imprescindibles para o correcto funcionamento da holoproteína. Por exemplo, as proteínas que conteñen varios grupos hemo C están implicadas en reaccións de transferencia de electróns múltiples. Especialmente importante é a redución de 6 electróns que se require para reducir o nitróxeno atmosférico a dúas moléculas orgánicas de amoníaco. É común no hemo C que a proporción de aminoácidos sexa máis alta nas hemoproteínas bacterianas, polo que o interior dalgunhas proteínas citocromo c parece ateigado de grupos hemo C en comparación co que ocorre noutras hemoproteínas. Algunhas hemoproteínas, a miúdo de organismos unicelulares, poden conter cinco hemos C.[5] O complexo bc1 é outro importante encima que contén hemos de tipo C.
Os enlaces tioéter parece que permiten unha gran liberdade de funcionamento ás holoproteínas. En xeral, os citocromos de tipo c poden ser "axustados finamente" nun rango máis amplo de potenciais de oxidorredución ca os citocromos b. Isto pode ser unha importante razón que explica por que o citocromo c é case universal en todos os seres vivos. O hemo C xoga tamén un importante papel na apoptose, na que só unhas poucas moléculas de citocromo c citoplásmico que conteñan hemo C poden orixinar a morte celular programada.[6]
Ademais destes enlaces covalentes ecuatoriais, o ferro hémico está tamén xeralmente coordinado coas cadeas laterais de dous aminoácidos, facendo que o ferro estea hexacoordinado. Por exemplo, oc citocromos c de mamíferos e atúns conteñen un só hemo C, que está coordinado axialmente con cadeas laterais de histidina e metionina.[7] Quizais debido aos dous enlaces covalentes que unen o hemo á proteína, o ferro do hemo C está ás veces ligado axialmente ao grupo amino da lisina ou mesmo á auga.
Notas[editar | editar a fonte]
- ↑ Paul, K.G.; Högfeldt, Erik; Sillén, Lars Gunnar; Kinell, Per-Olof (1950). "The splitting with silver salts of the cysteine-porphyrin bonds in cytochrome c". Acta Chemica Scandinavica 4: 239–244. doi:10.3891/acta.chem.scand.04-0239.
- ↑ Caughey, W.S.; et al. (1975). "Heme A of Cytochrome c Oxidase". Journal of Biological Chemistry 250: 7602–7622.
- ↑ Takano T., Trus B.L., Mandel N., Mandel G., Kallai O.B., Swanson R., Dickerson R.E. (1977). "Tuna cytochrome c at 2.0 A resolution. II. Ferrocytochrome structure analysis.". Journal of Biological Chemistry 252: 776–785. PMID 188826.
- ↑ Aquí o termo holoproteína está usado co significado de proteína completa con parte proteica (apoproteína) e parte non proteica (o hemo), que é o seu significado na literatura científica en inglés e máis internacional.
- ↑ Diode or Tunnel-Diode Characteristics? Resolving the Catalytic Consequences of Proton Coupled Electron Transfer in a Multi-Centered Oxidoreductase
- ↑ Bowman, S.E.J., Bren, K.L. (2008). "The chemistry and biochemistry of heme C: functional bases for covalent attachment". Nat. Prod. Rep. 25 (6): 1118–1130. PMC 2654777. PMID 19030605. doi:10.1039/b717196j.
- ↑ Yeh, S.R., Han, S., and Rousseau, D.L. (1998). "Cytochrome c folding and unfolding". Accounts of Chemical Research 31 (11): 727–735. doi:10.1021/ar970084p.
