Osíxeno: Diferenzas entre revisións
m robot Añadido: zh-min-nan:O (goân-sò͘) |
m robot Añadido: uz:Kislorod |
||
| Liña 220: | Liña 220: | ||
[[ug:ئوكسىگېن]] |
[[ug:ئوكسىگېن]] |
||
[[uk:Кисень]] |
[[uk:Кисень]] |
||
[[uz:Kislorod]] |
|||
[[vi:Ôxy]] |
[[vi:Ôxy]] |
||
[[zh:氧]] |
[[zh:氧]] |
||
Revisión como estaba o 8 de setembro de 2006 ás 04:40
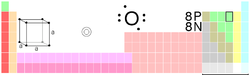
Oitavo elemento da táboa periódica dos elementos, con oito protóns, unha masa media de 16, 8 neutróns e 8 electróns en estado neutro.
O osíxeno é un elemento químico de número atómico 8 e símbolo O. Na súa forma molecular, O2, é un gas a temperatura ambiente. Representa aproximadamente o 20% da composición da atmosfera terrestre. É un dos elementos máis importantes da química orgánica e participa de forma moi importante no ciclo enerxético dos seres vivos, esencial na respiración celular dos organismos aeróbicos. É un gas incoloro, inodoro e insípido. Existe unha forma molecular formada por tres átomos de osíxeno, O3, denominada ozono, cuxa presencia na atmosfera protexe a Terra da incidencia de radiación ultravioleta procedente do Sol.
Un átomo de osíxeno combinado con dous de hidróxeno forman unha molécula de auga.
Características principais
En condicións normais de presión e temperatura, o osíxeno atópase en estado gasoso formando moléculas diatómicas (O2) que, a pesar de ser inestables, se xeran durante a fotosíntese das plantas e son despois usadas polos animais na respiración (ver ciclo do osíxeno).
O osíxeno líquido e sólido ten unha lixeira coloración azulada e nos dous estados é moi paramagnético. O osíxeno líquido obténse correntemente da destilación fraccionada do aire líquido xunto co nitróxeno.
Reacciona coa práctica totalidade dos metais (exceptuando os metais nobles) provocando a corrosión.
Aplicacións
A principal utilización do osíxeno é como oxidante, pola súa elevada electronegatividade, só superada polo fluor, así, por exemplo, úsase osíxeno líquido en motores de propulsión dos foguetes, e nos procesos industriais e no transporte o osíxeno para a combustión tómase direitamente do aire. Outras aplicacións industriais son a soldadura e a fabricación de aceiro e metanol.
A medicina tamén fai uso do osíxeno subministrándoo como suplemento a pacientes con dificultades respiratorias; e empréganse botellas de osíxeno en diversas prácticas deportivas como o submarinismo ou laborais, no caso de acceso a locais cerrados ou escasamente ventilados, con atmosferas contaminadas (limpeza interior de depósitos, traballo en salas de pintura, etc.)
O Osíxeno provoca euforia nas persoas que o inhalan, polo que se ten usado de xeito histórico como divertimento (o que segue a ser válido hoxe en día). No século XIX usouse tamén, misturado con óxido nitroso como analxésico.
Historia
O osíxeno, do grego ὀξύς, ácido, e -xeno, da raíz γεν, xerar, nome doado por Lavoisier en 1774, leva un nome etimolóxicamente erróneo na medida en que hai moitos ácidos que non teñen osíxeno. Descuberto polo boticario sueco Karl Wilhelm Scheele no 1771, pero o seu traballo non tivo recoñecemento inmediato, sendo en ocasións atribuído a Joseph Priestley, que fixo un descubrimento independente o 1 de agosto de 1774.
Abundancia e obtención
É o elemento máis abundante da codia terrestre (arredor dun 46,7%), e dos océanos (arredor do 87% como compoñente da auga) e o segundo na atmosfera (cerca do 20%).
Os óxidos de metais, silicatos (SiO44-) e carbonatos (CO32-) atópanse a miúdo en rochas e chan. Na atmosfera atópase como osíxeno molecular, O2, dióxido de carbono e en menor proporción como monóxido de carbono (CO), ozono (O3), dióxido de nitróxeno (NO2), monóxido de nitróxeno (NO), dióxido de xofre (SO2), etc.
Nos planetas exteriores (máis lonxe do Sol) e en cometas atópase auga xeada e outros compostos de osíxeno, por exemplo, en Marte hai dióxido de carbono xeado. O espectro deste elemento tamén se aprecia con frecuencia nas estrelas.
Compostos
a súa alta electronegatividade fai que reaccione con case calquera elemento químico, agás os gases nobles. O composto máis salientable que forma é a auga (H2O); otros compostos ben coñecidos son o dióxido de carbono, os alcois (R-OH), aldehídos, (R-CHO), e ácidos carboxílicos (R-COOH).
Os radicais clorato (ClO3-), perclorato (ClO4-), cromato (CrO42-), dicromato (Cr2O72-), permanganato (MnO4-) e nitrato (NO3-) son fortes axentes oxidantes. Os Epóxidos son éteres nos cales o átomo de osíxeno forma parte dun anel de tres átomos.
O Ozono (O3) fórmase por descargas eléctricas en presencia de osíxeno molecular (durante as tormentas eléctricas por exemplo). Tense atopado no osíxeno líquido, en pequenas cantidades, unha dobre molécula de osíxeno (O2)2.
Papel biolóxico
O osíxeno respirado polos organismos aerobios, liberado polas plantas mediante a fotosíntese, participa na conversión de nutrientes en enerxía (ATP). A súa diminución provoca hipoxemia, e a falla total del, anoxia que pode provocar a morte do organismo.
Isótopos
O Osíxeno ten tres isótopos estables e dez radioactivos. Os radioisótopos correspondentes teñen unha vida media menor de tres minutos.
Precaucións
O Osíxeno pode ser tóxico a elevadas presións parciais.
Algúns compostos como o ozono, o peróxido de hidróxeno e radicais hidroxilo son moi tóxicos. O corpo humano desenvolveu mecanismos de protección contras estas especies tóxicas. Por exemplo, a glutación actúa como antioxidante, o mesmo que a bilirrubina (un producto derivado do metabolismo da hemoglobina).
As atmosferas ricas en osíxeno en presenza de materiais combustibles son susceptibles de provocar incendios que se propagan con gran rapidez, o mesmo ca explosións. Outro tanto pasa se as fontes de osíxeno son cloratos, percloratos, dicromatos, etc.; estes compostos con alto poder oxidante poden provocar tamén queimaduras químicas.