Tamaño do xenoma

O tamaño do xenoma é a cantidade total de ADN contido nunha soa copia dun xenoma simple completo. Mídese normalmente pola súa masa en picogramos (billonésimas de gramo, 10−12), abreviado pg, ou menos frecuentemente en daltons, ou como o número total de pares de bases de nucleótidos, xeralmente en megabases (millóns de pares de bases, abreviado Mb ou Mbp). Un picogramo equivale a 978 megabases.[1] En organismos diploides, os termos tamaño do xenoma e valor C utilízanse indistintamente.
A complexidade dun organismo non é directamente proporcional ao tamaño do seu xenoma. O contido en ADN total é moi variable entre distintos taxons biolóxicos. Algúns organismos unicelulares teñen moito máis ADN que os humanos, por exemplo, por razóns que aínda non están claras (ver ADN non codificante e enigma do valor C).
Orixe do termo
[editar | editar a fonte]
A creación do termo "tamaño do xenoma" ás veces atribúese erradamente a Ralph Hinegardner, que o utilizou nun artigo en 1976,[2] incluso en discusións que tratan especificamente da terminoloxía deste campo da investigación (por exemplo en Greilhuber 2005[3]). En realidade, Hinegardner[2] usou o termo unha soa vez e foi no título. Porén, o termo parece que apareceu xa en 1968, cando Hinegardner se preguntaba, no último parágrafo doutro artigo, se o contido de ADN celular reflectía realmente o tamaño do xenoma ("cellular DNA content does, in fact, reflect genome size").[4] Nese contexto, "tamaño do xenoma" estivo sendo utilizado no sentido de xenotipo para referirse ao número de xenes dun organismo.
Nun artigo enviado só dous meses despois, Wolf et al. (1969)[5] usaron o termo "tamaño do xenoma" e co seu actual uso; polo que estes autores probablemente deberían ser recoñecidos como os creadores do termo no seu uso moderno. A inicios da década de 1970, "tamaño do xenoma" era xa un termo de uso común e coa súa definición actual, probablemente como resultado da súa inclusión no influínte libro de Susumu Ohno Evolution by Gene Duplication (Evolución por duplicación xénica), publicado en 1970.[6]
Variación no tamaño do xenoma e contido de xenes
[editar | editar a fonte]Coa aparición de varias técnicas moleculares nos pasados 50 anos, puidéronse analizar os tamaños dos xenomas de miles de eucariotas, e estes datos están dispoñibles en bases de datos on line para animais, plantas e fungos (ver as ligazóns externas). O tamaño do xenoma nuclear mídese normalmente en eucariotas usando medidas densitométricas de núcleos tinguidos con Feulgen (anteriormente facíase con densitómetros especializados e agora normalmente por análise de imaxes computarizada[7]) ou ben por medio de citometría de fluxo. En procariotas, os métodos predominantes para determinar o tamaño do xenoma son a electroforese en xel en campo pulsado e a secuenciación de xenomas completos.
Os tamaños dos xenomas nucleares varían enormemente entre as especies eucariotas. En animais as diferenzas entre uns e outros poden alcanzar un factor de máis de 3.000, e en plantas de 1.000.[8][9] Os xenomas dos protistas presentan diferenzas de tamaño que chegan a un factor de máis de 300.000, pero o extremo máis alto deste rango (Amoeba) foi posto en cuestión.[10] En eucariotas (pero non en procariotas), o tamaño do xenoma non é proporcional ao número de xenes presentes no xenoma, unha observación que foi considerada antiintuitiva antes do descubrimento do ADN non codificante e o que se acabou coñecendo como o "paradoxo do valor C". Porén, aínda que hoxe xa non hai ningún aspecto paradoxal entre a discrepancia entre o tamaño do xenoma e o número de xenes, o termo continúa sendo de uso común. Por razóns de claridade conceptual, as varias incógnitas que permanecen sobre a variación no tamaño do xenoma como foi indicado por algún autor constitúen máis ben un crebacabezas ou un enigma, o chamado "enigma do valor C".
O tamaño do xenoma correlaciónase cun rango de características medibles a nivel celular e de organismo, como o tamaño celular, taxa de división celular e, dependendo do taxon, o tamaño corporal, taxa metabólica, taxa de desenvolvemento, complexidade de órganos, distribución xeográfica ou risco de extinción.[8][9] Baseándose nos datos dos xenomas completamente secuenciados (ata abril de 2009), o número de xenes transformado logaritmicamente presenta unha correlación linear co tamaño do xenoma transformado logaritmicamente en bacterias, arqueas, virus e orgánulos combinados, mentres que en eucariotas a correlación é non linear (con logaritmos seminaturais).[11] Aínda que isto último contrasta coa idea previa de que non había correlación nos eucariotas, a correlación non linear observada nos eucariotas pode reflectir o incremento desproporcionadamente rápido de ADN non codificante en xenomas eucariotas cada vez máis grandes. Aínda que os datos de xenomas secuenciados están na práctica nesgados cara a xenomas pequenos, o cal pode comprometer a exactitude da correlación derivada empiricamente, e a proba final da corelación deberá obterse secuenciando algúns dos xenomas eucariotas máis grandes, actualmente os datos non parecen descartar unha posible correlación.
Redución do xenoma
[editar | editar a fonte]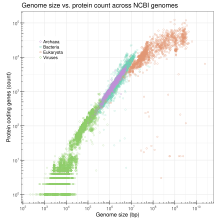
A redución do xenoma, tamén chamada degradación do xenoma, é o proceso polo cal o xenoma dun organismo se reduce en relación co dos seus devanceiros. O tamaño do xenoma flutúa regularmente e a redución do seu tamaño é máis significativo nas bacterias.
Os casos máis significativos evolutivamente de redución do xenoma poden observarse en orgánulos eucariotas que se sabe derivaron de bacterias por endosimbiose: mitocondrias e plastidios. Estes orgánulos descenden dun endosimbionte primordial que podía sobrevivir dentro da célula hóspede e que a célula hóspede tamén necesitaba para sobrevivir. Moitas mitocondrias nos tempos actuais teñen menos de 20 xenes en todo o seu xenoma, mentres que unha bacteria de vida libre adoita ter polo menos 1.000 xenes. Aparentemente, moitos dos xenes perdidos transferíronse ao núcleo celular do hóspede, mentres que outros simplemente se perderon e a súa función foi substituída polos procesos realizados polo hóspede.
Outras bacterias convertéronse en endosimbiontes ou patóxenos intracelulares obrigados e experimentaron como resultado unha ampla redución do xenoma. Este proceso parece estar dominado pola deriva xenética que se produce principalmente debido a un tamaño de poboación pequeno, unhas baixas taxas de recombinación, e altas taxas de mutación. Algunhas especies do bacterioplancto mariñas de vida libre tamén mostran signos de redución do xenoma, que se hipotetiza que son impilsados pola selección natural.[12][13][14]
En especies endosimbióticas obrigadas
[editar | editar a fonte]As especies endosimbiótics obrigadas cracterízanse pola súa completa incapacidade de sobrevivir fóra do seu hóspede. Estas especies convertéronse nunha importante ameaza para os humanos, xa que adoitan poder evadirse da acción do sistema inmunitario e manipulan o ambiente do hóspede para conseguir nutrientes. Unha explicación habitual destas capacidades manipulativas é a súa estrutura xenómica compacta e eficiente. Estes pequenos xenomas son o resultado de perdas masivas de ADN superfluo, algo que está asociado exclusivamente coa perda do seu estadio de vida libre. Cando unha especie fai unha transición evolutiva desde un estilo de vida libre a outro intracelular obrigado pode perder ata o 90% do material xenético. Durante este proceso o futuro parasito esta exposto a un ambiente rico en metabolitos no que dalgún modo necesita agocharse dentro da célula hóspede, e eses factores reducen a retención xénica e incrementan a deriva xenética conducindo a unha aceleración da perda de xenes non esenciais.[15][16][17] Exemplos comúns de especies con xenomas reducidos son Buchnera aphidicola, Rickettsia prowazekii e Mycobacterium leprae. Un endosimbionte obrigado dos insectos cicadélidos, Nasuia deltocephalinicola, ten o menor xenoma coñecido entre os organismos celulares, de só 112 kb.[18] Malia a patoxenicidade da maioría dos endosimbiontes, algunhas especies intracelulares obrigadas teñen efectos positivos sobre a fitness dos seus hóspedes.
Propúxose o modelo de evolución redutiva como un intento de definir as características comúns observadas en todos os endosimbiontes obrigados.[19] Este modelo ilustra catro características xerais das especies con xenomas reducidos e intracelulares obrigadas:
- "optimización do xenoma" resultado da selección relaxada sobre xenes que son superfluos no ambiente intracelular;
- un nesgo cara á aparición de delecións xenéticas (en lugar de insercións), que afectan fortemente a xenes que foron alterados pola acumulación de mutacións (pseudoxenes);[20]
- moi pouca ou ningunha capacidade de adquirir novo ADN; e
- considerable redución do tamaño efectivo de poboación nas poboacións endosimbióticas, particularmente en especies que dependen da transmisión vertical de material xenético.
Baseándose neste modelo, está claro que os endosimbintes enfróntanse a retos adaptativos diferentes aos das especies de vida libre e, como se deduce da análise de diferentes parasitos, os seus repertorios de xenes son extremadamente diferentes, o que nos leva á conclusión de que a miniaturización do xenoma segue un padrón distinto nos diferentes simbiontes.[21][22][23]
Conversión de picogramos (pg) a pares de bases (bp)
[editar | editar a fonte]ou simplemente:
Regra de Drake
[editar | editar a fonte]En 1991, John W. Drake propuxo unha regra xeral: a taxa de mutación dun xenoma e o seu tamaño están inversamente correlacionados.[24] Esta regra considérase aproximadamente correcta para xenomas simples como os dos virus de ADN e organismos unicelulares. O seu fundamento descoñécese.
Propúxose que o pequeno tamaño dos virus de ARN está constrinxido por unha relación tripartita entre a fidelidade de replicación, o tamaño do xenoma e a complexidade xenética. A maioría dos virus de ARN carecen da función de corrección de erros do ARN, que limita a súa fidelidade de replicación e, por tanto, o tamaño do seu xenoma. Isto tamén se denominou "paradoxo de Eigen".[25] Unha excepción á regra do pequeno tamaño xenómico nos virus de ARN encóntrase nos Nidovirus. Estes virus parece que adquiriron unha exorribonuclease 3′-5′ (ExoN) que lles permite un incremento no tamaño xenómico.[26]
Miniaturización do xenoma e tamaño óptimo
[editar | editar a fonte]En 1972 Michael David Bennett[27] presentou a hipótese de que había unha correlación entre o contido de ADN e o volume nuclear mentres que Commoner e van’t Hof e Sparrow antes ca el postularan que incluso o tamaño celular e a lonxitude do ciclo celular estaban controlados pola cantidade de ADN.[28][29] Teorías máis recentes presentaron a discusión da existencia dun mecanismo que constrinxe fisicamente o desenvolvemento do xenoma a un tamaño óptimo.[30]
Esas explicacións foron discutidas nun artigo de Cavalier-Smith[31] no que o autor sinalaba que a maneira de entender a relación entre o tamaño do xenoma e o volume celular estaba relacionada coa teoría esquelética. O núcleo desta teoría está relacionado co volume celular, determinado por unha equilibrio de adaptación entre vantaxes e desvantaxes dun tamaño celular maior, a optimización da razón núcleo:citoplasma (razón carioplasmática)[32][33] e o concepto de que os xenomas máis grandes teñen unha maior tendencia á acumulación de transposóns duplicativos como consecuencias do maior contido do ADN esquelético non codificante.[31] Cavalier-Smith tamén propuxo que, como reacción á redución da célula, o núcleo terá unha maior tendencia á selección en favor da deleción en comparación coa duplicación.[31]
Desde un punto de vista económico para a célula, como o fósforo e a enerxía son escasos, unha redución no ADN debería ser sempre o foco da evolución, a non ser que se consiga un beneficio. A deleción aleatoria será entón principalmente prexudicial e non será seleccionada debido á redución da fitness gañada pero ocasionalmente a eliminación será tamén vantaxosa. Esta solución de compromiso entre a economía e a acumulación de ADN non codificante é a clave do mantemento da razón carioplasmática.
Mecanismos da miniaturización do xenoma
[editar | editar a fonte]A cuestión básica no proceso de miniaturización do xenoma é se ocorre en grandes episodios concretos ou debido a unha constante erosión do contido xénico. Para estimarmos a evolución deste proceso cómpre comparar un xenoma ancestral con outro no que se supón que se produciu a redución. Foi posible esclarecer o mecanismo da miniaturización do xenoma grazas á semellanza entre o contido xénico de Buchnera aphidicola e o da bacteria entérica Escherichia coli, cun 89% de identidade no ADNr de 16S e un 62% para xenes ortólogos.[34] O xenoma do endosimbionte B. aphidicola caracterízase por ter un tamaño que é sete veces menor que o de E. coli (643 kb comparado con 4,6 Mb)[35][36] e pode considerarse un subconxunto do repertorio de xenes das bacterias entéricas.[36] A partir da comparación entre xenomas viuse que algúns xenes persisten en forma parcialmente dexenerada,[36] o que indica que a súa función se perdeu durante o proceso e que os eventos de erosión acurtaron a súa lonxitude como se documentou en Rickettsia.[37][38][39] Esta hipótese está confirmada pola análise dos pseudoxenes de Buchnera, nos cales o número de delecións era máis de dez veces maior comparado co de insercións.[39]
En Rickettsia prowazekii, como noutras bacterias con xenomas pequenos, este endosimbionte mutualista experimentou unha ampla redución da actividade funcional cunha grande excepción comparado con outros parasitos: aínda mantén a capacidade biosintética de produción dos aminoácidos que necesita o seu hóspede.[40][41][36] Os efectos comúns da redución do xenoma entre este endosimbionte e os outros parasitos son a redución da capacidade de producir fosfolípidos, de reparación e recombinación e unha conversión xeral da composición dos xenes cara á unha maior riqueza no contido de A-T[42] debido ás mutacións e substitucións.[15][40] Proba da perda da función de reparación e recombinación é a perda do xene recA, xene implicado na vía da recombinase. Este evento ocorreu durante a eliminación dunha rexión máis grande que contén dez xenes cun total de case 10 kb.[36][40] O mesmo aconteceu cos xenes uvrA, uvrB e uvrC, os cales codifican encimas de excisión implicados na reparación do ADN danado debido á exposición aos raios UV.[34]
Un dos mecanismos máis plausibles para explicar a redución do xenoma é o rearranxo cromosómico porque a inserción/deleción de porcións máis grandes de secuencia é máis fácil que se produza durante a recombinación homóloga comparada coa ilexítima, polo que o espallamento de elementos transpoñibles afectará positivamente á taxa de deleción.[31] A perda destes xenes nos estadios iniciais da miniaturización debe xogar un papel na evolución das delecións. As evidencias de que os eventos maiores de eliminación de xenes ocorreron antes das delecións máis pequenas proceden da comparación do xenoma de Bucknera e o dun antepasado reconstruído, no que os xenes que se perderon non están dispersados aleatoriamente no antepasado senón agregados, e da relación negativa entre o número de xenes perdidos e a lonxitude dos espazadores.[34] O evento de creación de pequenos indeis locais desempeña un papel marxinal na redución do xenoma,[43] especialmente nas etapas iniciais nas que un número maior de xenes se fai superfluo.[44][34]
Os eventos particulares ocorren debido á falta de presión de selección para a retención de xenes, especialmente se se perde parte dunha vía que perde a súa función durante unha deleción previa. Un exemplo disto é a deleción de recF, xene necesario para o funcionamento de recA, e dos xenes que o flanquean.[45] Unha das consecuencias da eliminación de tal cantidade de secuencias afectou mesmo á regulación dos xenes que permanecían. A perda de grandes seccións do xenoma podería de feito conducir á perda de secuencias promotoras. Isto podería empurrar a selección cara á evolución de rexións policistrónicas cun efecto positivo tanto para a redución de tamaño[46] coma para a eficiencia da transcrición.[47]
Probas da minituarización do xenoma
[editar | editar a fonte]Un exemplo da miniaturización do xenoma dáse nos microsporidios, uns parasitos intracelulares anaerobios dos artrópodos que evolucionaron a partir de fungos aeróbicos.
Durante este proceso formouse un orgánulo especial, o mitosoma,[48] como consecuencia de que a mitocondria quedou reducida a un relicto sen xenoma e sen actividade metabólica excepto a produción de centros de ferro-xofre e a capacidade de entrar nas células hóspedes.[49][50] Nestes seres, excepto os ribosomas, tamén miniaturizaos, moitos outros orgánulos acabaron perdéndose durante o proceso da formación do xenoma máis pequeno atopado nos eucariotas.[31] Desde os seus posibles antepasados, uns fungos cigomicotas, os microsporidios reduciron o seu xenoma eliminando case 1.000 xenes e reduciron incluso o tamaño das proteínas e dos xenes codificadores de proteínas.[51] Este proceso extremo foi posible grazas á selección vantaxosa dun tamaño celular menor imposta polo parasitismo.
Outro exemplo de miniaturización está representado pola presenza de nucleomorfos, núcleos escravos, dentro da célula de dúas algas difererntes, criptófitas e cloraracneanas.[52]
Os nucleomorfos caracterízanse por ter un dos xenomas máis pequenos coñecidos (551 e 380 kb) e, como ocore nos microsporidios, algúns xenomas están notablemente reducidos en lonxitude comparados cos doutros eucariotas debido á falta virtualmente total de ADN non codificante.[31] O factor máis interesante é a coexistencia deses pequenos núcleos dentro dunha célula que contén outro núcleo que nunca experimentou tal redución do xenoma. Ademais, mesmo se as céllas hóspedes teñen diferentes volumes en distintas especies e unha consecuente variabilidade no tamaño xenómico, o nucleomorfo permanece invariable, o que denota un dobre efecto de selección dentro da mesma célula.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Dolezel J, Bartoš J, Voglmayr H, Greilhuber J (2003). "Nuclear DNA content and genome size of trout and human". Cytometry Part A 51 (2): 127–128. PMID 12541287. doi:10.1002/cyto.a.10013.
- ↑ 2,0 2,1 Hinegardner R (1976). "Evolution of genome size". En F.J. Ayala. Molecular Evolution. Sinauer Associates, Inc., Sunderland. pp. 179–199.
- ↑ Greilhuber J, Doležel J, Lysák M, Bennett MD (2005). "The origin, evolution and proposed stabilization of the terms 'genome size' and 'C-value' to describe nuclear DNA contents". Annals of Botany 95 (1): 255–260. PMC 4246724. PMID 15596473. doi:10.1093/aob/mci019.
- ↑ Hinegardner R (1968). "Evolution of cellular DNA content in teleost fishes". American Naturalist 102 (928): 517–523. doi:10.1086/282564.
- ↑ Wolf U, Ritter H, Atkin NB, Ohno S (1969). "Polyploidization in the fish family Cyprinidae, Order Cypriniformes. I. DNA-content and chromosome sets in various species of Cyprinidae". Humangenetik 7 (3): 240–244. PMID 5800705. doi:10.1007/BF00273173.
- ↑ Ohno S (1970). Evolution by Gene Duplication. New York: Springer-Verlag. ISBN 0-04-575015-7.
- ↑ Hardie DC, Gregory TR, Hebert PD (2002). "From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry". Journal of Histochemistry and Cytochemistry 50 (6): 735–749. PMID 12019291. doi:10.1177/002215540205000601.
- ↑ 8,0 8,1 Bennett MD, Leitch IJ (2005). "Genome size evolution in plants". En T.R. Gregory. The Evolution of the Genome. San Diego: Elsevier. pp. 89–162.
- ↑ 9,0 9,1 Gregory TR (2005). "Genome size evolution in animals". En T.R. Gregory. The Evolution of the Genome. San Diego: Elsevier. pp. 3–87.
- ↑ McGrath, Casey, L, & Katz, Laura A. (2004). "Genome diversity in microbial eukaryotes". Trends in Ecology & Evolution 19 (1): 32–38. PMID 16701223. doi:10.1016/j.tree.2003.10.007.
- ↑ Hou Y, Lin S (2009). Redfield RJ, ed. "Distinct Gene Number- Genome Size Relationships for Eukaryotes and Non-Eukaryotes: Gene Content Estimation for Dinoflagellate Genomes". PLOS ONE 4 (9): e6978. Bibcode:2009PLoSO...4.6978H. PMC 2737104. PMID 19750009. doi:10.1371/journal.pone.0006978.
- ↑ Dufresne A, Garczarek L, Partensky F (2005). "Accelerated evolution associated with genome reduction in a free-living prokaryote". Genome Biol 6 (2): R14. PMC 551534. PMID 15693943. doi:10.1186/gb-2005-6-2-r14.
- ↑ Giovannoni SJ; et al. (2005). "Genome streamlining in a cosmopolitan oceanic bacterium". Science 309 (5738): 1242–1245. Bibcode:2005Sci...309.1242G. PMID 16109880. doi:10.1126/science.1114057.
- ↑ Giovannoni SJ; et al. (2008). "The small genome of an abundant coastal ocean methylotroph". Environmental Microbiology 10 (7): 1771–1782. PMID 18393994. doi:10.1111/j.1462-2920.2008.01598.x.
- ↑ 15,0 15,1 Moran, N. A. (1996-04-02). "Accelerated evolution and Muller's rachet in endosymbiotic bacteria". Proceedings of the National Academy of Sciences 93 (7): 2873–2878. Bibcode:1996PNAS...93.2873M. ISSN 0027-8424. PMC 39726. PMID 8610134. doi:10.1073/pnas.93.7.2873.
- ↑ Wernegreen, J. J.; Moran, N. A. (1999-01-01). "Evidence for genetic drift in endosymbionts (Buchnera): analyses of protein-coding genes.". Molecular Biology and Evolution 16 (1): 83–97. ISSN 0737-4038. PMID 10331254. doi:10.1093/oxfordjournals.molbev.a026040.
- ↑ Spaulding, Allen W.; Dohlen, Carol D. von (2001). "Psyllid endosymbionts exhibit patterns of co-speciation with hosts and destabilizing substitutions in ribosomal RNA". Insect Molecular Biology 10 (1): 57–67. ISSN 1365-2583. PMID 11240637. doi:10.1046/j.1365-2583.2001.00231.x.
- ↑ "And the Genomes Keep Shrinking…". Arquivado dende o orixinal o 23 de agosto de 2013. Consultado o 23 de decembro de 2021.
- ↑ Wernegreen J (2005). "For better or worse: Genomic consequences of genomic mutualism and parasitism" (PDF). Current Opinion in Genetics & Development 15 (6): 1–12. PMID 16230003. doi:10.1016/j.gde.2005.09.013. Arquivado dende o orixinal (PDF) o 2011-07-22.
- ↑ Moran NA, Plague GR (2004). "Genomic changes following host restriction in bacteria". Current Opinion in Genetics & Development 14 (6): 627–633. PMID 15531157. doi:10.1016/j.gde.2004.09.003.
- ↑ Mushegian, A. R.; Koonin, E. V. (1996-09-17). "A minimal gene set for cellular life derived by comparison of complete bacterial genomes.". Proceedings of the National Academy of Sciences 93 (19): 10268–10273. Bibcode:1996PNAS...9310268M. ISSN 0027-8424. PMC 38373. PMID 8816789. doi:10.1073/pnas.93.19.10268.
- ↑ Huynen, Martijn A.; Bork, Peer (1998-05-26). "Measuring genome evolution". Proceedings of the National Academy of Sciences 95 (11): 5849–5856. Bibcode:1998PNAS...95.5849H. ISSN 0027-8424. PMC 34486. PMID 9600883. doi:10.1073/pnas.95.11.5849.
- ↑ Maniloff, J (1996-09-17). "The minimal cell genome: "on being the right size".". Proceedings of the National Academy of Sciences of the United States of America 93 (19): 10004–10006. Bibcode:1996PNAS...9310004M. ISSN 0027-8424. PMC 38325. PMID 8816738. doi:10.1073/pnas.93.19.10004.
- ↑ Drake, J W (1991). "A constant rate of spontaneous mutation in DNA-based microbes". Proc Natl Acad Sci USA 88 (16): 7160–7164. Bibcode:1991PNAS...88.7160D. PMC 52253. PMID 1831267. doi:10.1073/pnas.88.16.7160.
- ↑ Kun, A; Santos, M; Szathmary, E (2005). "Real ribozymes suggest a relaxed error threshold". Nat Genet 37 (9): 1008–1011. PMID 16127452. doi:10.1038/ng1621.
- ↑ Lauber, C; Goeman, JJ; Parquet Mdel, C; Thi Nga, P; Snijder, EJ; Morita, K; Gorbalenya, AE (Jul 2013). "The footprint of genome architecture in the largest genome expansion in RNA viruses". PLOS Pathog 9 (7): e1003500. PMC 3715407. PMID 23874204. doi:10.1371/journal.ppat.1003500.
- ↑ Bennett, Michael David; Riley, Ralph (1972-06-06). "Nuclear DNA content and minimum generation time in herbaceous plants". Proceedings of the Royal Society of London. Series B. Biological Sciences 181 (1063): 109–135. Bibcode:1972RSPSB.181..109B. PMID 4403285. doi:10.1098/rspb.1972.0042.
- ↑ Hof, J. Van't; Sparrow, A. H. (June 1963). "A relationship between DNA content, nuclear volume, and minimum mitotic cycle time". Proceedings of the National Academy of Sciences of the United States of America 49 (6): 897–902. Bibcode:1963PNAS...49..897V. ISSN 0027-8424. PMC 300029. PMID 13996145. doi:10.1073/pnas.49.6.897.
- ↑ Commoner, Barry (June 1964). "Roles Of Deoxyribonucleic Acid in Inheritance". Nature 202 (4936): 960–968. Bibcode:1964Natur.202..960C. ISSN 1476-4687. PMID 14197326. doi:10.1038/202960a0.
- ↑ Orgel, L. E.; Crick, F. H. C. (April 1980). "Selfish DNA: the ultimate parasite". Nature 284 (5757): 604–607. Bibcode:1980Natur.284..604O. ISSN 1476-4687. PMID 7366731. doi:10.1038/284604a0.
- ↑ 31,0 31,1 31,2 31,3 31,4 31,5 Cavalier-Smith, Thomas (2005-01-01). "Economy, Speed and Size Matter: Evolutionary Forces Driving Nuclear Genome Miniaturization and Expansion". Annals of Botany 95 (1): 147–175. ISSN 0305-7364. PMC 4246715. PMID 15596464. doi:10.1093/aob/mci010.
- ↑ Strasburger, Eduard (1893). Ueber die wirkungssphäre der Kerne und die Zellgrösse. (en alemán). OCLC 80359142.
- ↑ Huxley, J. S. (May 1925). "The Cell in Development and Heredity". Nature 115 (2897): 669–671. Bibcode:1925Natur.115..669H. ISSN 1476-4687. doi:10.1038/115669a0.
- ↑ 34,0 34,1 34,2 34,3 Moran, Nancy A.; Mira, Alex (2001-11-14). "The process of genome shrinkage in the obligate symbiont Buchnera aphidicola". Genome Biology 2 (12): research0054.1. ISSN 1474-760X. PMC 64839. PMID 11790257. doi:10.1186/gb-2001-2-12-research0054.
- ↑ Blattner, Frederick R.; Plunkett, Guy; Bloch, Craig A.; Perna, Nicole T.; Burland, Valerie; Riley, Monica; Collado-Vides, Julio; Glasner, Jeremy D.; Rode, Christopher K.; Mayhew, George F.; Gregor, Jason (1997-09-05). "The Complete Genome Sequence of Escherichia coli K-12". Science 277 (5331): 1453–1462. ISSN 0036-8075. PMID 9278503. doi:10.1126/science.277.5331.1453.
- ↑ 36,0 36,1 36,2 36,3 36,4 Shigenobu, Shuji; Watanabe, Hidemi; Hattori, Masahira; Sakaki, Yoshiyuki; Ishikawa, Hajime (September 2000). "Genome sequence of the endocellular bacterial symbiont of aphids Buchnera sp. APS". Nature 407 (6800): 81–86. Bibcode:2000Natur.407...81S. ISSN 1476-4687. PMID 10993077. doi:10.1038/35024074.
- ↑ Andersson, J. O.; Andersson, S. G. (1999-09-01). "Genome degradation is an ongoing process in Rickettsia.". Molecular Biology and Evolution 16 (9): 1178–1191. ISSN 0737-4038. PMID 10486973. doi:10.1093/oxfordjournals.molbev.a026208.
- ↑ Andersson, Jan O.; Andersson, Siv G. E. (2001-05-01). "Pseudogenes, Junk DNA, and the Dynamics of Rickettsia Genomes". Molecular Biology and Evolution 18 (5): 829–839. ISSN 0737-4038. PMID 11319266. doi:10.1093/oxfordjournals.molbev.a003864.
- ↑ 39,0 39,1 Mira, Alex; Ochman, Howard; Moran, Nancy A. (2001-10-01). "Deletional bias and the evolution of bacterial genomes". Trends in Genetics 17 (10): 589–596. ISSN 0168-9525. PMID 11585665. doi:10.1016/S0168-9525(01)02447-7.
- ↑ 40,0 40,1 40,2 Andersson, Siv G. E.; Zomorodipour, Alireza; Andersson, Jan O.; Sicheritz-Pontén, Thomas; Alsmark, U. Cecilia M.; Podowski, Raf M.; Näslund, A. Kristina; Eriksson, Ann-Sofie; Winkler, Herbert H.; Kurland, Charles G. (November 1998). "The genome sequence of Rickettsia prowazekii and the origin of mitochondria". Nature 396 (6707): 133–140. Bibcode:1998Natur.396..133A. ISSN 1476-4687. PMID 9823893. doi:10.1038/24094.
- ↑ Tamas, Ivica; Klasson, Lisa M.; Sandström, Jonas P.; Andersson, Siv G. E. (2001). "Mutualists and parasites: how to paint yourself into a (metabolic) corner". FEBS Letters 498 (2–3): 135–139. ISSN 1873-3468. PMID 11412844. doi:10.1016/S0014-5793(01)02459-0.
- ↑ Wernegreen, J. J.; Moran, N. A. (2000-07-22). "Decay of mutualistic potential in aphid endosymbionts through silencing of biosynthetic loci: Buchnera of Diuraphis". Proceedings of the Royal Society of London. Series B: Biological Sciences 267 (1451): 1423–1431. PMC 1690690. PMID 10983826. doi:10.1098/rspb.2000.1159.
- ↑ Petrov, Dmitri A. (2002-06-01). "Mutational Equilibrium Model of Genome Size Evolution". Theoretical Population Biology 61 (4): 531–544. ISSN 0040-5809. PMID 12167373. doi:10.1006/tpbi.2002.1605.
- ↑ Gregory, T. Ryan (2003-09-01). "Is small indel bias a determinant of genome size?". Trends in Genetics 19 (9): 485–488. ISSN 0168-9525. PMID 12957541. doi:10.1016/S0168-9525(03)00192-6.
- ↑ Gasior, Stephen L.; Olivares, Heidi; Ear, Uy; Hari, Danielle M.; Weichselbaum, Ralph; Bishop, Douglas K. (2001-07-17). "Assembly of RecA-like recombinases: Distinct roles for mediator proteins in mitosis and meiosis". Proceedings of the National Academy of Sciences 98 (15): 8411–8418. Bibcode:2001PNAS...98.8411G. ISSN 0027-8424. PMC 37451. PMID 11459983. doi:10.1073/pnas.121046198.
- ↑ Selosse, M.-A.; Albert, B.; Godelle, B. (2001-03-01). "Reducing the genome size of organelles favours gene transfer to the nucleus". Trends in Ecology & Evolution 16 (3): 135–141. ISSN 1872-8383. PMID 11179577. doi:10.1016/s0169-5347(00)02084-x.
- ↑ Scherbakov, D. V.; Garber, M. B. (2000-07-01). "Overlapping genes in bacterial and phage genomes". Molecular Biology 34 (4): 485–495. ISSN 1608-3245. doi:10.1007/BF02759558.
- ↑ Williams, Bryony A. P.; Hirt, Robert P.; Lucocq, John M.; Embley, T. Martin (August 2002). "A mitochondrial remnant in the microsporidian Trachipleistophora hominis". Nature 418 (6900): 865–869. Bibcode:2002Natur.418..865W. ISSN 1476-4687. PMID 12192407. doi:10.1038/nature00949.
- ↑ Keeling, Patrick J.; Fast, Naomi M. (2002). "Microsporidia: Biology and Evolution of Highly Reduced Intracellular Parasites". Annual Review of Microbiology 56 (1): 93–116. PMID 12142484. doi:10.1146/annurev.micro.56.012302.160854.
- ↑ Cavalier-Smith, T. (2001). "What are Fungi?". En McLaughlin, David J.; McLaughlin, Esther G.; Lemke, Paul A. Systematics and Evolution. Systematics and Evolution: Part A. The Mycota (Springer Berlin Heidelberg). pp. 3–37. ISBN 978-3-662-10376-0. doi:10.1007/978-3-662-10376-0_1.
- ↑ Vivarès, Christian P; Gouy, Manolo; Thomarat, Fabienne; Méténier, Guy (2002-10-01). "Functional and evolutionary analysis of a eukaryotic parasitic genome". Current Opinion in Microbiology 5 (5): 499–505. ISSN 1369-5274. PMID 12354558. doi:10.1016/S1369-5274(02)00356-9.
- ↑ Douglas, Susan; Zauner, Stefan; Fraunholz, Martin; Beaton, Margaret; Penny, Susanne; Deng, Lang-Tuo; Wu, Xiaonan; Reith, Michael; Cavalier-Smith, Thomas; Maier, Uwe-G. (April 2001). "The highly reduced genome of an enslaved algal nucleus". Nature 410 (6832): 1091–1096. Bibcode:2001Natur.410.1091D. ISSN 1476-4687. PMID 11323671. doi:10.1038/35074092.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Evolution of Chlamydiaceae
- Andersson JO Andersson SG; Andersson (1999). "Genome degradation is an ongoing process in Rickettsia". Molecular Biology and Evolution 16 (9): 1178–1191. PMID 10486973. doi:10.1093/oxfordjournals.molbev.a026208. Arquivado dende o orixinal o 17/04/2005. Consultado o 23/12/2021.
Ligazóns externas
[editar | editar a fonte]- Animal Genome Size Database
- Plant DNA C-values Database Arquivado 10 de marzo de 2019 en Wayback Machine.
- Fungal Genome Size Database
- Fungal Database Arquivado 10 de marzo de 2008 en Wayback Machine. — do CBS


