Vacina de ARNm

Unha vacina de ARNm é un tipo de vacina que usa unha copia dunha molécula de ARN mensaxeiro (ARNm ou mRNA) para producir unha resposta inmune.[1] A vacina entrega moléculas dun ARNm que codifica un antíxeno ás células inmunitarias, as cales usan o ARNm deseñado como molde para construír unha proteína allea ao organismo, que normalmente sería producida por un patóxeno infeccioso (como, por exemplo, un virus) ou por unha célula cancerosa. Estas moléculas de proteínas estimulan unha resposta inmunitaria adaptativa que ensina ao corpo a identificar e destruír o patóxeno correspondente ou as células cancerosas.[1] O ARNm é entregado no interior do corpo por unha coformulación do ARN encapsulado en nanopartículas lipídicas que protexen as febras de ARN e axudan á súa absorción nas células.[2][3]
A reactoxenicidade, a tendencia dunha vacina a producir reaccións adversas, é similar á das vacinas convencionais non de ARN.[4] As persoas susceptibles a ter unha resposta autoinmune poden ter unha reacción adversa ás vacinas de ARN mensaxeiro.[4] As vantaxes das vacinas de ARNm sobre as vacinas tradicionais son as seguintes: a facilidade para deseñalas, a velocidade e baixo custo de produción, a indución de inmunidade celular e humoral e a falta de interacción co ADN xenómico.[5][6] Aínda que algunhas vacinas de ARN mensaxeiro, como a vacina da COVID-19 de Pfizer–BioNTech, teñen a desvantaxe de necesitar almacenamento ultrafrío antes da súa distribución;[1] outras vacinas de ARNm, como a de Moderna, CureVac e Walvax, non teñen esa necesidade.[7][8]
Na terapéutica de ARN as vacinas de ARN mensaxeiro espertaron un considerable interese, como as vacinas da COVID-19.[1] En decembro de 2020, Pfizer–BioNTech e Moderna obtiveron autorización para as súas vacinas da COVID-19 baseadas no ARNm. O 2 de decembro, a Axencia Reguladora de Medicinas e produtos Sanitarios (MHRA) do Reino Unido foi o primeiro regulador de medicamentos que aprobou a vacina de ARNm, autorizando o uso xeral da vacina de Pfizer–BioNTech.[9][10][11] O 11 de decembro, a Administración de Medicinas e Alimentos (FDA) dos Estados Unidos emitiu unha autorización de uso de emerxencia para a vacina de Pfizer–BioNTech[12][13] e unha semana despois autorizou tamén a vacina de Moderna.[14][15]
Historia
[editar | editar a fonte]Primeiras investigacións
[editar | editar a fonte]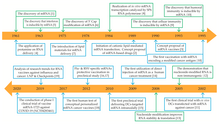
A primeira transfección con éxito de ARNm empaquetado dentro dunha nanopartícula liposómica nunha célula publicouse en 1989.[16][17] O ARNm "espido" (ou non protexido) feito no laboratorio inxectouse un ano máis tarde no músculo de ratos.[3][18] Estes estudos foron a primeira proba de que o ARNm transcrito in vitro cun xene elixido podía entregar a información xenética para producir unha proteína desexada dentro dun tecido celular vivo[3] e iso levou á proposta conceptual das vacinas de ARNm.[19][20][21]
En 1993 observouse que o ARNm encapsulado en liposomas que codifica un antíxeno estimulaba células T en ratos.[22][23] Ao ano seguinte desenvolveuse o ARNm autoamplificante ao incluír un xene dun antíxeno viral e un xene que codificaba unha replicase.[22][24] O método foi utilizado en ratos tanto para provocar respostas inmunitarias humorais coma celulares contra un patóxeno viral.[22] Ao ano seguinte observouse que un ARNm que codificaba un antíxeno tumoral orixinaba unha resposta inmunitaria similar contra as células cancerosas en ratos.[25][26]
Desenvolvemento
[editar | editar a fonte]O primeiro ensaio clínico en humanos no que se usaban células dendríticas ex vivo transfectadas con ARNm que codificaba antíxenos tumorais (vacina de ARNm do cancro terapéutica) empezou en 2001.[27][28] Catro anos despois, informouse do uso con éxito de nucleósidos modificados como método par transportar ARNm ao interior de células sen activar o sistema de defensa do corpo.[27][29] Os resultados dos ensaios clínicos dunha vacina de ARNm inxectada directamente no corpo contra células tumorais publicáronse en 2008.[30][31]
BioNTech en 2008 e Moderna en 2010 fundáronse para desenvolver biotecnoloxías de ARNm.[32][33] A axencia de investigación dos Estados Unidos DARPA lanzou nesa época un programa de investigación biotecnolóxica chamado ADEPT para desenvolver as tecnoloxías emerxentes para o exército dos Estados Unidos.[34][35] A axencia recoñeceu o potencial da tecnoloxía dos ácidos nucleicos para a defensa contra pandemias e empezou a investir neste eido.[34] Os investimentos de DARPA foron vistos como un voto de confianza nesta tecnoloxía que, á súa vez, animou outras axencias gobernamentais e investidores privados a investir na tecnoloxía do ARNm.[35] DARPA concedeu nesa época unha subvención de 25 millóns de dólares a Moderna.[36]
Os primeiros ensaios clínicos humanos usando unha vacina de ARNm contra un axente infeccioso (da rabia) empezou en 2013.[37][38] Nos seguintes anos comezaron os ensaios clínicos de vacinas de ARNm para outros varios virus. As vacinas de ARNm para uso humano foron estudadas para axentes infecciosos como os virus da influenza,[39] virus Zika, citomegalovirus e virus Chikungunya.[40][41]
En marzo de 2022 Moderna anunciou o desenvolvemento de vacinas de ARNm para 15 doenzas, que eran: Chikungunya, COVID-19, febre hemorráxica de Crimea-Congo, dengue, ébola, VIH/SIDA, malaria, enfermidade do virus Marburg, febre de Lassa, coronavirus relacionado coa MERS (MERS-CoV), infección polo virus Nipah e henipavirus, febre do Val do Rift, febre grave con síndrome de trombocitopenia, tuberculose e febre de Zika.[42][43]
Aceleración
[editar | editar a fonte]A pandemia de COVID-19 e a secuenciación do virus causante SARS-CoV-2 a principios de 2020, levou a un rápido desenvolvemento das primeiras vacinas de ARNm aprobadas.[44][45] BioNTech e Moderna en decembro dese mesmo ano obtiveron a aprobación das súas vacinas da COVID-19 baseadas en ARNm. O 2 de decembro, sete días despois do seu ensaio final de oito semanas, a Axencia Regulatoria de Medicinas e produtos Sanitarios do Reino Unido (MHRA) converteuse no primeiro regulador de medicinas global en aprobar unha vacina de ARNm, outorgando unha autorización de emerxencia para a vacina da COVID-19 de Pfizer–BioNTech BNT162b2 para o seu uso xeral.[9][10][46] O 11 de decembro, a FDA nos Estados Unidos deu unha autorización de emerxencia para a vacina da COVID.19 de Pfizer–BioNTech e unha semana despois unha aprobación similar para a vacina de Moderna.[47] Outras vacinas de ARNm continúan desenvolvéndose.
Mecanismo
[editar | editar a fonte]- Véxase tamén: Sistema inmunitario.

O obxectivo dunha vacina é estimular o sistema inmunitario adaptativo para crear anticorpos que se unan con precisión a un determinado patóxeno. Os marcadores presentes no patóxeno ao que se unen os anticorpos son os antíxenos.[48]
As vacinas tradicionais estimulan unha resposta de anticorpos ao inxectar no corpo antíxenos, un microorganismo ou virus atenuado (debilitado), un virus inactivado, ou un vector viral recombinante que codifica un antíxeno (virus portador inofensivo cun transxene que codifica o antíxeno). Estes antíxenos e virus son preparados e cultivados fóra do corpo.[49][50]
A diferenza das anteriores, as vacinas de ARNm introducen un fragmento de curta vida[51] creado sinteticamente da secuencia de ARNm dun virus na persoa que vai ser vacinada. Estes fragmentos de ARNm son captados polas células dendríticas por medio da fagocitose.[52] As células dendríticas usan a súa maquinaria interna (ribosomas) para ler o ARNm e producir os antíxenos virais que codifica o ARNm.[4] O corpo degrada os fragmentos de ARNm en poucos días despois da súa introdución.[53] Aínda que as células non inmunes poden potencialmente absorber o ARNm da vacina, producir antíxenos e expoñelos na súa superficie, as células dendríticas absorben glóbulos de ARNm moito máis doadamente.[54] Os fragmentos de ARNm son trasladados ao citoplasma e non afectan o ADN xenómico do corpo, localizado separadamente no núcleo celular.[1][55]
Unha vez que a célula hóspede produce os antíxenos virais, comezan os procesos normais do sistema inmunitario adaptativo. Os antíxenos son rotos en cachos polos proteasomas. Despois as moléculas do complexo maior de histocompatibilidade (MHC) de clase I e II únense ao antíxeno e transpórtano á membrana plasmática, "activando" as células dendríticas.[55] Unha vez activadas, as células dendríticas migran aos ganglios linfáticos, onde presentan o antíxeno a células T e B.[56] Isto desencadea a produción de anticorpos especificamente afíns ao antíxeno, ao cal se unirán, o que finalmente ten como resultado a inmunidade a ese antíxeno.[48]
ARNm
[editar | editar a fonte]
O compoñente central dunha vacina de ARNm é o seu construto de ARNm.[57] O ARNm transcrito in vitro xérase a partir dun ADN de plásmido preparado por enxeñaría xenética, que ten un promotor da ARN polimerase e unha secuencia que corresponde á do construto de ARNm. Combinando a ARN polimerase do fago T7 e o ADN do plásmido, o ARNm pode ser transcrito no laboratorio. A eficacia da vacina depende da estabilidade e estrutura do ARNm deseñado.[4]
O ARNm transcrito in vitro ten os mesmos compoñentes estruturais que o ARNm natural en células eucariotas. Ten unha carapucha 5' (5' cap), unha rexión non traducida 5' (5' UTR) e outra 3'-UTR, un marco de lectura aberto (ORF), que codifica o antíxeno relevante, e unha cola 3'-poli(A). Modificando estes compoñentes do ARNm sintético, poden potenciarse a estabilidade e a capacidade traducional do ARNm e, á súa vez, mellora a eficacia da vacina.[57]
O ARNm pode mellorarse usando análogos sintéticos da 5'-cap, o cal aumenta a estabilidade e incrementa a tradución da proteína. De xeito similar, poden alterarse os elementos regulatorios nas rexións non traducidas 5' e 3', e a lonxitude da cola poli(A) é optimizada, para estabilizar o ARNm e incrementar a produción de proteínas. Os nucleótidos do ARNm poden ser modificados para á vez diminuír a activación da inmunidade innata e incrementar a vida media do ARNm na célula hóspede. A secuencia de ácido nucleico e o uso dos codóns inflúe na tradución da proteína. Enriquecendo a secuencia con contido en guanina-citosina mellora a estabilidade e vida media do ARNm e, á súa vez, a produción da proteína. Tamén mellora a produción de proteínas a substitución de codóns raros por codóns sinónimos usados frecuentemente pola célula hóspede.[4]
Entrega da vacina no interior do corpo
[editar | editar a fonte]
Para que unha vacina teña éxito debe entrar suficiente ARNm no citoplasma da célula hóspede para estimular a produción de antíxenos específicos. Porén, a entrada de moléculas de ARNm enfróntase a diversas dificultades. Non só son moléculas de ARNm demasiado grandes para cruzar a membrana plasmática por difusión simple, están tamén cargadas negativamente, igual que a membrana plasmática, o que causa unha mutua repulsión electrostática. Ademais, o ARNm é degradado doadamente polas RNAases na pel e no sangue.[55]
Desenvolvéronse varios métodos para superar estes obstáculas na entrega. Os métodos de entrega de vacinas poden ser clasificados segundo se o ARNm se transfire ás células dentro do organismo (in vivo) ou fóra del (ex vivo).[55][3]
Ex vivo
[editar | editar a fonte]As células dendríticas mostran os antíxenos na súa superficie, o que facilita a súa interacción coas células T para iniciar unha resposta inmune. As células dendríticas poden extraerse de pacientes e programarse co ARNm desexado, despois son administradas de novo aos pacientes para crear unha resposta inmune.[58]
A maneira máis simple de que as células dendríticas ex vivo capten moléculas de ARNm é por endocitose, unha vía bastante ineficiente, que no laboratorio pode mellorarse significativamente por electroporación.[55]
In vivo
[editar | editar a fonte]Desde o descubrimento de que a administración directa de ARNm transcrito in vitro leva á expresión de antíenos no corpo, estiveron investigándose as estratexias de entrega in vivo.[18] Ofrecen algunhas vantaxes sobre os métodos ex vivo, especialmente ao evitaren o custo de recoller e adaptar as células dendríticas dos pacientes e ao imitaren unha infección regular.[55]
Diferentes rutas de inxección, como a intradérmica, intravenosa ou intramuscular, teñen como resultado varios niveis de captación de ARNm, o que fai que a ruta de administración sexa un aspecto crítico da entrega in vivo. Un estudo que comparaba diferentes rutas mostrou que a inxección nun ganglio linfático orixina a maior resposta de células T.[59]
Inxección de ARNm espido
[editar | editar a fonte]A inxección de ARNm espido significa que a entrega da vacina só se fai nunha solución tampón.[60] Este modo de captación de ARNm coñécese desde a década de 1990.[18] Os primeiros estudos clínicos no mundo usaron a inxección intradérmica de ARNm espido para a vacinación.[61][62] Utilizouse unha variedade de métodos para entregar ARNm espido, como as inxeccións subcutáneas, intravenosas e intratumorais. Aínda que a entrega de ARNm espido causa unha resposta inmune, o efecto é relativamente débil, e despois da inxección o ARNm adoita degradarse rapidamente.[55]
Vectores de polímeros e péptidos
[editar | editar a fonte]Poden mesturrse co ARNm polímeros catiónicos para así xerar cubertas protectoras chamadas poliplexos. Estes protexen o ARNm recombinante das ribonucleases e axudan á súa penetración nas células. A protamina é un péptido catiónico natural que foi utilizado para encapsular o ARNm para a vacinación.[63][64]
Vector de nanopartícula lipídica
[editar | editar a fonte]
A primeira vez que a FDA aprobou o uso de nanopartículas lipídicas como sistema de entrega de fármacos foi en 2018, cando a axencia aprobou o primeiro fármaco de ARN interferente pequeno, chamado Onpattro.[65] Encapsular a molécula de ARNm en nanopartículas lipídicas foi un adianto esencial para producir ARNm viable, atopando solucións a varias barreiras técnicas clave na entrega da molécula de ARNm á célula hóspede.[65][66] A investigación sobre o uso de lípidos para entregar ARN interferente pequeno a células converteuse nos alicerces de investigacións similares sobre o uso de lípidos para a entrega de ARNm.[67] Porén, debían de inventarse novos lípidos para encapsular as febras de ARN mensaxeiro, que son moito máis longos que as febras de ARN interferente pequeno.[67]
Principalmente, o lípido proporciona unha capa de protección contra a degradación, permitindo un rendemento traducional máis robusto. Ademais, a personalización da capa externa lipídica permite seleccionar como obxectivos os tipos de células desexadas por interaccións con ligandos. No entanto, moitos estudos tamén salientaron a dificultade de estudar este tipo de entrega, demostrando que hai unha inconsistencia entre as aplicacións in vivo e in vitro de nanopartículas en canto á captación celular.[68] As nanopartículas poden administrarse no copo e ser transportadas por diferentes rutas, como intravenosa ou a través do sistema linfático.[65]
Un asunto coas nanopartículas lipídicas é que varios dos logros que levaron ao uso práctico desa tecnoloxía implican o uso de microfluídica. As cámaras de reacción microfluídica son difíciles de escalar, xa que o punto clave da microfluídica é aproveitar os comportamentos a microescala de lípidos. O único modo de sortear este obstáculo é utilizar un amplo número de cámaras de reacción microfluídica en paralelo, unha tarefa nova que require un equipo a medida.[69][70] Para as vacinas de ARNm da COVID-19 esta foi o principal colo de botella na produción. Pfizer usou a estratexia do funcionamento en paralelo para resolver o problema da escala. Despois de verificar que os mesturadores de chorros de impacto (impingement jet mixers) non podían escalarse directamente,[71] Pfizer preparou uns 100 pequenos mesturadores (cada un deles do tamaño aproximado dunha moeda de medio dólar, conectounos por medio de bombas e filtros cun "labirinto de bombeo,"[72][73] e instalou un sistema de computadoras para regular o fluxo e a presión a través dos mesturadores.[71]
Outro problema co uso deste método de entrega a grande escala é a dispoñibilidade dos novos lípidos usados para crear nanopartículas lipídicas, especialmente lípidos catiónicos ionizables. Antes de 2020, eses lípidos eran fabricados en pequenas cantidades que se medían en gramos ou quilogramos, e que se usaban para a investigación médica e un feixe de fármacos para tratar condicións raras. Como a seguridade e eficacia das vacinas de ARNm estaba xa clara en 2020, as poucas empresas capaces de fabricar os lípidos neesarios tiveron que enfrontarse co cambio de escala na produción para responder aos pedidos de varias toneladas deses lípidos.[70][74]
Vector viral
[editar | editar a fonte]- Véxase tamén: Vacina de vector viral.
Ademais dos métodos de entega non viral, foron alterados por enxeñaría virus de ARN para conseguir respostas inmunolóxicas similares. Os virus de ARN típicos usados como vectores inclúen os retrovirus, lentivirus, alfavirus e rabdovirus, cada un dos cales pode diferir en estrutura e función.[75] Tales virus utilizáronse en estudos clínicos sobre diversas doenzas en animais modelos como o rato, polo e primates.[76][77][78]
Vantaxes
[editar | editar a fonte]Vacinas tradicionais
[editar | editar a fonte]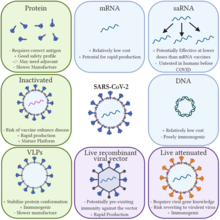
As vacinas de ARNm ofrecen vantaxes específicas sobre as vacinas tradicionais.[4][5] Como as vacinas de ARNm non se constrúen a partir dun patóxeno activo (nin inactivado), non son infecciosas. En contraste, as vacinas tradicionais requiren a produción de patóxenos, que, se se fan en grandes volumes, poderían incrementar o risco de gromos localizados do virus nas instalacións de produción.[5] Outra vantaxe biolóxica das vacinas de ARNm é que como os antíxenos se producen na célula, estimulan a inmunidade celular xunto coa inmunidade humoral.[6][79]
As vacinas de ARNm teñen a vantaxe de produción de que poden deseñarse rapidamente. Moderna deseñou a súa vacina mRNA-1273 para a COVID-19 en dous días.[80] Poden tamén fabricarse máis rápido, máis barato e de modo máis estandarizado (cunha baixa taxa de erros na produción), o cal pode mellorar a capacidade de resposta a gromos graves.[4][5]
A vacina de Pfizer–BioNTech necesitou orixinalmente 110 días para a súa produción masiva (antes Pfizer empezou a optimizar o proceso de fabricación en só 60 días), o cal era substancialmente máis rápido que nas vacinas tradiconais da gripe e polio.[72] Nese marco temporal maior o tempo de produción real é de só uns 22 días: dúas semanas para a clonación molecular dos plásmidos de ADN e purificación do ADN, catro días para a transcrición de ADN a ARN e purificación do ARNm, e catro días para encapsular o ARNm en nanopartículss lipídicas seguido do enchido e acabado (encher os viais e empaquetar).[81] A maioría dos días que cómpren para cada lote de produción son empregados en rigorosos controis de calidade en cada etapa.[72]
Vacinas de ADN
[editar | editar a fonte]Ademais de compartiren as vantaxes das vacinas de ADN teóricas sobre as vacinas tradicionais, as vacinas de ARNm teñen tamén vantaxes adicionais sobre as vacinas de ADN. O ARNm é traducido no citosol, así que non hai necesidade de que o ARN entre no núcleo celular, e evítase o risco de que sexa integrado no xenoma do hóspede.[3] Os nucleósidos modificados (por exemplo, as pseudouridinas, nucleósidos 2'-O-metilados) poden incorporarse ao ARNm para suprimir a estimulación da resposta inmune para evitar a degradación inmediata e producir un efecto máis persistente pola mellora da capacidade de tradución.[29][82][83] O marco de lectura aberto (ORF) e as rexións non traducidas (UTR) do ARNm poden ser optimizadas para diferentes propósitos (un proceso chamado enxeñería de secuencia de ARNm), por exemplo polo enriquecemento do contido en guanina-citosina ou elixindo UTRs específicas que se sabe incrementan a tradución.[52] Pode engadirse un ORF adicional que codifique un mecanismo de replicación do ARN para amplificar a tradución do antíxeno e, por tanto, a resposta inmune, diminuíndo a cantidade de material de partida necesario.[84][85]
Desvantaxes
[editar | editar a fonte]Almacenamento
[editar | editar a fonte]Como o ARNm é fráxil, algunhas vacinas deben gardarse a temperturas moi baixas para evitar a súa degradación, o que daría pouca inmunidade efectiva ao receptor. A vacina de ARNm de Pfizer–BioNTech's BNT162b2 debe conservarse entre os −80 e os −60 °C.[86][87] Moderna di que a súa vacina mRNA-1273 pode almacenarse entre os −25 e −15 °C,[88] o cal é comparable coas temperaturas dun conxelador doméstico,[87] e que permanece estable entre 2 e 8 °C por 30 días.[88][89] En novembro de 2020, Nature informou de que "aínda que é posible que as diferenzas nas formulacións de LNPs [(nanopartículas lipídicas)] ou estruturas secundarias do ARNm poidan explicar as diferenzas en termoestabilidade [entre as vacinas de Moderna e BioNtech], moitos expertos sospeitan que ambas as vacinas finalmente demostrarán ter necesidades de almacenamento e vidas útiles similares en varias condicións de temperatura."[79] Están a estudarse varias plataformas que poden permitir o almacenamento a temperturas máis altas.[4]
Autorización
[editar | editar a fonte]Antes de 2020, non fora autorizada ningunha plataforma de tecnoloxía de ARNm (fármaco ou vacina) para o seu uso en humanos, así que había un risco de que se presentasen efectos descoñecidos.[79] A pandemia de COVID-19 de 2020 requiría unha capacidade de produción máis rápida das vacinas de ARNm, facéndoas atractivas ás organizacións sanitarias nacionais, e isto abriu o debate sobre o tipo de autorización inicial que deberían ter as vacinas de ARNm (como a autorización de uso de emerxencia ou a autorización de acceso ampliado) pasado do período de oito semanas despois dos ensaios finais en humanos.[90][91] Finalmente, recibiron a autorización para uso de emerxencia.[14][12]
Efectos colaterais
[editar | editar a fonte]A reactoxenicidade é similar á das vacinas convencionais non de ARNm. Porén, as persoas susceptibles a unha resposta inmune poden ter reaccións adversas ás vacinas de ARNm.[4] As febras de ARNm nas vacinas poden orixinar unha reacción inmune non pretendida. Para minimizar isto, as secuencias de ARNm en vacinas de ARNm deséñanse para imitar as producidas polas células de mamífero.[5]
Informouse de efectos reactoxénicos fortes pero transitorios en ensaios de novas vacinas de ARNm para a COVID-19; porén, a maioría da xente non experimenta efectos colaterais graves, que consistiron principalmente en febre e fatiga. Os efectos colaterias graves defínense como aqueles que impiden a actividade diaria.[92]
Eficacia
[editar | editar a fonte]As vacinas de ARNm da COVID-19 de Moderna e Pfizer–BioNTech teñen taxas de eficacia do 90 a 95 %. Anteriores ensaios de fármacos de ARNm para outros patóxenos distintos do virus da COVID-19 non foran efectivos e tiveran que abandonarse nas fases iniciais dos ensaios. A razón da eficacia das novas vacinas de ARNm non está clara.[93]
A científica Margaret A. Liu sinalou que a eficacia das novas vacinas de ARNm da COVID-19 podería deberse ao "gran volume de recursos" que se puxeron en desenvolvemento, ou a que as vacinas poderían estar "desencadeando unha resposta inflamatoria non específica ao ARNm que podería estar intensificando a súa resposta inmune específica, dado que a técnica dos nucleósidos modificados reducía a inflamación pero non a eliminaba completamente", e que "isto tamén pode explicar as intensas reaccións como dores e febres das que se informou nalgúns receptores das vacinas de ARNm para o SARS-CoV-2". Estas reaccións, aínda que graves, eran transitorias, e outra posibilidade é que se trate dunha reacción ás moléculas lipídicas usadas para administrar o fármaco.[93]
Desinformación
[editar | editar a fonte]Espallouse moita desinformación sobre que as vacinas de ARNm poderían alterar o ADN nuclear.[94] O ARNm no citosol é rapidamente degradado antes de que teña tempo de chegar ao núcleo. De feito, as vacinas de ARNm deben almacenarse a temperaturas moi baixas e libres de RNAses para impedir a degradación do ARNm. Os retrovirus poden ser de ARN monocatenario (igual que o son moitas das vacinas contra o SARS-CoV-2), o cal entra no núcleo celular e usa unha reversotranscriptase para producir ADN a partir do ARN no núcleo. Un retrovirus ten mecanismos para a súa importación ao núcleo, pero outros ARNm (como os das vacinas) carecen deses mecanismos. Unha vez dentro do núcleo, a creación de ADN a partir de ARN non podía ocorrer sen reversotranscriptases e cebadores ou primers axeitados, os cales acompañan ambos o retrovirus, pero que non están presentes noutros ARNm exóxenos (como os das vacinas) incluso no caso de que puidesen entar no núcleo.[95]
Amplificación
[editar | editar a fonte]As vacinas de ARNm usan ARNm non amplificante (convencional) ou ARNm autoamplificante.[96] As vacinas de Pfizer–BioNTech e Moderna usan ARNm non amplificado. A investigación continúa sobre ambos os tipos de ARNm como métodos para facer vacinas contra outros posibles patóxenos e cancros.[30]
Non amplificante
[editar | editar a fonte]
As vacinas de ARNm iniciais usaban un construto de ARNm non amplificante.[64] O ARNm non amplificante ten soamente un marco de lectura aberto que codifica o antíxeno de interese.[96] A cantidade total de ARNm dispoñible pola célula é igual á cantidade entregada pola vacina. A forza da dose está limitada pola cantidade de ARNm que pode ser entregada pola vacina.[97] As vacinas non amplificantes substitúen a uridina por N1-metilpseudouridina nun intento de reducir a toxicidade.[98]
Autoamplificante
[editar | editar a fonte]As vacinas de ARNm autoamplificante (en inglés saRNA) replican o seu ARNm despois da transfección.[99] O ARNm autoamplificante ten dous marcos de lectura abertos. O primeiro marco, como o ARNm convencional, codifica o antíxeno de interese. O segundo marco codifica unha ARN polimerase ARN dependente (e as súas proteínas axudantes) que replica o construtro de ARNm na célula. Isto permite administrar doses de vacina menores.[99] Os mecanismos e consecuentemente a avaliación do ARNm autoamplificante poden ser diferentes, xa que o ARNm autoamplificante é unha molécula moito maior.[3] As vacinas de ARN autoamplificante están investigándose para aplicalas contra a malaria.[100] Gritstone bio empezou en 2021 un ensaio en fase 1 dunha vacina de ARN autoamplificante para a COVID-19, usada como unha vacina de reforzo (booster). A vacina está deseñada para tomar como diana tanto a proteína da espícula do coronavirus SARS-CoV-2 coma as proteínas virais que teñen menos tendencia á variación xenética, para proporcionar unha maior protección contra as variants do SARS‑CoV‑2.[101][102] As vacinas de ARN autoamplificante deben usar uridina, que é necesaria para que poida producirse a replicación.[98]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 1,3 1,4 Park KS, Sun X, Aikins ME, Moon JJ (decembro de 2020). "Non-viral COVID-19 vaccine delivery systems". Advanced Drug Delivery Reviews 169: 137–51. PMC 7744276. PMID 33340620. doi:10.1016/j.addr.2020.12.008.
- ↑ Kowalski PS, Rudra A, Miao L, Anderson DG (abril de 2019). "Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery". Mol Ther 27 (4): 710–28. PMC 6453548. PMID 30846391. doi:10.1016/j.ymthe.2019.02.012.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 Verbeke R, Lentacker I, De Smedt SC, Dewitte H (outubro de 2019). "Three decades of messenger RNA vaccine development". Nano Today 28: 100766. doi:10.1016/j.nantod.2019.100766. hdl:1854/LU-8628303. Arquivado dende o orixinal o 11 de xaneiro de 2021. Consultado o 8 de decembro de 2020.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 Pardi N, Hogan MJ, Porter FW, Weissman D (abril de 2018). "mRNA vaccines — a new era in vaccinology". Nature Reviews Drug Discovery 17 (4): 261–279. ISSN 1474-1784. PMC 5906799. PMID 29326426. doi:10.1038/nrd.2017.243.
- ↑ 5,0 5,1 5,2 5,3 5,4 PHG Foundation (2019). "RNA vaccines: an introduction". University of Cambridge. Arquivado dende o orixinal o 6 de decembro de 2018. Consultado o 18 de novembro de 2020.
- ↑ 6,0 6,1 Kramps T, Elders K (2017). "Introduction to RNA Vaccines". RNA Vaccines: Methods and Protocols. Methods in Molecular Biology 1499. pp. 1–11. ISBN 978-1-4939-6479-6. PMID 27987140. doi:10.1007/978-1-4939-6481-9_1.
- ↑ Crommelin DJ, Anchordoquy TJ, Volkin DB, Jiskoot W, Mastrobattista E (marzo de 2021). "Addressing the Cold Reality of mRNA Vaccine Stability". Journal of Pharmaceutical Sciences 110 (3): 997–1001. ISSN 0022-3549. PMC 7834447. PMID 33321139. doi:10.1016/j.xphs.2020.12.006.
- ↑ "Mexico to start late-stage clinical trial for China's mRNA COVID-19 vaccine". Reuters. 11 de maio de 2021. Arquivado dende o orixinal o 23 de agosto de 2021. Consultado o 19 de agosto de 2021.
- ↑ 9,0 9,1 "UK authorises Pfizer/BioNTech COVID-19 vaccine" (Nota de prensa). Department of Health and Social Care. 2 de decembro de 2020. Arquivado dende o orixinal o 2 de decembro de 2020. Consultado o 2 de decembro de 2020.
- ↑ 10,0 10,1 Boseley S, Halliday J (2 de decembro de 2020). "UK approves Pfizer/BioNTech Covid vaccine for rollout next week". The Guardian. Arquivado dende o orixinal o 2 de decembro de 2020. Consultado o 2 de decembro de 2020.
- ↑ "Conditions of Authorisation for Pfizer/BioNTech COVID-19 Vaccine" (Decision). Medicines & Healthcare Products Regulatory Agency. 8 de decembro de 2020. Arquivado dende o orixinal o 7 de decembro de 2020. Consultado o 10 de decembro de 2020.
- ↑ 12,0 12,1 "FDA Takes Key Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for First COVID-19 Vaccine". U.S. Food and Drug Administration (FDA) (Nota de prensa). 11 de decembro de 2020. Arquivado dende o orixinal o 31 de xaneiro de 2021. Consultado o 6 de febreiro de 2021.
- ↑ Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (decembro de 2020). "The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Pfizer-BioNTech COVID-19 Vaccine – United States, December 2020" (PDF). MMWR Morb Mortal Wkly Rep 69 (50): 1922–24. PMC 7745957. PMID 33332292. doi:10.15585/mmwr.mm6950e2. Arquivado dende o orixinal (PDF) o 19 de decembro de 2020. Consultado o 7 de febreiro de 2021.
- ↑ 14,0 14,1 "FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine". U.S. Food and Drug Administration (FDA) (Nota de prensa). 18 de decembro de 2020. Arquivado dende o orixinal o 19 de decembro de 2020. Consultado o 21 de decembro de 2020.
- ↑ Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (xaneiro de 2021). "The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Moderna COVID-19 Vaccine – United States, December 2020" (PDF). MMWR Morb Mortal Wkly Rep 69 (5152): 1653–56. PMC 9191904. PMID 33382675. doi:10.15585/mmwr.mm695152e1. Arquivado dende o orixinal (PDF) o 9 de febreiro de 2021. Consultado o 7 de febreiro de 2021.
- ↑ Xu S, Yang K, Li R, Zhang L (setembro de 2020). "mRNA Vaccine Era-Mechanisms, Drug Platform and Clinical Prospection". International Journal of Molecular Sciences 21 (18): 6582. PMC 7554980. PMID 32916818. doi:10.3390/ijms21186582 //www.ncbi.nlm.nih.gov/pmc/articles/PMC7554980
|PMC=sen título (Axuda).Initiation of cationic lipid-mediated mrna transfection; Concept proposal of mRNA-based drugs
- ↑ Malone RW, Felgner PL, Verma IM (agosto de 1989). "Cationic liposome-mediated RNA transfection". Proceedings of the National Academy of Sciences of the United States of America 86 (16): 6077–81. Bibcode:1989PNAS...86.6077M. PMC 297778. PMID 2762315. doi:10.1073/pnas.86.16.6077 //www.ncbi.nlm.nih.gov/pmc/articles/PMC297778
|PMC=sen título (Axuda). - ↑ 18,0 18,1 18,2 Wolff JA, Malone RW, Williams P, Chong W, Acsadi G, Jani A, Felgner PL (marzo de 1990). "Direct gene transfer into mouse muscle in vivo". Science 247 (4949 Pt 1): 1465–8. Bibcode:1990Sci...247.1465W. PMID 1690918. doi:10.1126/science.1690918.
- ↑ May M (31 de maio de 2021). "After COVID-19 successes, researchers push to develop mRNA vaccines for other diseases". Nature. Arquivado dende o orixinal o 13 de outubro de 2021. Consultado o 31 de xullo de 2021.
Cando se estaban testando a ampla variedade de vacinas contra a COVID-19 en ensaios clínicos, só uns poucos expertos esperaban que a tecnoloxía non probada do ARNm fose a estrela. En 10 meses, as vacinas de ARNm eran tanto as primeiras en ser aprobadas coma as máis efectivas. Aínda que estas son as primeiras vacinas de ARNm que se aprobaron, a historia das vacinas de ARNm empeza hai máis de 30 anos, con moitas fochas na estrada por diante. En 1990, o último científico físico Jon Wolff e os seus colegas da Universidade de Wisconsin inxectaron ARNm en ratos, que causou que as células do rato producisen as proteínas codificadas. En moitos aspectos, ese traballo serviu como un primeiro paso cara a facer unha vacina a partir de ARNm, pero había un longo camiño que percorrer, e aínda o hai, para moitas aplicacións.
- ↑ Xu S, Yang K, Li R, Zhang L (setembro de 2020). "mRNA Vaccine Era-Mechanisms, Drug Platform and Clinical Prospection". International Journal of Molecular Sciences 21 (18): 6582. PMC 7554980. PMID 32916818. doi:10.3390/ijms21186582 //www.ncbi.nlm.nih.gov/pmc/articles/PMC7554980
|PMC=sen título (Axuda).Concept proposal of mRNA vaccines (1990)
- ↑ Patent: WO1990011092 Arquivado 14 de outubro de 2021 en Wayback Machine.; Inventors: Philip L. Felgner, Jon Asher Wolff, Gary H. Rhodes, Robert Wallace Malone, Dennis A. Carson; Assignees: Vical Inc., Wisconsin Alumni Research Foundation; Title: "Expression of Exogenous Polynucleotide Sequences in a Vertebrate Arquivado 9 de decembro de 2021 en Wayback Machine."; (Cita: "O presente invento relaciónase coa introdución de secuencias de ADN e ARN espidas nun vertebrado para conseguir a expresión controlada dun polipéptido. É útil en terapia xénica, vacinación e en calquera situación terapéutica na cal un polipéptido debería administrarse a células in vivo"; Exemplo 8: vacinación de ARNm de ratos para producir a proteína gpl20 do VIH); Data de prioridade: 21 de marzo de 1989; data de publicación: 4 de outubro de 1990.
- ↑ 22,0 22,1 22,2 Pascolo S (agosto de 2004). "Messenger RNA-based vaccines". Expert Opinion on Biological Therapy 4 (8): 1285–94. PMID 15268662. doi:10.1517/14712598.4.8.1285.
- ↑ Martinon F, Krishnan S, Lenzen G, Magné R, Gomard E, Guillet JG, et al. (xullo de 1993). "Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA". European Journal of Immunology 23 (7): 1719–22. PMID 8325342. doi:10.1002/eji.1830230749.
- ↑ Zhou X, Berglund P, Rhodes G, Parker SE, Jondal M, Liljeström P (decembro de 1994). "Self-replicating Semliki Forest virus RNA as recombinant vaccine". Vaccine 12 (16): 1510–14. PMID 7879415. doi:10.1016/0264-410x(94)90074-4.
- ↑ Kallen KJ, Theß A (xaneiro de 2014). "A development that may evolve into a revolution in medicine: mRNA as the basis for novel, nucleotide-based vaccines and drugs". Therapeutic Advances in Vaccines 2 (1): 10–31. PMC 3991152. PMID 24757523. doi:10.1177/2051013613508729.
- ↑ Conry RM, LoBuglio AF, Wright M, Sumerel L, Pike MJ, Johanning F, et al. (abril de 1995). "Characterization of a messenger RNA polynucleotide vaccine vector". Cancer Research 55 (7): 1397–400. PMID 7882341.
- ↑ 27,0 27,1 Sahin U, Karikó K, Türeci Ö (outubro de 2014). "mRNA-based therapeutics — developing a new class of drugs". Nature Reviews Drug Discovery 13 (10): 759–80. ISSN 1474-1784. PMID 25233993. doi:10.1038/nrd4278.
- ↑ Heiser A, Coleman D, Dannull J, Yancey D, Maurice MA, Lallas CD, et al. (febreiro de 2002). "Autologous dendritic cells transfected with prostate-specific antigen RNA stimulate CTL responses against metastatic prostate tumors". The Journal of Clinical Investigation 109 (3): 409–17. ISSN 0021-9738. PMC 150859. PMID 11828001. doi:10.1172/JCI14364.
- ↑ 29,0 29,1 Karikó K, Buckstein M, Ni H, Weissman D (agosto de 2005). "Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA". Immunity 23 (2): 165–75. PMID 16111635. doi:10.1016/j.immuni.2005.06.008.
- ↑ 30,0 30,1 Blakney AK, Ip S, Geall AJ (xaneiro de 2021). "An Update on Self-Amplifying mRNA Vaccine Development". Vaccines 9 (2): 97. PMC 7911542. PMID 33525396. doi:10.3390/vaccines9020097 //www.ncbi.nlm.nih.gov/pmc/articles/PMC7911542
|PMC=sen título (Axuda). - ↑ Weide B, Carralot JP, Reese A, Scheel B, Eigentler TK, Hoerr I, et al. (febreiro-marzo de 2008). "Results of the first phase I/II clinical vaccination trial with direct injection of mRNA". Journal of Immunotherapy 31 (2): 180–8. PMID 18481387. doi:10.1097/CJI.0b013e31815ce501.
- ↑ "BioNTech's founders: scientist couple in global spotlight". France 24. 13 de novembro de 2020. Arquivado dende o orixinal o 14 de febreiro de 2021. Consultado o 31 de xullo de 2021.
- ↑ Garade D (10 de novembro de 2020). "The story of mRNA: How a once-dismissed idea became a leading technology in the Covid vaccine race". Stat. Arquivado dende o orixinal o 10 de novembro de 2020. Consultado o 16 de novembro de 2020.
- ↑ 34,0 34,1 Sonne P (30 de xullo de 2020). "How a secretive Pentagon agency seeded the ground for a rapid coronavirus cure". The Washington Post. Arquivado dende o orixinal o 2 de agosto de 2021. Consultado o 21 de xuño de 2021.
- ↑ 35,0 35,1 Usdin S (19 de marzo de 2020). "DARPA's gambles might have created the best hopes for stopping COVID-19". BioCentury. Arquivado dende o orixinal o 18 de xuño de 2021. Consultado o 19 de xuño de 2021.
- ↑ "DARPA Awards Moderna Therapeutics A Grant For Up To $25 Million To Develop Messenger RNA Therapeutics" (Nota de prensa). 2 de outubro de 2013. Arquivado dende o orixinal o 2 de xuño de 2021. Consultado o 31 de maio de 2021.
- ↑ Dolgin E (setembro de 2021). "The tangled history of mRNA vaccines". Nature 597 (7876): 318–24. Bibcode:2021Natur.597..318D. ISSN 0028-0836. PMID 34522017. doi:10.1038/d41586-021-02483-w.
- ↑ Alberer M, Gnad-Vogt U, Hong HS, Mehr KT, Backert L, Finak G, et al. (setembro de 2017). "Safety and immunogenicity of a mRNA rabies vaccine in healthy adults: an open-label, non-randomised, prospective, first-in-human phase 1 clinical trial". The Lancet 390 (10101): 1511–20. PMID 28754494. doi:10.1016/S0140-6736(17)31665-3.
- ↑ Dolgin E (novembro de 2021). "mRNA flu shots move into trials". Nature Reviews Drug Discovery 20 (11): 801–3. PMID 34635829. doi:10.1038/d41573-021-00176-7.
- ↑ Hou X, Zaks T, Langer R, Dong Y (agosto de 2021). "Lipid nanoparticles for mRNA delivery". Nature Reviews Materials 6 (12): 1078–94. Bibcode:2021NatRM...6.1078H. ISSN 2058-8437. PMC 8353930. PMID 34394960. doi:10.1038/s41578-021-00358-0 //www.ncbi.nlm.nih.gov/pmc/articles/PMC8353930
|PMC=sen título (Axuda). - ↑ "COVID-19 and Your Health". Centers for Disease Control and Prevention. 11 de febreiro de 2020. Arquivado dende o orixinal o 3 de marzo de 2021. Consultado o 26 de novembro de 2020.
- ↑ "Moderna Announces Its Global Public Health Strategy". investors.modernatx.com (en inglés). Arquivado dende o orixinal o 16 de marzo de 2022. Consultado o 15 de marzo de 2022.
- ↑ Steenhuysen, Julie; Erman, Michael (8 de marzo de 2022). "Moderna plots vaccines against 15 pathogens with future pandemic potential". Reuters (en inglés). Arquivado dende o orixinal o 14 de marzo de 2022. Consultado o 15 de marzo de 2022.
- ↑ Ball P (xaneiro de 2021). "The lightning-fast quest for COVID vaccines — and what it means for other diseases". Nature 589 (7840): 16–18. Bibcode:2021Natur.589...16B. PMID 33340018. doi:10.1038/d41586-020-03626-1.
- ↑ Wherry EJ, Jaffee EM, Warren N, D'Souza G, Ribas A (abril de 2021). "How Did We Get a COVID-19 Vaccine in Less Than 1 Year?". Clinical Cancer Research 27 (8): 2136–38. ISSN 1078-0432. PMC 8052930. PMID 33542081. doi:10.1158/1078-0432.CCR-21-0079.
- ↑ Roberts M (2 decembro de 2020). "Covid Pfizer vaccine approved for use next week in UK". BBC News. Arquivado dende o orixinal o 2 de decembro de 2020. Consultado o 2 de decembro de 2020.
- ↑ Office of the Commissioner (18 de decembro de 2020). "Pfizer-BioNTech COVID-19 Vaccine". FDA. Arquivado dende o orixinal o 14 de xaneiro de 2021. Consultado o 21 de decembro de 2020.
- ↑ 48,0 48,1 Batty CJ, Heise MT, Bachelder EM, Ainslie KM (decembro de 2020). "Vaccine formulations in clinical development for the prevention of severe acute respiratory syndrome coronavirus 2 infection". Advanced Drug Delivery Reviews 169: 168–89. PMC 7733686. PMID 33316346. doi:10.1016/j.addr.2020.12.006.
- ↑ Kyriakidis NC, López-Cortés A, González EV, Grimaldos AB, Prado EO (febreiro de 2021). "SARS-CoV-2 vaccines strategies: a comprehensive review of phase 3 candidates". npj Vaccines 6 (1): 28. PMC 7900244. PMID 33619260. doi:10.1038/s41541-021-00292-w.
- ↑ Bull JJ, Nuismer SL, Antia R (xullo de 2019). "Recombinant vector vaccine evolution". PLOS Computational Biology 15 (7): e1006857. Bibcode:2019PLSCB..15E6857B. PMC 6668849. PMID 31323032. doi:10.1371/journal.pcbi.1006857.
- ↑ Hajj KA, Whitehead KA (setembro de 2017). "Tools for translation: non-viral materials for therapeutic mRNA delivery". Nature Reviews Materials 2 (10): 17056. Bibcode:2017NatRM...217056H. doi:10.1038/natrevmats.2017.56.
- ↑ 52,0 52,1 Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ (novembro de 2012). "Developing mRNA-vaccine technologies". RNA Biology 9 (11): 1319–30. PMC 3597572. PMID 23064118. doi:10.4161/rna.22269.
- ↑ Anand P, Stahel VP (maio de 2021). "Review the safety of Covid-19 mRNA vaccines: a review". Patient Safety in Surgery 15 (1): 20. PMC 8087878. PMID 33933145. doi:10.1186/s13037-021-00291-9.
- ↑ Goldman B (22 de decembro de 2020). "How do the new COVID-19 vaccines work?". Scope. Stanford Medicine. Arquivado dende o orixinal o 30 de xaneiro de 2021. Consultado o 28 de xaneiro de 2021.
- ↑ 55,0 55,1 55,2 55,3 55,4 55,5 55,6 Xu S, Yang K, Li R, Zhang L (setembro de 2020). "mRNA Vaccine Era—Mechanisms, Drug Platform and Clinical Prospection". International Journal of Molecular Sciences 21 (18): 6582. PMC 7554980. PMID 32916818. doi:10.3390/ijms21186582 //www.ncbi.nlm.nih.gov/pmc/articles/PMC7554980
|PMC=sen título (Axuda). - ↑ Fiedler K, Lazzaro S, Lutz J, Rauch S, Heidenreich R (2016). "mRNA Cancer Vaccines". Recent Results in Cancer Research. Fortschritte der Krebsforschung. Progres dans les Recherches Sur le Cancer. Recent Results in Cancer Research 209: 61–85. ISBN 978-3-319-42932-8. PMID 28101688. doi:10.1007/978-3-319-42934-2_5.
- ↑ 57,0 57,1 Jackson NA, Kester KE, Casimiro D, Gurunathan S, DeRosa F (febreiro de 2020). "The promise of mRNA vaccines: a biotech and industrial perspective". npj Vaccines 5 (1): 11. ISSN 2059-0105. PMC 7000814. PMID 32047656. doi:10.1038/s41541-020-0159-8.
- ↑ Benteyn D, Heirman C, Bonehill A, Thielemans K, Breckpot K (febreiro de 2015). "mRNA-based dendritic cell vaccines". Expert Review of Vaccines 14 (2): 161–76. PMID 25196947. doi:10.1586/14760584.2014.957684.
- ↑ Kreiter S, Selmi A, Diken M, Koslowski M, Britten CM, Huber C, et al. (novembro de 2010). "Intranodal vaccination with naked antigen-encoding RNA elicits potent prophylactic and therapeutic antitumoral immunity". Cancer Research 70 (22): 9031–40. PMID 21045153. doi:10.1158/0008-5472.can-10-0699.
- ↑ "Vaccine components". Immunisation Advisory Centre. 22 de setembro de 2016. Arquivado dende o orixinal o 26 de xsneiro de 2021. Consultado o 20 de decembro de 2020.
- ↑ Probst J, Weide B, Scheel B, Pichler BJ, Hoerr I, Rammensee HG, Pascolo S (agosto de 2007). "Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependent". Gene Therapy 14 (15): 1175–80. PMID 17476302. doi:10.1038/sj.gt.3302964.
- ↑ Lorenz C, Fotin-Mleczek M, Roth G, Becker C, Dam TC, Verdurmen WP, et al. (xullo de 2011). "Protein expression from exogenous mRNA: uptake by receptor-mediated endocytosis and trafficking via the lysosomal pathway". RNA Biology 8 (4): 627–36. PMID 21654214. doi:10.4161/rna.8.4.15394.
- ↑ Weide B, Pascolo S, Scheel B, Derhovanessian E, Pflugfelder A, Eigentler TK, et al. (xuño de 2009). "Direct injection of protamine-protected mRNA: results of a phase 1/2 vaccination trial in metastatic melanoma patients". Journal of Immunotherapy 32 (5): 498–507. PMID 19609242. doi:10.1097/CJI.0b013e3181a00068.
- ↑ 64,0 64,1 Wang Y, Zhang Z, Luo J, Han X, Wei Y, Wei X (febreiro de 2021). "mRNA vaccine: a potential therapeutic strategy". Molecular Cancer 20 (1): 33. PMC 7884263. PMID 33593376. doi:10.1186/s12943-021-01311-z.
- ↑ 65,0 65,1 65,2 Cooney E (1 de decembro de 2020). "How nanotechnology helps mRNA Covid-19 vaccines work". Stat. Arquivado dende o orixinal o 1 de decembro de 2020. Consultado o 3 de decembro de 2020.
- ↑ Reichmuth AM, Oberli MA, Jaklenec A, Langer R, Blankschtein D (maio de 2016). "mRNA vaccine delivery using lipid nanoparticles". Therapeutic Delivery 7 (5): 319–34. PMC 5439223. PMID 27075952. doi:10.4155/tde-2016-0006.
- ↑ 67,0 67,1 Cross R (6 de marzo de 2021). "Without these lipid shells, there would be no mRNA vaccines for COVID-19". Chemical & Engineering News (American Chemical Society). Arquivado dende o orixinal o 5 de marzo de 2021. Consultado o 6 de marzo de 2021.
- ↑ Paunovska K, Sago CD, Monaco CM, Hudson WH, Castro MG, Rudoltz TG, et al. (marzo de 2018). "A Direct Comparison of in Vitro and in Vivo Nucleic Acid Delivery Mediated by Hundreds of Nanoparticles Reveals a Weak Correlation". Nano Letters 18 (3): 2148–57. Bibcode:2018NanoL..18.2148P. PMC 6054134. PMID 29489381. doi:10.1021/acs.nanolett.8b00432.
- ↑ Lowe D (3 de febreiro de 2021). "Opinion: A straightforward explanation why more COVID-19 vaccines can't be produced with help from 'dozens' of companies". MarketWatch. Arquivado dende o orixinal o 5 de febreiro de 2021. Consultado o 5 de febreiro de 2021.
- ↑ 70,0 70,1 King A (23 de marzo de 2021). "Why manufacturing Covid vaccines at scale is hard". Chemistry World (Royal Society of Chemistry). Arquivado dende o orixinal o 24 de marzo de 2021. Consultado o 26 de marzo de 2021.
- ↑ 71,0 71,1 Sealy A (2 de abril de 2021). "Manufacturing moonshot: How Pfizer makes its millions of Covid-19 vaccine doses". CNN. Arquivado dende o orixinal o 1 de abril de 2021. Consultado o 3 de abril de 2021.
- ↑ 72,0 72,1 72,2 Weise E, Weintraub K (7 de febreiro de 2021). "Race to the Vaccine: A COVID-19 vaccine life cycle: from DNA to doses". USA Today (Gannett). Arquivado dende o orixinal o 25 de febreiro de 2021. Consultado o 24 de febreiro de 2021.
- ↑ Hopkins JS, Eastwood J, Moriarty D (3 de marzo de 2021). "mRNA Covid-19 Vaccines Are Fast to Make, but Hard to Scale". The Wall Street Journal. Arquivado dende o orixinal o 4 de abril de 2021. Consultado o 3 de abril de 2021.
- ↑ Rowland C (18 de febreiro de 2021). "Why grandparents can't find vaccines: Scarcity of niche biotech ingredients". The Washington Post. Arquivado dende o orixinal o 26 de febreiro de 2021. Consultado o 7 de marzo de 2021.
- ↑ Lundstrom K (marzo de 2019). "RNA Viruses as Tools in Gene Therapy and Vaccine Development". Genes 10 (3): 189. PMC 6471356. PMID 30832256. doi:10.3390/genes10030189.
- ↑ Huang TT, Parab S, Burnett R, Diago O, Ostertag D, Hofman FM, et al. (febreiro de 2015). "Intravenous administration of retroviral replicating vector, Toca 511, demonstrates therapeutic efficacy in orthotopic immune-competent mouse glioma model". Human Gene Therapy 26 (2): 82–93. PMC 4326030. PMID 25419577. doi:10.1089/hum.2014.100.
- ↑ Schultz-Cherry S, Dybing JK, Davis NL, Williamson C, Suarez DL, Johnston R, Perdue ML (decembro de 2000). "Influenza virus (A/HK/156/97) hemagglutinin expressed by an alphavirus replicon system protects chickens against lethal infection with Hong Kong-origin H5N1 viruses". Virology 278 (1): 55–59. PMID 11112481. doi:10.1006/viro.2000.0635.
- ↑ Geisbert TW, Feldmann H (novembro de 2011). "Recombinant vesicular stomatitis virus-based vaccines against Ebola and Marburg virus infections". The Journal of Infectious Diseases 204 (Suppl 3): S1075–81. PMC 3218670. PMID 21987744. doi:10.1093/infdis/jir349.
- ↑ 79,0 79,1 79,2 Dolgin E (novembro de 2020). "COVID-19 vaccines poised for launch, but impact on pandemic unclear". Nature Biotechnology. PMID 33239758. doi:10.1038/d41587-020-00022-y.
- ↑ Neilson S, Dunn A, Bendix A (26 de novembro de 2020). "Moderna's groundbreaking coronavirus vaccine was designed in just 2 days". Business Insider. Arquivado dende o orixinal o 11 de xaneiro de 2021. Consultado o 28 de novembro de 2020.
- ↑ Rabson M (27 de febreiro de 2021). "From science to syringe: COVID-19 vaccines are miracles of science and supply chains". CTV News (Bell Media). Arquivado dende o orixinal o 27 de febreiro de 2021. Consultado o 28 de febreiro de 2021.
- ↑ Karikó K, Muramatsu H, Ludwig J, Weissman D (novembro de 2011). "Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA". Nucleic Acids Research 39 (21): e142. PMC 3241667. PMID 21890902. doi:10.1093/nar/gkr695.
- ↑ Pardi N, Weissman D (17 de decembro de 2016). "Nucleoside Modified mRNA Vaccines for Infectious Diseases". RNA Vaccines. Methods in Molecular Biology 1499. Springer New York. pp. 109–21. ISBN 978-1-4939-6479-6. PMID 27987145. doi:10.1007/978-1-4939-6481-9_6.
- ↑ Berglund P, Smerdou C, Fleeton MN, Tubulekas I, Liljeström P (xuño de 1998). "Enhancing immune responses using suicidal DNA vaccines". Nature Biotechnology 16 (6): 562–65. PMID 9624688. doi:10.1038/nbt0698-562.
- ↑ Vogel AB, Lambert L, Kinnear E, Busse D, Erbar S, Reuter KC, et al. (febreiro de 2018). "Self-Amplifying RNA Vaccines Give Equivalent Protection against Influenza to mRNA Vaccines but at Much Lower Doses". Molecular Therapy 26 (2): 446–55. PMC 5835025. PMID 29275847. doi:10.1016/j.ymthe.2017.11.017.
- ↑ "Pfizer-BioNTech COVID-19 Vaccine Vaccination Storage & Dry Ice Safety Handling". Pfizer. Arquivado dende o orixinal o 24 de xaneiro de 2021. Consultado o 17 de decembro de 2020.
- ↑ 87,0 87,1 Simmons-Duffin S. "Why Does Pfizer's COVID-19 Vaccine Need To Be Kept Colder Than Antarctica?". NPR.org. Arquivado dende o orixinal o 1 de febreiro de 2021. Consultado o 18 de novembro de 2020.
- ↑ 88,0 88,1 "Fact Sheet for Healthcare Providers Administering Vaccine". ModernaTX, Inc. Arquivado dende o orixinal (PDF) o 28 de xsneiro de 2021. Consultado o 21 de decembro de 2020.
- ↑ "Moderna Announces Longer Shelf Life for its COVID-19 Vaccine Candidate at Refrigerated Temperatures". NPR.org. Arquivado dende o orixinal o 16 de novembro de 2020. Consultado o 18 de novembro de 2020.
- ↑ Thomas K (22 de outubro de 2020). "Experts Tell F.D.A. It Should Gather More Safety Data on Covid-19 Vaccines". New York Times. Arquivado dende o orixinal o 26 de xaneiro de 2021. Consultado o 21 de novembro de 2020.
- ↑ Kuchler H (30 de setembro de 2020). "Pfizer boss warns on risk of fast-tracking vaccines". Financial Times. Arquivado dende o orixinal o 18 de novembro de 2020. Consultado o 21 de novembro de 2020.
- ↑ Wadman M (novembro de 2020). "Public needs to prep for vaccine side effects". Science 370 (6520): 1022. PMID 33243869. doi:10.1126/science.370.6520.1022.
- ↑ 93,0 93,1 Kwon D (25 de novembro de 2020). "The Promise of mRNA Vaccines". The Scientist. Arquivado dende o orixinal o 22 de xaneiro de 2021. Consultado o 27 de novembro de 2020.
- ↑ Carmichael F, Goodman J (2 de decembro de 2020). "Vaccine rumours debunked: Microchips, 'altered DNA' and more" (Reality Check). BBC. Arquivado dende o orixinal o 13 de marzo de 2021. Consultado o 10 de decembro de 2020.
- ↑ Skalka AM (2014). "Retroviral DNA Transposition: Themes and Variations". Microbiology Spectrum 2 (5): 1101–23. ISBN 9781555819200. PMC 4383315. PMID 25844274. doi:10.1128/microbiolspec.MDNA3-0005-2014.
- ↑ 96,0 96,1 Deering RP, Kommareddy S, Ulmer JB, Brito LA, Geall AJ (xuño de 2014). "Nucleic acid vaccines: prospects for non-viral delivery of mRNA vaccines". Expert Opin Drug Deliv 11 (6): 885–99. PMID 24665982. doi:10.1517/17425247.2014.901308.
- ↑ Versteeg L, Almutairi MM, Hotez PJ, Pollet J (setembro de 2019). "Enlisting the mRNA Vaccine Platform to Combat Parasitic Infections". Vaccines 7 (4): 122. PMC 6963228. PMID 31547081. doi:10.3390/vaccines7040122 //www.ncbi.nlm.nih.gov/pmc/articles/PMC6963228
|PMC=sen título (Axuda). - ↑ 98,0 98,1 "New crop of COVID-19 mRNA vaccines could be easier to store, cheaper to use". www.science.org (en inglés). Arquivado dende o orixinal o 5 de abril de 2022. Consultado o 6 de abril de 2022.
- ↑ 99,0 99,1 Bloom K, van den Berg F, Arbuthnot P (abril de 2021). "Self-amplifying RNA vaccines for infectious diseases". Gene Therapy 28 (3–4): 117–129. PMC 7580817. PMID 33093657. doi:10.1038/s41434-020-00204-y.
- ↑ Lowe D (1 de marzo de 2021). "A Malaria Vaccine Candidate". Science Translational Medicine. Arquivado dende o orixinal o 6 de maio de 2021. Consultado o 7 de maio de 2021.
- ↑ Knapton, Sarah (20 de setembro de 2021). "First 'variant-proof' Covid vaccine starts trials in Manchester - Retired couple Andrew Clarke, 63, and his wife Helen, 64, from Bolton, became the first to receive the mRNA vaccine on Monday". The Daily Telegraph. Arquivado dende o orixinal o 20 de setembro de 2021. Consultado o 21 de setembro de 2021.
- ↑ "Gritstone Announces Dosing of First Volunteer in Trial Evaluating Self-Amplifying mRNA as a COVID-19 Vaccine Booster and Immunogenicity Enhancer". PipelineReview. 20 de setembro de 2021. Arquivado dende o orixinal o 22 de setembro de 2021. Consultado o 21 de setembro de 2021.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Dolgin E (setembro de 2021). "The tangled history of mRNA vaccines". Nature (PDF) 597 (9): 318–24. Bibcode:2021Natur.597..318D. PMID 34522017. doi:10.1038/d41586-021-02483-w https://media.nature.com/original/magazine-assets/d41586-021-02483-w/d41586-021-02483-w.pdf
|url=sen título (Axuda). - Sahin U, Karikó K, Türeci Ö (outubro de 2014). "mRNA-based therapeutics – developing a new class of drugs". Nat Rev Drug Discov 13 (10): 759–80. PMID 25233993. doi:10.1038/nrd4278.
Ligazóns externas
[editar | editar a fonte]- "Five things you need to know about: mRNA vaccines". Horizon. Arquivado dende o orixinal o 4 de abril de 2020. Consultado o 17 de novembro de 2020.
- "RNA vaccines: an introduction". PHG Foundation. University of Cambridge.
- "Understanding mRNA COVID-19 Vaccines". Centers for Disease Control and Prevention. 4 de xaneiro de 2022.
- Kolata, Gina; Mueller, Benjamin (15 de xaneiro de 2022). "Halting Progress and Happy Accidents: How mRNA Vaccines Were Made". The New York Times.
- M.I.T. Lecture 10: Kizzmekia Corbett, Vaccines" no YouTube
- xkcd webcomic explaining how the vaccine works using Star Wars characters and situations.
