Estrutura secundaria dos ácidos nucleicos


A estrutura secundaria dos ácidos nucleicos son as interaccións de apareamento de bases nun polímero de ácido nucleico ou entre dous destes polímeros. Pode representarse como unha lista de bases que están apareadas nunha molécula de ácido nucleico, que darán lugar a unha estrutura secundaria concreta.[1] As estruturas secundarias dos ADNs e ARNs biolóxicos adoitan ser diferentes: o ADN biolóxico existe principalmente en forma de dobres hélices cun apareamento de bases completo, mentres que o ARN biolóxico ten unha soa cadea e adoita formar interaccións de apareamento de bases complexas e intricadas debido á súa maior capacidade de formar enlaces de hidróxeno no seu grupo hidroxilo extra do azucre ribosa.
Nun contexto non biolóxico, a estrutura secundaria é unha consideración moi importante no deseño de ácidos nucleicos para obter estruturas de ácidos nucleicos para a nanotecnoloxía do ADN e computación do ADN, xa que o padrón dos apareamentos de bases determina en última instancia a estrutura global das moléculas.
Conceptos fundamentais[editar | editar a fonte]
Apareamento de bases[editar | editar a fonte]
- Artigo principal: Par de bases.
En bioloxía molecular, dous nucleótidos en febras opostas complementarias de ADN ou ARN que están conectadas por medio de enlaces de hidróxeno chámanse pares de bases (a miúdo abreviadas como bp). No apareamento de bases canónico de Watson e Crick no ADN a adenina (A) forma un par de bases coa timina (T) e a guanina (G) forma outro coa citosina (C). No ARN a timina é substituída polo uracilo (U). Os padróns de enlaces de hidróxeno alternativos, como o par de bases cambaleante e o par de bases Hoogsteen, tamén poden aparecer, especialmente no ARN; dando lugar a estruturas terciarias complexas e funcionais. Este apareamento é o mecanismo polo cal os codóns do ARN mensaxeiro son recoñecidos polos anticodóns do ARN transferente durante a tradución de proteínas. Algúns encimas que se une ao ADN e ARN poden recoñecer padróns de apareamenrto de bases específicas que identifican rexións regulatorias particulares dos xenes. Os enlaces de hidróxeno son o mecanismo químico que subxace nas regras de apareamento de bases descritas antes. A correspondencia xeométrica apropiada dos doantes e aceptores dos enlaces de hidróxeno permite soamente que se formen establemente os pares "correctos". O ADN con alto contido GC é máis estable que o ADN con baixo contido GC, pero ao contrario do que popularmente se cre, os enlaces de hidróxeno non estabilizan o ADN significativamente e a estabilización débese principalmente ás interaccións de empillamento (stacking).[2]
As nucleobases máis grandes, adenina e guanina, pertencen a unha clase de estruturas químicas de dobre anel chamadas purinas; as nucleobases máis pequenas, citosina e timina (e uracilo), son membros das pirimidinas, que tamén son cíclicas pero só teñen un anel. As purinas só se complementan con pirimidinas: os apareamentos pirimidina-pirimidina son enerxeticametne desfavorables porque as moléculas están demasiado afastadas para que establezan enlaces de hidróxeno; os apareamentos purina-purina son tamén enerxeticamente desfavorables porque as moléculas están demasiado próximas, o que orixina repulsión de solapamento. Os outros apareamentos, como GT e AC serían incorrectos porque o padrón de doantes e aceptores de enlaces de hidróxeno non se cumpre. O par de bases cambaleante GU, con dous enlaces de hidróxeno, dáse bastante a miúdo no ARN.
Hibridación de ácidos nucleicos[editar | editar a fonte]
- Artigo principal: Termodinámica dos ácidos nucleicos.
A hibridación é o proceso de apareameno de bases complementario que forma unha dobre hélice. A fusión é o proceso polo cal rompen as interaccións entre as febras da dobre hélice, separando as dúas febras do ácido nucleico. Estes enlaces son febles, e sepáranse doadamente cun quentamento suave, encimas ou forza física. A fusión ocorre preferentemente en certos puntos do ácido nucleico.[3] Secuencias ricas en T e A son máis fáciles de fundir que as rexións ricas en C e G. Determinados pares de bases son tamén susceptibles á fusión do ADN, especialmente T A e T G.[4] Estas características mecánicas reflíctense no uso de secuencias como a TATAA situadas ao comezo de moitos xenes para axudar a ARN polimerase a separar as febras do ADN durante a transcrición.
A separación de febras de ácidos nucleicos por quentamento suave, como pasa na PCR, é simple con tal que as moléculas teñan menos de 10.000 pares de bases (10 quilopares de basess, ou 10 kbp). O entrelazado das febras do ADN fai que os segmentos longos sexan difíciles de separar. A célula evita este problema permitindo que os seus encimas de fusión do ADN (helicases) funcionen xunto coas topoisomerases, que poden cortar quimicamente o esqueleto de azucre-fosfato dunha febra para que poida xirar arredor da outra. As helicases desenronlan as febras para facilitar o avance dos encimas que len a secuencia, como a ADN polimerase.
Motivos da estrutura secundaria[editar | editar a fonte]

A estrutura secundaria dos ácidos nucleicos consta de hélices (con pares de bases contiguas) e varios tipos de bucles (nucleótidos non apareados rodeados de hélices). Frecuentemente estes elementos ou combinacións deles subclasifícanse en categorías adicionais, como tetrabucles, pseudonós e talos-bucles.
Dobre hélice[editar | editar a fonte]
- Artigo principal: Dobre hélice de ácidos nucleicos.
A dobre hélice é unha importante estrutura terciaria das moléculas de ácidos nucleicos, que está intimamente conectada coa estrutura secundaria da molécula. Unha dobre hélice está formada por rexións con moitos pares de bases consecutivos. A estrutura secundaria depende dos apareamentos de bases e está formada por pequenos motivos; neste caso segmentos de dobre hélice, pero no ADN toda a molécula pode ser unha dobre hélice, mentres que no ARN hai tramos con dobre hélice e outros sen ela.
A dobre hélice dun ácido nucleico é un polímero espiral, xeralmente dextroxiro, que contén dúas febras de nucleótidos que forman entre si apareamentos de bases. Un xiro da hélice consta duns dez nucleótidos e contén un suco maior e outro menor (menos ancho e profundo).[5] Dada esta diferenza en anchura entre os dous sucos, moitas proteínas que se unen ao ADN fano no suco maior.[6] Son posibles moitas formas de dobre hélice; no caso do ADN as tres formas bioloxicamente relevantes son o ADN A, o ADN B e o ADN Z, mentres que as dobres hélices do ARN teñen estruturas similares á forma A do ADN.
Estruturas de talo-bucle[editar | editar a fonte]

- Artigo principal: Talo-bucle.
A estrutura secundaria das moléculas de ácido nucleico adoita poder descompoñerse en talos e bucles. A estrutura de talo-bucle (tamén denominada "forquita") está formada por unha hélice con apareamento de bases que acaba nun curto bucle sen apareamento. É extremadamente común e é un elemento de construción de motivos estruturais máis grandes como as estruturas en folla de trevo, que son unións de catro tramos de hélice como as que se encontran no ARN transferente. Son tamén ferecuentes os bucles internos (unha serie curta de bases non apareadas nunha hélice apareada máis longa) e avultamentos (rexións nas que unha das febras dunha hélice ten inseridas bases extra que non teñen outras coas que aparearse na febra oposta).
Hai moitos elementos de estrutura secundaria de importancia nos ARNs biolóxicos; algúns famosos exemplos son os talos-bucles do terminador independente de Rho e a folla de trevo do ARNt. Estanse a realizar activas investigacións para determinar a estrutura secundaria das moléculas de ARN, usando métodos experimentais e computacionais.
Pseudonós[editar | editar a fonte]
- Artigo principal: Pseudonó.
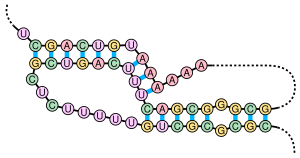
Un pseudonó é unha estrutura secundaria de ácido nucleico que contén polo menos dúas estruturas de talo-bucle nas cales a metade dun talo está intercalado entre as dúas metades do outro talo. Os pseudonós préganse en conformacións tridimensionais con forma de nó, pero non son verdadeiros nós topolóxicos. O apareamento de bases nos pseudonós non está ben aniñado; é dicir, o apareamento de bases ocorre "solapándose" nas posicións da secuencia. Isto fai que a presenza de pseudonós xerais nas secuencias dos ácidos nucleicos sexa imposible de predicir polo método estándar de programación dinámica, que utiliza un sistema de contabilización repetitivo para identificar os talos e, en consecuencia, non pode detectar os pares de bases non aniñadas cos algoritmos comúns. Porén, poden predicirse unhas subclases limitadas de pseudonós usando programas dinámicos modificados.[8] As técnicas de predición de novas estruturas como a gramática libre de contexto estocástica tamén son incapaces de considerar os pseudonós.
Os pseudonós poden formar unha variedade de estruturas con actividade catalítica[9] e varios procesos biolóxicos importantes dependen de que as moléculas de ARN formen pseudonós. Por exemplo, o compoñente de ARN da telomerase humana contén un pseudonó que é esencial para a súa actividade.[7] O ribocima do virus da hepatite delta é un exemplo ben coñecido dun ARN catalítico cun pseudonó no seu sitio activo.[10][11] Aínda que o ADN tamén pode formar pseudonós, xeralmente estes non están presentes en condicións fisiolóxicas estándar.
Predición da estrutura secundaria[editar | editar a fonte]
A maioría dos métodos para a predición da estrutura secundaria dos ácidos nucleicos baséanse no modelo termodinámico do veciño máis próximo.[12][13] Un método común de determinar as estruturas máis probables dunha determinada secuencia de nucleótidos utilizan un algoritmo de programación dinámica que trata de buscar estruturas con baixa enerxía libre.[14] Os algoritmos de programación dinámica adoitan prohibir pseudonós, ou outros casos nos cales os pares de bases non están completamente aniñados, xa que se considera que estas estruturas son moi caras computacionalmente mesmo para moléculas pequenas de ácidos nucleicos. Poden utilizarse tamén outros métodos, como as gramáticas libres de contexto estocásticas para predicir a estrutura secundaria dos ácidos nucleicos.
Para moitas moléculas de ARN a estrutura secundaria é moi importante para o correcto funcionamento do ARN, a miúdo máis que a propia secuencia. Isto axuda á análise de ARN non codificante ás veces denominado "xenes de ARN". Unha aplicación bioinformática usa estruturas secundarias do ARN preditas para buscar un xenoma de formas non codificantes pero funcionais de ARN. Por exemplo, os microARNs teñen estruturas de talo-bucle canónicas interrompidas por pequenos bucles internos.
A estrutura secundaria do ARN aplícase no empalme do ARN en certas especies. Nos humanos e outros tetrápodos, observouse que sen a proteína U2AF2, o proceso de empalme (splicing) queda inhibido. Porén, no peixe cebra e outros teleósteos o proceso do empalme do ARN pode ocorrer en certos xenes mesmo en ausencia de U2AF2. Isto pode ser porque o 10% dos xenes do peixe cebra teñen pares de bases TG e AC alternos nos seus sitios de empalme 3' e 5', respectivamente, en cada intrón, o que altera a estrutura secundaria do ARN. Isto suxire que a estrutura secundaria do ARN pode influír no empalme, potencialmente sen usar proteínas como U2AF2, que se cría eran necesarias para que ocorrese o empalme.[15]
Determinación da estrutura secundaria[editar | editar a fonte]
A estrutura secundaria dun ARN pode determinarse a partir de datos das coordenadas atómicas (estrutura terciaria) obtidas por cristalografía de raios X, a miúdo depositados no Protein Data Bank. Entre os métodos actuais están 3DNA/DSSR[16] e MC-annotate.[17]
Notas[editar | editar a fonte]
- ↑ Dirks, Robert M.; Lin, Milo; Winfree, Erik; Pierce, Niles A. (2004). "Paradigms for computational nucleic acid design". Nucleic Acids Research 32 (4): 1392–1403. PMC 390280. PMID 14990744. doi:10.1093/nar/gkh291.
- ↑ Yakovchuk, Peter; Protozanova, Ekaterina; Frank-Kamenetskii, Maxim D. (2006). "Base-stacking and base-pairing contributions into thermal stability of the DNA double helix". Nucleic Acids Research 34 (2): 564–574. PMC 1360284. PMID 16449200. doi:10.1093/nar/gkj454.
- ↑ Breslauer KJ, Frank R, Blöcker H, Marky LA (1986). "Predicting DNA duplex stability from the base sequence". PNAS 83 (11): 3746–3750. Bibcode:1986PNAS...83.3746B. PMC 323600. PMID 3459152. doi:10.1073/pnas.83.11.3746.
- ↑ Richard Owczarzy (2008-08-28). "DNA melting temperature - How to calculate it?". High-throughput DNA biophysics. owczarzy.net. Arquivado dende o orixinal o 2015-04-30. Consultado o 2008-10-02.
- ↑ Alberts; et al. (1994). The Molecular Biology of the Cell. New York: Garland Science. ISBN 978-0-8153-4105-5.
- ↑ Pabo C, Sauer R (1984). "Protein-DNA recognition". Annu Rev Biochem 53: 293–321. PMID 6236744. doi:10.1146/annurev.bi.53.070184.001453.
- ↑ 7,0 7,1 Chen JL, Greider CW (2005). "Functional analysis of the pseudoknot structure in human telomerase RNA". Proc Natl Acad Sci USA 102 (23): 8080–5. Bibcode:2005PNAS..102.8080C. PMC 1149427. PMID 15849264. doi:10.1073/pnas.0502259102.
- ↑ Rivas E, Eddy SR (1999). "A dynamic programming algorithm for RNA structure prediction including pseudoknots". J Mol Biol 285 (5): 2053–2068. PMID 9925784. arXiv:physics/9807048. doi:10.1006/jmbi.1998.2436.
- ↑ Staple, David W.; Butcher, Samuel E. (2005-06-14). "Pseudoknots: RNA Structures with Diverse Functions". PLOS Biol 3 (6): e213. ISSN 1545-7885. PMC 1149493. PMID 15941360. doi:10.1371/journal.pbio.0030213.
- ↑ Doudna, Jennifer A.; Ferré-D'Amaré, Adrian R.; Zhou, Kaihong (outubro de 1998). "Crystal structure of a hepatitis delta virus ribozyme". Nature 395 (6702): 567–574. Bibcode:1998Natur.395..567F. PMID 9783582. doi:10.1038/26912.
- ↑ Lai, Michael M. C. (1995-06-01). "The Molecular Biology of Hepatitis Delta Virus". Annual Review of Biochemistry 64 (1): 259–286. ISSN 0066-4154. PMID 7574482. doi:10.1146/annurev.bi.64.070195.001355.
- ↑ Xia T, SantaLucia J Jr, Burkard ME, Kierzek R, Schroeder SJ, Jiao X, Cox C, Turner DH (outubro de 1998). "Thermodynamic parameters for an expanded nearest-neighbor model for formation of RNA duplexes with Watson-Crick base pairs". Biochemistry 37 (42): 14719–35. PMID 9778347. doi:10.1021/bi9809425.
- ↑ Mathews DH, Disney MD, Childs JL, Schroeder SJ, Zuker M, Turner DH (maio de 2004). "Incorporating chemical modification constraints into a dynamic programming algorithm for prediction of RNA secondary structure". PNAS 101 (19): 7287–92. Bibcode:2004PNAS..101.7287M. PMC 409911. PMID 15123812. doi:10.1073/pnas.0401799101.
- ↑ Zuker, M. (1989-04-07). "On finding all suboptimal foldings of an RNA molecule". Science (en inglés) 244 (4900): 48–52. Bibcode:1989Sci...244...48Z. ISSN 0036-8075. PMID 2468181. doi:10.1126/science.2468181.
- ↑ Lin, Chien-Ling; Taggart, Allison J.; Lim, Kian Huat; Cygan, Kamil J.; Ferraris, Luciana; Creton, Robert; Huang, Yen-Tsung; Fairbrother, William G. (13 de novembro de 2015). "RNA structure replaces the need for U2AF2 in splicing". Genome Research 26 (1): 12–23. PMC 4691745. PMID 26566657. doi:10.1101/gr.181008.114.
- ↑ Lu, XJ; Bussemaker, HJ; Olson, WK (2 de decembro de 2015). "DSSR: an integrated software tool for dissecting the spatial structure of RNA.". Nucleic Acids Research 43 (21): e142. PMC 4666379. PMID 26184874. doi:10.1093/nar/gkv716.
- ↑ "MC-Annotate". www-lbit.iro.umontreal.ca.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- MDDNA: Bioinformática estrutural do ADN
- Abalone — Software comercial para a modelización de ADN
- DNAlive: unha interface web para computar as propiedades físicas do ADN. Tamén permite cruzar os resultados co UCSC Genome browser e DNA dynamics.


