Tiocianato

O tiocianato [1][2] (tamén chamado sulfocianato, sulfocianuro ou rodanuro[3]) é o anión [SCN]−. É a base conxugada do ácido tiociánico. Entre os seus derivados comúns están os sales incoloros tiocianato de potasio e tiocianato de sodio. Os compostos orgánicos que conteñen o grupo funcional SCN tamén se chaman tiocianatos. Antes utilizábase en pirotecnia o tiocianato de mercurio(II).
O tiocianato é análogo ao ión cianato, [OCN]−, no cal o oxíxeno se substituíu por xofre. O [SCN]− é un dos pseudohaluros, debido á similitude das súas reaccións coas dos ións haluro. O tiocianato coñecíase tamén como rodanuro (da palabra grega que significa rosa) debido á cor vermella dos complexos que forma co ferro. O tiocianato prodúcese por reacción de xofre elemental ou tiosulfato co cianuro:
- 8 CN− + S8 → 8 SCN−
- CN− + S2O32− → SCN− + SO32−
A segunda reacción é catalizada polo encima sulfotransferase coñecido como rodanese (sic)[4] e pode ser importante para a detoxificación do cianuro no corpo.
Estrutura, enlaces e coordinación[editar | editar a fonte]
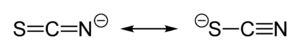
O tiocianato comparte a súa carga negativa aproximadamente por igual entre o xofre e o o nitróxeno. Como consecuencia, o tiocianato pode actuar como nucleófilo tanto no xofre coma no nitróxeno, polo que é un ligando ambidentado. O [SCN]− pode tamén funcionar como ponte entre dous metais (M−SCN−M) ou entre tres (>SCN− ou −SCN<). As evidencias experimentais levan á conclusión xeral de que os metais de clase A (ácidos duros) tenden a formar complexos de tiocinato unidos polo nitróxeno, mentres que os metais de clase B (ácidos brandos) tenden a formar complexos de tiocianato unidos polo xofre. Ás veces están implicados outros factores, por exemplo, cinética e solubilidade, e pode darse isomería de enlace, por exemplo [Co(NH3)5(NCS)]Cl2 e [Co(NH3)5(SCN)]Cl2.[5]
Tiocianatos orgánicos[editar | editar a fonte]
Os derivados orgánicos e con metais de transición do ión tiocianato poden existir como "isómeros de enlace." Nos tiocianatos, o grupo orgánico (ou ión metálico) está unido ao xofre: o R−S−C≡N ten un enlace simple S-C e un triplo enlace C-N.[6] Nos isotiocianatos, o substituínte está unido ao nitróxeno: o R−N=C=S ten un dobre enlace S-C e un dobre enlace C-N:
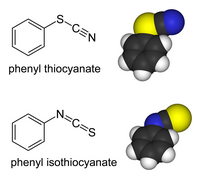
Os tiocianatos orgánicos son hidrolizados a tiocarbamatos na síntese de tiocarbamatos de Riemschneider.
Ensaio para o ferro (III)[editar | editar a fonte]
Se engadimos [SCN]− a unha solución que contén ións de ferro (III) (Fe3+), foórmase unha solución da cor do sangue debido á formación do [Fe(NCS)(H2O)5]2+.
-
O complexo de cor vermello sangue pentaaqua(tiocianato-N)ferro(III), [Fe(NCS)(H2O)5]2+, indica a presenza de Fe3+ na solución
-
Ensaio para o ferro(III).
Bioquímica do tiocianato en medicina[editar | editar a fonte]
O tiocianato [7] ten un importante papel na biosíntese de hipotiocianito pola lactoperoxidase.[8][9][10] Así a completa ausencia de tiocianato [11] ou de tiocianato reducido [12] no corpo humano (por exemplo, na fibrose quística) produce un dano ao sistema de defensa humano.[13][14] O tiocianato é un potente inhibidor competitivo do simporter sodio-ioduro da tiroide.[15]
O tiocianato é un metabolito do nitroprusiato de sodio (un potente vasodialtador)[16].
Notas[editar | editar a fonte]
- ↑ ChemSpider Thiocyanate
- ↑ CHEBI Thiocyanate
- ↑ PubChem compound Thiocyanate
- ↑ Cipollone R, Ascenzi P, Tomao P, Imperi F, Visca P (2008). "Enzymatic detoxification of cyanide: clues from Pseudomonas aeruginosa Rhodanese". J. Mol. Microbiol. Biotechnol. 15 (2-3): 199–211. PMID 18685272. doi:10.1159/000121331.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. p. 326. ISBN 0-08-037941-9.
- ↑ Guy, R. G. (1977). "Syntheses and Preparative Applications of Thiocyanates". En Patai, S. Chemistry of Cyanates and Their Derivatives 2. New York: John Wiley.
- ↑ Pedemonte, N.; Caci, E.; Sondo, E.; Caputo, A.; Rhoden, K.; Pfeffer, U.; di Candia, M.; Bandettini, R.; Ravazzolo, R.; Zegarra-Moran, O.; Galietta, L. J. (2007). "Thiocyanate Transport in Resting and IL-4-Stimulated Human Bronchial Epithelial Cells: Role of Pendrin and Anion Channels" (pdf). Journal of Immunology 178 (8): 5144–5153. PMID 17404297.
- ↑ Conner, G. E.; Wijkstrom-Frei, C.; Randell, S. H.; Fernandez, V. E.; Salathe, M. (2007). "The Lactoperoxidase System Links Anion Transport to Host Defense in Cystic Fibrosis" (pdf). FEBS Letters 581 (2): 271–278. PMC 1851694. PMID 17204267. doi:10.1016/j.febslet.2006.12.025.
- ↑ White, W. E.; Pruitt, K. M.; Mansson-Rahemtulla, B. (1983). "Peroxidase-Thiocyanate-Peroxide Antibacterial System Does not Damage DNA" (pdf). Antimicrobial Agents and Chemotherapy 23 (2): 267–272. PMC 186035. PMID 6340603.
- ↑ Thomas, E. L.; Aune, T. M. (1978). "Lactoperoxidase, Peroxide, Thiocyanate Antimicrobial System: Correlation of Sulfhydryl Oxidation with Antimicrobial Action" (pdf). Infection and Immunity 20 (2): 456–463. PMC 421877. PMID 352945.
- ↑ Childers, M.; Eckel, G.; Himmel, A.; Caldwell, J. (2007). "A new Model of Cystic Fibrosis Pathology: Lack of Transport of Glutathione and its Thiocyanate Conjugates". Medical Hypotheses 68 (1): 101–112. PMID 16934416. doi:10.1016/j.mehy.2006.06.020.
- ↑ Minarowski, Ł.; Sands, D.; Minarowska, A.; Karwowska, A.; Sulewska, A.; Gacko, M.; Chyczewska, E. (2008). "Thiocyanate concentration in saliva of cystic fibrosis patients". Folia Histochemica et Cytobiologica 46 (2): 245–246. PMID 18519245. doi:10.2478/v10042-008-0037-0.
- ↑ Moskwa, P.; Lorentzen, D.; Excoffon, K. J.; Zabner, J.; McCray, P. B. Jr.; Nauseef, W. M.; Dupuy, C.; Bánfi, B. (2007). "A Novel Host Defense System of Airways is Defective in Cystic Fibrosis" (pdf). American Journal of Respiratory and Critical Care Medicine 175 (2): 174–183. PMC 2720149. PMID 17082494. doi:10.1164/rccm.200607-1029OC.
- ↑ Xu, Y.; Szép, S.; Lu, Z. (2009). "The antioxidant role of thiocyanate in the pathogenesis of cystic fibrosis and other inflammation-related diseases" (pdf). Proceedings of the National Academy of Science U.S.A. 106 (48): 20515–20519. Bibcode:2009PNAS..10620515X. PMC 2777967. PMID 19918082. doi:10.1073/pnas.0911412106.
- ↑ Braverman LE; He X; Pino S; et. al (2005). "The effect of perchlorate, thiocyanate, and nitrate on thyroid function in workers exposed to perchlorate long-term". J Clin Endocrinol Metab. 90 (2): 700–706. PMID 15572417. Arquivado dende o orixinal o 02 de maio de 2013. Consultado o 20 de novembro de 2012.
- ↑ Nitropress (Nitroprusside Sodium) Drug Information: User Reviews, Side Effects, Drug Interactions and Dosage at RxList. Rxlist.com. Retrieved on 20-11-2012.

![O complexo de cor vermello sangue pentaaqua(tiocianato-N)ferro(III), [Fe(NCS)(H2O)5]2+, indica a presenza de Fe3+ na solución](http://upload.wikimedia.org/wikipedia/commons/thumb/1/11/Pentaaquathiocyanatoiron%28II%29-3D-balls.png/120px-Pentaaquathiocyanatoiron%28II%29-3D-balls.png)
