Resposta policlonal das células B

A resposta policlonal das células B é un tipo natural de resposta inmune que presenta o sistema inmunitario adaptativo dos mamíferos. Posibilita que un determinado antíxeno sexa recoñecido e atacado polas súas partes solapantes, chamadas epítopos, por múltiples clons de células B.[1][2]
No decurso dunha resposta inmunitaria normal, algunhas partes do patóxeno (por exemplo, unha bacteria) son recoñecidos polo sistema inmunitario como algo alleo (non propio), e eliminadas ou neutralizadas para reducir os posibles danos que poderían causar. A substancia recoñecible chámase antíxeno. O sistema inmunitario pode responder de moitas maneiras ao antíxeno; unha característica fundamental desta resposta é a produción de anticorpos polas células B (ou linfocitos B) que interveñen nun conxunto de accións do sistema inmunitario chamado inmunidade humoral. Os anticorpos son solubles e non requiren para o seu funcionamento un contacto directo célula a célula entre o patóxeno e a célula B.
Os antíxenos poden ser substancias grandes e complexas, e calquera anticorpo pode só unirse a unha área pequena e específica do antíxeno. En consecuencia, unha resposta inmune efectiva implica a miúdo a produción de moitos anticorpos distintos por células B moi diferentes contra o mesmo antíxeno. De aí o termo "policlonal", que deriva das palabras gregas poly, que significa 'moitos', e klon, 'gromo', 'ramiña'.[3][4][5] Un clon é un grupo de células que se orixinan a partir da división dunha célula "parental" común. Os anticorpos así producidos nunha resposta policlonal denomínanse anticorpos policlonais. Os anticorpos policlonais son heteroxéneos e distintos das moléculas de anticorpos monoclonais, as cales son idénticas e reaccionan contra un só epítopo, é dicir, son máis específicas.
Aínda que a resposta policlonal lle dá certas vantaxes ao sistema inmunitario, como ter unha maior probabilidade de reaccionar contra os patóxenos, tamén incrementa as posibilidades de desenvolver certas doenzas autoinmunes que resultan da reacción do sistema inmunitario contra moléculas nativas producidas polo propio hóspede.
Resposta humoral a unha infección
[editar | editar a fonte]- Artigo principal: Sistema inmunitario.
As doenzas que poden transmitirse dun organismo a outro denomínanse enfermidades infecciosas, e o axente biolóxico que as causa denomínase patóxeno. O proceso polo cal o patóxeno se introduce no corpo denomínase inoculación,[nota 1][6] e o organismo ao que afecta denomínase hóspede. Cando o patóxeno se establece nunha etapa chamada colonización,[7] pode ter como resultado unha infección,[7] na que causa danos ao hóspede directamente ou por medio da produción de substancia daniñas chamadas toxinas.[7] Isto orixina os diversos síntomas e signos característicos dunha doenza infecciosa como a pneumonía ou a difteria.
Contrarrestar as doenzas infecciosas é moi importante para a supervivencia do organismo e da especie. Isto conségueo o hóspede eliminando o patóxeno e as súas toxinas ou facéndoos non funcionais. O conxunto de células, tecidos e órganos que se especializan na protección do corpo contra as infeccións constitúen o sistema inmunitario. O sistema inmunitario realiza este labor por medio do contacto directo que establecen certos leucocitos co patóxeno invasor, que forman unha rama do sistema inmunitario chamada inmunidade mediada por células, ou producindo substancias que se moven polo corpo ata chegar a sitios afastados de onde se segregaron, "buscan" as células causantes da doenza e as toxinas uníndose especificamente[nota 2] a elas, e neutralizándoas no proceso chamado inmunidade humoral. Ditas substancias defensivas son os anticorpos solubles, que realizan as seguintes accións:
- Recobren o patóxeno, impedíndolle adherirse á célula hóspede e imposibilitando así a colonización.
- Fan que precipiten (que se agreguen e "afundan" deixando de circular ao unírense a eles) os antíxenos solubles, e promoven a súa retirada dos tecidos e sangue por outras células do sistema inmune.
- Recobren o microorganismo, o que atrae células que fagocitan o patóxeno. Este recubrimento chámase opsonización. Deste modo, o anticorpo actúa como unha opsonina.
- Activan o sistema do complemento, que causa perforacións na envoltura extena do patóxeno (a súa membrana plasmática), o que o mata.
- Marcan células do hóspede infectadas por virus para que sexan destruídas nun proceso chamado citotoxicidade mediada por células dependente de anticorpo.[8]
- Tipos de leucocitos
Resposta das células B
[editar | editar a fonte]
Os anticorpos realizan varias funcións na protección do hóspede contra o patóxeno. As súas formas solubles (anticorpos) que levan a cabo estas funcións son producidas polas células B plasmáticas, un tipo de linfocito B. Esta produción está estreitamente regulada e require a activación de células B polas células T activadas (outro tipo de leucocito), o cal é un procedemento secuencial. Os principais pasos implicados son:[9]
- Recoñecemento específico ou non específico do patóxeno (por medio dos seus antíxenos) coa subseguinte fagocitación do antíxeno por células B ou por macrófagos. Isto activa a célula B só parcialmente.
- Procesamento do antíxeno.
- Presentación do antíxeno.
- Activación das células T colaboradoras (axudante ou auxiliar) polas células presentadoras do antíxeno.
- Coestimulación da célula B pola célula T activada, o que ten como resultado a súa completa activación.
- Proliferación[nota 3] das células B coa produción resultante de anticorpos solubles.

Recoñecemento de patóxenos
[editar | editar a fonte]Os patóxenos sintetizan proteínas que poden servir como antíxenos recoñecibles; poden expresar esas moléculas na súa superficie ou liberalas nos seus arredores (fluídos corporais). O que fai que estas substancias sexan recoñecibles é que se unen moi especificamente e con certa forza a certas proteínas do hóspede chamadas anticorpos. Os anticorpos poden estar ancorados á superficie das células do sistema inmunitario, e nese caso serven como receptores inmunitarios, ou poden ser segregados ao sangue (anticorpos solubles). A escala molecular, as proteínas son relativamente grandes, polo que non poden ser recoñecidas no seu conxunto total; ao contrario, teñen segmentos máis pequenos chamados epítopos, que son os que serán recoñecidos.[1] Un epítopo ponse en contacto cunha pequena rexión (de 15 a 22 aminoácidos) da molécula de anticorpo; esta rexión coñécese como parátopo.[1] No sistema inmunitario, os anticorpos unidos a membrana son o receptor de células B (BCR). Ademais, aínda que o receptor de células T (TCR) non se clasifica bioquimicamente como anticorpo, realiza unha función similar na que se une especificamente a epítopos acomplexados con moléculas do complexo maior de histocompatibilidade (MHC).[nota 4][10] A unión entre un parátopo e o seu antíxeno correspondente é moi específica, debido á súa estrutura, e é establecida por medio de varios enlaces non covalentes, de xeito non moi diferente ao apareamento doutros tipos de ligandos (calquera átomo, ión ou molécula que se une a un receptor con polo menos algún grao de especificidade e forza). A especificidade da unión non se orixina por un tipo de interacción ríxido de chave e pechadura, senón que necesita que tanto o parátopo coma o epítopo experimenten lixeiros cambios conformacionais cando están un en presenza do outro.[11]
Recoñecemento específico do epítopo polas células B
[editar | editar a fonte]- Artigos principais: Epítopo linear e Epítopo conformacional.

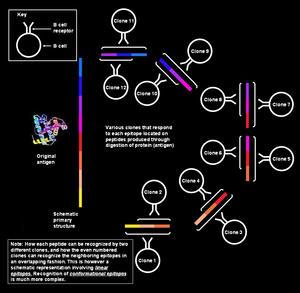
Na figura da esquerda, os diversos segmentos que forman o epítopo son colineares de forma continua, é dicir, son secuenciais; porén, para o que interesa no recoñecemento de antíxenos polas células B, esta explicación é moi simplista. Tales epítopos coñécense como secuenciais ou lineares, xa que todos os aminoácidos que os forman están na mesma secuencia (liña). Este modo de recoñecemento é posible só cando o péptido é pequeno (duns seis a oito aminoácidos de longo),[1] e é empregado polas células T.
Porén, as células B de memoria/virxes recoñecen as proteínas intactas presentes na superficie dco patóxeno.[nota 5] Nesta situación, a proteína na súa estrutura terciaria está tan pregada que algúns bucles da secuencia de aminoácidos quedan situados no interior da proteína, e os segmentos que os flanquean poden quedar na superficie. O parátopo no receptor de células B ponse en contacto só con aqueles aminoácidos que están situados na superficie da proteína. Os aminoácidos da superficie poden en realidade non estar en secuencia continua na estrutura primaria da proteína, pero quedan xuntos despois do pregamento da proteína (como se ve na figura adxunta). Tales epítopos coñécense como epítopos conformacionais e tenden a ser máis longos (de 15 a 22 residos de aminoácidos) que os epítopos lineares.[1] Igualmente, os anticorpos producidos polas células plasmáticas que pertencen ao mesmo clon uniranse aos mesmos epítopos conformacionais das proteínas do patóxeno.[12][13][14][15]
A unión dun antíxeno específico coas correspondentes moléculas BCR ten como resultado o incremento da produción de moléculas MHC-II. Isto ten importancia, xa que non ocorre igual cando o mesmo antíxeno é internalizado por un proceso relativamente non específico chamado pinocitose, no cal o antíxeno xunto co fluído que o rodea é absorbido formando unha pequena vesícula pola célula B.[16] Por tanto, ese antíxeno denomínase antíxeno non específico e non conduce á activación da célula B, nin á produción de anticorpos contra el.
Recoñecemento non específico polos macrófagos
[editar | editar a fonte]- Artigos principais: Receptor de tipo Toll e Receptor de recoñecemento de padrón.
Os macrófagos e as células dendríticas empregan un mecanismo diferente para recoñecer o patóxeno. Os seus receptores recoñecen certos motivos presentes nos patóxenos invasores que é moi improbable que estean presentes nunha célula hóspede. Eses motivos repetidos son recoñecidos polos receptores de recoñecemento de padrón (PRRs) como os receptores de tipo Toll (TLRs) expresados polos macrófagos.[1][17] Como o mesmo receptor podería unirse a un motivo dado presente nas superficies de microorganismos moi diferentes, este modo de recoñecemento é relativaemnte non específico e constitúe unha resposta inmunitaria innata.
Procesamento do antíxeno
[editar | editar a fonte]- Artigo principal: Procesamento de antíxenos.

Despois de recoñecer un antíxeno, unha célula presentadora do antíxeno como o macrófago ou o linfocito B fagocítao completamente por un proceso chamado fagocitose. A partícula fagocitada, xunto con parte do material que o rodea, pasa a formar parte dunha vesícula endocítica (o fagosoma), que se fusiona despois con lisosomas. Dentro do lisosoma en dixestión, o antíxeno é roto en pequenos fragmentos chamados péptidos pola acción de proteases (encimas que degradan as grandes proteínas). Cada péptido é despois acomplexado con moléculas do complexo maior de histocompatibilidade de clase II (MHC-II) localizadas no lisosoma (este método de "manexar" o antíxeno denomínase procesamento pola vía endocítica ou exóxena que é distinta da vía citosólica ou endóxena,[17][18][19] a cal acomplexa as proteínas anormais producidas dentro da célula (por exemplo, baixo a influencia dunha infección viral ou nunha célula tumoral) con moléculas de MHC-I.
Unha vía alternativa de procesamento endocítico demostrouse tamén cando certas proteínas como o fibrinóxeno e a mioglobina poden unirse como un conxunto a moléculas de MHC-II despois de que son desnaturalizadas e redúcense os seus enlaces disulfuro (o que rompe o enlace ao engadirlle átomos de hidróxeno). As proteases degradan despois as rexións expostas do complexo proteína-MHC II.[19]
Presentación do antíxeno
[editar | editar a fonte]- Artigos principais: Presentación do antíxeno e Complexo maior de histocompatibilidade.
Unha vez que o antíxeno (péptido) procesado forma o complexo coa molécula do MHC, ambos migran xuntos á membrana plasmática, onde son exhibidos (elaborados) como un complexo que pode ser recoñecido pola célula CD 4+ (o linfocito T colaborador) (un tipo de linfocito).[nota 6][20] Isto denomínase presentación de antíxenos. Porén, os epítopos (conformacionais) que son recoñecidos pola célula B antes da súa dixestión non poden ser os mesmos que os presentados á célula T colaboradora. Adicionalmente, unha célula B pode presentar diferentes péptidos acomplexados a diferentes moléculas MHC-II.[16]
Estimulación das células T colaboradoras
[editar | editar a fonte]- Artigo principal: Célula T colaboradora.
As células CD4+ a través do seu complexo receptor de células T-CD3 recoñece as moléculas MHC II unidas a epítopo na superficie de células presentadoras do antíxeno, e son así activadas. Con esta activación, estas células T proliferan e diferéncianse en células Th2.[16][21] Isto fai que empecen a producir sinais químicos solubles que promoven a súa propia supervivencia. Porén, outra importante función que levan a cabo é a estimulación das células B ao estableceren un contacto físico directo con elas.[10]
Coestimulación de células B por células T colaboradoras activadas
[editar | editar a fonte]- Artigo principal: Activación das células B.
A estimulación completa das células T colaboradoras necesita a proteína B7 presente na célula presentadora do antíxeno para unirse coa molécula CD28 presente na superficie da célula T (en estreita proximidade co receptor da célula T).[10] Igualmente, unha segunda interacción entre o ligando CD40 ou CD154 (CD40L) presente na superficie da célula T e o CD40 presente na superfice da célula B, é tamén necesaria.[21] As mesmas interaccións que estimulan a célula T colaboradora tamén estimulan a célula B, de aí que se use o termo coestimulación. O mecanismo enteiro asegura que unha célula T activada só estimula a célula B que recoñece o antíxeno que contén o mesmo epítopo que recoñece o receptor TCR da célula T colaboradora coestimulante. A célula B queda estimulada, ademais de pola coestimulación directa, por certos factores de crecemento, como as interleucinas IL-2, IL-4, IL-5 e IL-6 de maneira parácrina. Estes factores son xeralmente producidos polas células T colaboradoras acabadas de activar.[22] Con todo, esta activación ocorre só despois de que o receptor da célula B presente nunha célula B de memoria ou na propia célula B virxe se una ao correspondente epítopo, sen o cal os pasos que inician a fagocitose e o procesamento do antíxeno non terían ocorrido.
Proliferación e diferenciación das células B
[editar | editar a fonte]- Artigos principais: Célula B, Mutación, Hipermutación somática e Maduración da afinidade.
Unha célula B virxe ou inexperimentada é a que pertence a un clon que nunca se atopou co epítopo para o cal é específico. En contraste, unha célula B de memoria é a que deriva da activación dunha célula B virxe ou de memoria. A activación dunha célula B virxe ou de memoria vai segida dunha gran proliferación desa determinada célula B, a maioría de cuxa proxenie se diferencia finalmente en células B plasmáticas;[nota 7] o resto sobrevive como célula B de memoria. Así, cando as células virxes pertencentes a un clon particular se encontran co seu antíxeno específico para dar lugar ás células plasmáticas, deixan tamén unhas poucas células diferenciadas como células B de memoria, isto coñécese como resposta inmunitaria primaria. No curso da proliferación deste clon, os xenes do receptor da célula B poden sufrir frecuentes mutacións (unha en cada dúas divisións celulares)[8] nos xenes que codifican os parátopos dos anticorpos. Estas mutacións frecuentes denomínanse hipermutacións somáticas. Cada unha destas mutacións altera lixeiramente a capacidade de unión ao epítopo do parátopo, creando novos clons de células B no proceso. Algúns dos parátopos de nova creación únense máis fortemente ao mesmo epítopo (o que conduce á selección dos clons que os posúan), o que se coñece como maduración da afinidade.[8][21] Outros parátopos únense mellor a epítopos que son lixeiramenre diferentes dos epítopos orixinais que estimularan a proliferación. As variacións na estrutura do epítopo prodúcense tamén xeralmente por mutacións nos xenes do patóxeno que codifica o seu antíxeno. Así, a hipermutación somática, fai que os receptores da célula B e os anticorpos solubles en posteriores encontros cos antíxenos, sexan máis inclusivos no seu potencial de recoñecemento de antíxenos con epítopos alterados, ademais de ofreceren unha maior especificidade para o antíxeno que induciu a proliferación no primeiro lugar. Cando as células de memoria son estimuladas polo antíxeno para que orixinen células plasmáticas (igual que na resposta primaria aos clons), deixan incluso máis células de memoria no proceso, isto denomínase resposta inmunitaria secundaria,[21] o que se traduce en maiores cantidades de células plasmáticas e unha velocidade maior de produción de anticorpos que se mantén durante grandes períodos de tempo. As células B con memoria producidas como parte dunha resposta secundaria recoñecen o antíxeno correspondente máis rápido e únense máis fortemente a el (é dicir, con maior afinidade de unión) debido á maduración de afinidade. Os anticorpos solubles producidos polo clon mostran unha potenciación similar na unión ao antíxeno.[21]
Bases da policlonalidade
[editar | editar a fonte]As respostas son de natureza policlonal, xa que cada clon está en maior ou menor medida especializado na produción de anticorpos contra un determinado epítopo e porque cada antíxeno contén múltiples epítopos, cada un dos cales á súa vez pode ser recoñecido por máis dun clon de células B. Para poder reaccionar a innumerables antíxenos, e cos múltiples epítopos que os constitúen, o sistema inmunitario debe ter a capacidade de recoñecer unha gran cantidade de epítopos, é dicir, debería haber unha gran diversidade de clons de células B.
Clonalidade das células B
[editar | editar a fonte]No corpo hai cantidades relativamente pequenas de células B de memoria e virxes. Como o corpo necesita poder responder a unha gran cantidde de patóxenos potenciais, mentén un conxunto de células B cun amplo rango de especificidades.[17] En consecuencia, aínda que hai case sempre polo menos unha célula B (virxe ou de memoria) que pode responder a calquera epítopo determinado (de entre todos contra os que o sistema inmunitario pode reaccionar), hai moi poucos que sexan duplicados exactos. Porén, cando unha célula B encontra un antíxeno ao cal pode unirse, pode proliferar moi rapidamente.[21] Ese grupo de células con idéntica especificidade para o epítopo é un clon, e deriva dunha célula "parental" común. Todas as células B "fillas" teñen a mesma especificidade para o epítopo que a célula "parental" orixinal e segregan anticorpos con parátopos idénticos. Estes anticorpos son anticorpos monoclonais, xa que derivan de clons da mesma célula parental. Unha resposta policlonal é aquela na cal clons de múltiples células B reaccionan co mesmo antíxeno.
Un antíxeno contén múltiples epítopos solapantes
[editar | editar a fonte]
Un só antíxeno pode ser considerado como unha secuencia de múltiples epítopos que se solapan. Aos diversos epítopos poden unirse moitos clons de células B únicos. Isto orixina unha multiplicidade aínda maior na resposta global.[3] Todas estas células B poden ser activadas e producir grandes colonias de clons de células plasmáticas, cada unha das cales pode segregar ata mil moléculas de anticorpos iguais contra cada epítopo por segundo.[21]
Múltiples clons recoñecen un só epítopo
[editar | editar a fonte]Ademais de que diferentes células B reaccionen con diferentes epítopos do mesmo antíxeno, as células B que pertencen a diferentes clons poden tamén reaccionar co mesmo epítopo. Un epítopo que pode ser atacado por moitas células B distintas dise que é moi inmunoxénico. Neses casos, as afinidades de unión para os respectivos pares epítopo-parátopo varían, e algúns clons de células B producen anticorpos que se unen fortemente ao epítopo, e outros producen anticorpos que se unen debilmente.[1]
Selección clonal
[editar | editar a fonte]- Artigos principais: Ganglio linfático, Centro xerminal e Selección clonal.
Os clons que se unen a un determinado epítopo con maior forza é máis probable que sexan seleccionados para experimentar unha maior proliferación nos centros xerminais dos folículos en varios tecidos linfoides como os ganglios linfáticos. Isto non é moi diferente da selección natural: os clons son seleccionados pola súa fitness para atacar os epítopos (forza de unión) do patóxeno que encontran.[23] O que fai a analoxía aínda máis evidente é que os linfocitos B teñen que competir entre eles polos sinais que promoven a súa supervivencia nos centros xerminais.
Diversidade dos clons de células B
[editar | editar a fonte]Como hai moitos e moi diversos patóxenos, moitos dos cales están mutando constantemente, é sorprendente que a maioría dos individuos permanezan libres de infeccións a maioría do tempo. Así, para o mantemento da saúde cómpre que o corpo recoñeza todos os patóxenos (os antíxenos que estes presentan ou producen) que poidan existir. Isto conséguese mantendo un conxunto enormemente grande (uns 109) de clons de células B, cada un dos cales reacciona contra un epítopo específico recoñecéndoo e producindo anticorpos contra el. Porén, en calquera momento moi poucos clons permanecen realmente receptivos ao seu epítopo específico. Así, todos os clons de células B combinados poden recoñecer aproximadamente 107 epítopos diferentes.[21] Ademais, durante toda a vida dun individuo, este require xeralmente a xeración de anticorpos contra moi poucos antíxenos en comparación co número que o corpo podería recoñecer e contra os que podería responder.[21]
Importancia do fenómeno
[editar | editar a fonte]Aumento da posibilidade de recoñecemento de antíxenos
[editar | editar a fonte]Se un antíxeno pode ser recoñecido por máis dun compoñente da súa estrutura, é menos probable que pase desapercibido ao sistema inmunitario.[nota 8] A mutación dos organismos patóxenos pode ter como resultado a modificación do aníxeno, e, por tanto, da estrutura do epítopo. Se o sistema inmunitario "lembra" como son os outros epítopos, o antíxeno e o organismo invasor, aínda serán recoñecidos e sometidos á resposta inmunitaria do corpo. Deste xeito, a resposta policlonal amplía o rango de patóxenos que se poden recoñecer.[24]
Limitación do sistema inmunitario ante virus que mutan rapidamente
[editar | editar a fonte]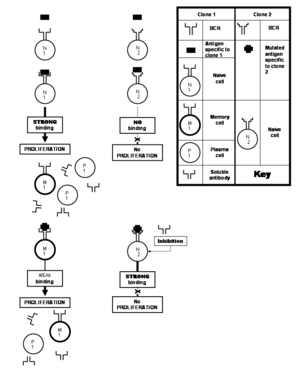
- Artigo principal: Pecado orixinal antixénico.
Moitos virus sofren fecuentes mutacións que orixinan cambios na composición de aminoácidos de importantes proteínas virais. Os epítopos localizados na proteína poden tamén sufrir alteracións nese proceso. Un epítopo así alterado únese con menos forza cos seus anticorpos específicos que o epítopo orixinal que estimulaba o sistema inmunitario. Isto é algo desafortunado porque as hipermutacións somáticas darían lugar a clons con capacidade de producir anticorpos solubles que se unirían ao epítopo alterado con suficiente avidez como para neutralizalo. Pero estes clons consistirían en células virxes ás que os anticorpos debilmente unidos producidos polo clon estimulado anteriormente non lles permiten proliferar. Esta teoría coñécese como o pecado orixinal antixénico.[21] Este fenómeno entra en funcionamento especialmente nas respostas inmunes contra virus como os da gripe, dengue e VIH.[25] Porén, esta limitación non está imposta polo fenómeno da resposta policlonal, senón contra ela por unha resposta inmune que está nesgada en favor de células de memoria experimentadas e en contra das células virxes novatas.
Aumento da posibilidade de reaccións autoinmunes
[editar | editar a fonte]- Artigo principal: Autoinmunidade.
Na autoinmunidade o sistema inmunitario recoñece por erro certas moléculas nativas do propio corpo como se fosen alleas, e desencadea unha resposta inmune contra elas. Como estas moléculas, que son compoñentes normais do corpo, sempre existen de forma natural no corpo, o ataque contra elas pode ser cada vez máis forte conforme pasa o tempo (similar ao que ocorre nas respostas inmunitarias secundarias). Ademais, moitos organismos presentan mimetismo molecular, o que comporta que mostren antíxenos na superficie celular que son antixenicamente similares a proteínas do hóspede. Isto ten dúas posibles consecuencias: primeiro, o organismo invasor pode ser considerado como un antíxeno propio e non ser atacado; ou en segundo lugar, os anticorpos producidos contra el uniranse tamén ás proteínas nativas propias imitadas. Os anticorpos atacarán os antíxenos propios e os tecidos que os albergan ao activárense varios mecanismos como o sistema do complemento e a citotoxicidade mediada por células dependente de anticorpos. Por tanto, canto máis amplo é o rango de especificidades dos anticorpos, maior é a posibilidade de que algún reaccione contra antíxenos propios (as moléculas nativas do corpo).[26][27]
Produción de anticorpos monoclonais
[editar | editar a fonte]- Artigo principal: Anticorpo monoclonal.
Os anticorpos monoclonais son moléculas de inmunoglobulinas estruturalmente idénticas entre si con idéntica especificidade de epítopo (todas co mesmo epítopo e coa mesma afinidade), a diferenza dos anticorpos policlonais, que mostran variadas afinidades para o mesmo epítopo. Normalmente non se producen na resposta inmune natural, senón só en enfermidades como o mieloma múltiple, ou son producidos por técnicas especializadas de laboratorio. Debido á súa especificidade, os anticorpos monoclonais utilízanse en certas aplicacións para cuantificar ou detectar a presenza de substancias (as cales actúan como antíxenos dos anticorpos monoclonais), e para dirixilos contra determinadas células (por exemplo, células cancerosas). Os anticorpos monoclonais son útiles en varias modalidades de diagnóstico (como a western blot e a inmunofluorescencia) e en certas terapias, especialmente do cancro e de doenzas cun compoñente autoinmune. Pero, como virtualmente todas as respostas na natureza son policlonais, isto fai que a produción dos enormemente útiles anticorpos monoclonais non sexa tan fácil.[8]
Historia
[editar | editar a fonte]As primeiras evidencias da presenza dunha substancia neutralizante no sangue que podía contrarrestar as infeccións atopouse cando Emil von Behring xunto con Kitasato Shibasaburō en 1890 desenvolveu un soro contra a difteria, enfermidade bacteriana na que as bacterias soltan unha toxina. Isto fixérono transferindo soro producido por animais inmunizados contra a difteria a animais que a padecían. Ao transferiren o soro curaron os animais infectados. Behring recibiu o Premio Nobel por este traballo en 1901.[28]
Nesa época non se coñecía a natureza química da substancia que estaba no sangue e proporcionaba esta protección. Unhas poucas décadas despois demostrouse que ese soro protector podía neutralizar e facer precipitar as toxinas, e aglutinar bacterias. Todas estas funcións foron atribuídas a diferentes substancias presentes no soro, e denominadas en consecuencia antitoxinas, precipitinas e aglutininas.[17] As tres substancias eran en realidade unha soa (proteínas gammaglobulinas), como demostrou Elvin A. Kabat en 1939. O ano anterior Kabat demostrara a heteroxeneidade dos anticorpos por medio de estudos de ultracentrifugación de soros de cabalos.[29]
Ata entón, a inmunidade mediada por células e a humoral eran consideradas teorías rivais para explicar a resposta inmunitaria, pero a primeira quedou atrás debido ao avance de certas técnicas.[17] A inmunidade mediada por células adquiriu novo impulso cando en 1942, Merrill Chase transferiu con éxito a inmunidade contra a tuberculose entre porcos ao transferirlles leucocitos.[17][30]
Posteriormente, en 1948, Astrid Fagraeus demostrou na súa tese de doutoramento que as células B plasmáticas eran as responsables da produción de anticorpos.[31] O papel dos linfocitos nas respostas mediadas por células e humorais foi demostrado por James Gowans en 1959.[30]
Para explicar a ampla variedade de antíxenos que pode recoñecer o sistema inmunitario, Paul Ehrlich en 1900 hipotetizara que uns "receptores de cadea lateral" preexistentes se unían a un determinado patóxeno e que esta interacción é a que inducía a célula que tiña o receptor a multiplicarse e producir máis copias do mesmo receptor. Esta teoría, chamada "a teoría selectiva" non se conseguiu probar durante as seguintes cinco décadas, e fora desafiada por varias "teorías instrucionais" alternativas, que estaban baseadas na noción de que un anticorpo adopta a súa estrutura efectiva ao pregarse arredor do antíxeno.[17] Porén, a finais da década de 1950, os traballos de tres científicos: Jerne, Talmage e Burnet (que modificaron amplamente a teoría inicial), deron lugar á teoría da selección clonal, que probou todos os elementos da hipótese de Ehrlich excepto que os receptores específicos que podían neutralizar o axente eran solubles e non estaban unidos a membranas.[17][30]
A teoría da selección clonal demostrouse que era correcta cando Gustav Nossal mostrou que unha célula B sempre producía un único anticorpo.[32]
En 1974, Rolf Zinkernagel e Peter C. Doherty demostraron o papel do MHC na presentación de antíxenos.[30]
Notas
[editar | editar a fonte]- Notas
- ↑ O termo "inoculación" úsase maiormente no contexto dunha inmunización activa, é dicir, a introdución deliberada da substancia antixéncia no hóspede. Pero en moitas discusións de doenzas infecciosas, é relativamente frecuente usar este termo para implicar un evento espontáneo (é dicir, sen a intervención humana) que ten como resultado a introdución do organismo causante no corpo, como por beber auga contaminada con Salmonella typhi, o axente causante da febre tifoide. En tales casos o organismo causante denomínase inóculo, e o número de organismos introducidos "dose do inóculo".
- ↑ A especificidade implica que dous patóxenos diferentes serán vistos polo sistema inmunitario como dúas entidades distintas, e serán contrarrestados usando distintas moléculas de anticorpos solubles.
- ↑ Proliferación neste contexto significa multiplicación por mitose e diferenciación.
- ↑ O complexo maior de histocompatibilidade é unha rexión xénica no ADN que codifica a síntese de moléculas do complexo maior de histocompatibilidade de clase I e de clase II e outras proteínas implicadas no funcionamento do sistema do complemento (MHC de clase III). Os primeiros dous produtos son importantes na presentación de antíxenos. A compatibilidade do MHC é algo esencial para realizar transplantes de órganos, e nos humanos tamén se chama antíxeno leucocitario humano (HLA).
- ↑ Aquí, intactas significa que se recoñece a proteína non dixerida e non que o parátopo do receptor da célula B se poña en contacto á vez coa estrutura completa da proteína; o parátopo permanecerá en contacto só cunha porción restrinxida do antíxeno exposto na súa superficie.
- ↑ Hai moitos tipos de células sanguíneas. A maneira máis común de clasificalas é de acordo coa súa aparencia vista ao microscopio óptico despois de seren tinguidas con colorantes químicos. Pero co avance da tecnoloxía apareceron novos métodos de clasificación. Un deles emprega anticorpos monoclonais, que poden unirse especificamente a cada tipo de célula. Ademais, o mesmo tipo de glóbulo branco expresa moléculas típicas súas na súa membrana plasmática en varios estadios do seu desenvolvemento. Os anticorpos monoclonais que poden unirse especificamente cunha determinada molécula da superficie celular considéranse un grupo ou cluster de diferenciación (CD). Calquera anticorpo monoclonal ou grupo de anticorpos monoclonais que non reaccionan con moléculas da superficie dos linfocitos coñecidas, senón cunha molécula da superfice aínda non recoñecida sería considerado un novo cluster de diferenciación e daríaselle un número. Cada cluster de diferenciación abréviase como CD seguindo dun número (que xeralmente indica a orde do seu descubrimento). Así, unha célula que posúa unha molécula de superficie (ligando) que se une especificamente a un cluster de diferenciación 4 denominaríase célula CD4+. Igualmente, unha célula CD8+ será aquela que posúa o ligando CD8 e se una a anticorpos monoclonais CD8.
- ↑ As células plasmáticas segregan anticorpos que se unen á mesma estrutura que estimulara a célula B en primeiro lugar, ao unirse ao seu receptor de célula B.
- ↑ Analogamente, se nun lugar ateigado de xente, se supón que temos que recoñecer unha determinada persoa, é mellor saber tantas características físicas desa persoa como sexa posible. Se coñecemos a persoa só polo seu corte de pelo, hai a posibilidade de pasar por alto esa persoa se esta cambia de peiteado. Mentres que, se ademais do corte de pelo coñecemos as características faciais e a roupa que vai levar posta determinado día, será moito máis fácil que non nos pase desapercibida.
- Referencias
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Goldsby, Richard; Kindt, TJ; Osborne, BA; Janis Kuby (2003). "Antigens (Chapter 3)". Immunology (Fifth ed.). New York: W. H. Freeman and Company. pp. 57–75. ISBN 0716749475.
- ↑ "Definition of Polyclonal from MedicineNet.com". Webster's New World Medical Dictionary. Arquivado dende o orixinal o 07 de agosto de 2012. Consultado o 2008-05-03.
- ↑ 3,0 3,1 Frank, Steven A. (2002). "Specificity and Cross-Reactivity (Chapter 4)". Immunology and Evolution of Infectious Disease. Princeton University. pp. 33–56. ISBN 0691095957. Consultado o 2008-06-23.
- ↑ "Etymology of "clone"". Online etymology dictionary. Consultado o 2008-06-26.
- ↑ Bansal, R.K. (2005). "Reproductive Cloning-An Act Of Human Rights Violation" (PDF). Journal of Indian Association of Forensic Medicine (Indian Association of Forensic Medicine) 27 (3): 971–973. Arquivado dende o orixinal (PDF) o 16 de decembro de 2019. Consultado o 2008-06-23.
- ↑ "Definition of inoculation". TheFreeDictionary.com (citing Dorland's Medical Dictionary for Health Consumers. © 2007 by Saunders, an imprint of Elsevier, Inc.). Consultado o 2008-06-10.
- ↑ 7,0 7,1 7,2 Pier, Gerald B. (2005) [1945]. "Molecular mechanisms of microbial pathogenesis (Capítulo 105)". En Kasper, Braunwald, Fauci, Hauser, Longo, Jameson. Harrison's Principles of Internal Medicine 1 (Sixteenth ed.). McGraw-Hill. p. 700. ISBN 0-07-123983-9.
- ↑ 8,0 8,1 8,2 8,3 8,4 Goldsby. "Organization and Expression of Immunoglobulin Genes (Chapter 5)". Immunology (Fifth ed.). New York. pp. 105–136. ISBN 0-7167-6764-3.
- ↑ Nairn, Roderick (2004) [1954]. "Immunology (Capítulo 8)". En Geo F. Brooks; Janet S. Butel; Stephen A. Morse. Jawetz, Melnick, & Adelberg's Medical Microbiology (Twenty-Third Edition International ed.). Lange publications/McGraw-Hill. pp. 133–135, 138–139. ISBN 0-07-123983-9.
- ↑ 10,0 10,1 10,2 Goldsby. "T-Cell Maturation, Activation and Differentiation (Chapter 10)". Immunology (Fifth ed.). pp. 221–246. ISBN 0-7167-6764-3.
- ↑ Nair, Deepak; Singh Kavita; Siddiqui Zaved; Nayak Bishnu; Rao Kanury; Salunke Dinakar (2002-01-09). "Epitope Recognition by Diverse Antibodies Suggests Conformational Convergence in an Antibody Response" (PDF). The Journal of Immunology (The American Association of Immunologists) 168 (5): 2371–2382. PMID 11859128. doi:10.4049/jimmunol.168.5.2371. Consultado o 2008-05-03.
- ↑ "Immunochemical Applications". Technical Tips. EMD biosciences. Arquivado dende o orixinal o 11 de abril de 2008. Consultado o 2008-05-07.
- ↑ Davis, Cheryl. "Antigens". Biology course. Western Kentucky University. Arquivado dende o orixinal o 29 de marzo de 2008. Consultado o 2008-05-12.
- ↑ Ceri, Howard. "Antigens". Immunology course. University of Calgary. Arquivado dende o orixinal o 05 de outubro de 2008. Consultado o 2008-05-12.
- ↑ Khudyakov, Yury; Howard A. Fields (2002). Artificial DNA: Methods and Applications. Florida: CRC Press. p. 227. ISBN 0-8493-1426-7.
- ↑ 16,0 16,1 16,2 Myers, CD (1991). "Role of B cell antigen processing and presentation in the humoral immune response" (PDF). The FASEB Journal 5 (11): 2547–2553. PMID 1907935. Consultado o 2008-06-20.
- ↑ 17,0 17,1 17,2 17,3 17,4 17,5 17,6 17,7 Goldsby. "Overview of the Immune System (Capítulo 1)". Immunology (Fifth ed.). pp. 1–23. ISBN 0-7167-6764-3.
- ↑ Goldsby. "Antigen Processing and Presentation (Chapter 8)". Immunology (Fifth ed.). pp. 188–194. ISBN 0-7167-6764-3.
- ↑ 19,0 19,1 Ojcius, DM; L Gapin; JM Kanellopoulos; P Kourilsky (setembro de 1994). "Is antigen processing guided by major histocompatibility complex molecules?" (PDF). The FASEB Journal 8 (5): 974–978. PMID 8088463. Consultado o 2008-06-20.
- ↑ Goldsby. "Cells and Organs of the Immune System (Chapter 2)". Immunology (Fifth ed.). pp. 24–56. ISBN 0-7167-6764-3.
- ↑ 21,00 21,01 21,02 21,03 21,04 21,05 21,06 21,07 21,08 21,09 21,10 Goldsby. "B-Cell Generation, Activation and Differentiation (Chapter 11)". Immunology (Fifth ed.). New York. pp. 247–275. ISBN 0-7167-6764-3.
- ↑ McPhee, Stephen; Ganong, William (2006). Pathophysiology of Disease: An Introduction to Clinical Medicine. Lange Medical Books/McGraw-Hill. p. 39. ISBN 0-07-144159-X.
- ↑ Cziko, Gary (1995). "The Immune System: Selection by the Enemy". Without Miracles: Universal Selection Theory and the Second Darwinian Revolution (Fifth ed.). Massachusetts: MIT Press. pp. 39–48. ISBN 0-262-03232-5. Arquivado dende o orixinal o 19 de abril de 2012. Consultado o 2008-05-12.
- ↑ Greener, Mark (2005-02-14). "Monoclonal antibodies (MAbs) turn 30". The Scientist (Philadelphia: SAGE Publications) 19 (3): 14. Arquivado dende o orixinal o 31 de agosto de 2007. Consultado o 2008-06-06.
- ↑ Deem, Michael. "Michael W. Deem". Official Web Page. Rice University. Arquivado dende o orixinal o 04 de xullo de 2008. Consultado o 2008-05-08.
- ↑ Granholm, Norman; Tito Cavallo (1992). "Autoimmunity, Polyclonal B-Cell Activation and Infection (abstract)". Lupus (SAGE Publications) 1 (2): 63–74. PMID 1301966. doi:10.1177/096120339200100203. Arquivado dende o orixinal o 04 de abril de 2008. Consultado o 2008-05-04.
- ↑ Montes CL, Acosta-Rodríguez EV, Merino MC, Bermejo DA, Gruppi A. "Polyclonal B cell activation in infections: infectious agents' devilry or defense mechanism of the host? (abstract)". Journal of Leukocyte Biology (Society for Leukocyte Biology) 82 (5): 1027–1032. PMID 17615380. doi:10.1189/jlb.0407214. Arquivado dende o orixinal o 13 de abril de 2009. Consultado o 2008-05-04.
- ↑ "Emil von Behring: The Founder of Serum Therapy". Nobel Prize in Medicine. Arquivado dende o orixinal o 12 de xuño de 2008. Consultado o 2008-06-23.
- ↑ Mage, Rose G.; Ten Feizi. "Elvin A. Kabat". Biographical memoirs. Consultado o 2008-06-23.
- ↑ 30,0 30,1 30,2 30,3 Greenberg, Steven. "A Concise History of Immunology" (PDF). Consultado o 2008-06-23.
- ↑ "MTC News" (PDF). Karolinska Institutet. Arquivado dende o orixinal (PDF) o 12 de febreiro de 2012. Consultado o 2008-06-23.
- ↑ Turner, Stephen (outubro de 2007). "One POWERFUL Idea" (PDF). Australasian Science. Arquivado dende o orixinal (PDF) o 21 de xullo de 2008. Consultado o 2008-06-23.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Anticorpo policlonal
- Procesamento de antíxenos
- Antisoro, unha preparación de anticorpos policlonais usada para tratar envelenamentos por picaduras
Bibliografía
[editar | editar a fonte]- Goldsby, Richard; Kindt, TJ; Osborne, BA; Janis Kuby (2003). Immunology (Fifth ed.). New York: W. H. Freeman and Company. ISBN 0-7167-4947-5.
- Kishiyama, Jeffery L. (2006) [1997]. "Disorders of the Immune system (Chapter 3)". En Stephen J. McPhee; William F. Ganong. Pathophysiology of Disease: An Introduction to Clinical Medicine (5 ed.). Lange Medical Books/McGraw-Hill. pp. 32–58. ISBN 0-07-110523-9.
- Nairn, Roderick (2004) [1954]. "Immunology (Chapter 8)". En Geo F. Brooks; Janet S. Butel; Stephen A. Morse. Jawetz, Melnick, & Adelberg's Medical Microbiology (Twenty-Third Edition International ed.). Lange publications/McGraw-Hill. pp. 133–135, 138–139. ISBN 0-07-123983-9.