Neurotoxina

As neurotoxinas son toxinas que causan graves danos que levan á destrución do tecido nervioso, polo que causan neurotoxicidade.[3] As neurotoxinas son un amplo conxunto de compostos químicos exóxenos neuroloxicamente nocivos[4] que poden afectar a función do sistema nervioso en desenvolvemento ou maduro.[5] O termo pode tamén utilizarse para clasificar certos compostos endóxenos, os cales, cando están presentes en cantidades anoemais, poden ser neuroloxicamente tóxicos.[4] Aínda que as neurotoxinas adoitan ser neuroloxicamente destrutuivas, a súa capacidade de afectar especificamente compoñentes neurais é importante no estudo dos sistemas nerviosos.[6] Exemplos comúns de neurotoxinas son o chumbo,[7] etanol (alcohol etílico das bebidas alcohólicas),[8] glutamato,[9] óxido nítrico,[10] toxina botúlica (compoñente activo do Botox),[11] toxina tetánica,[12] e tetrodotoxina.[6] Algunhas substancias como o óxido nítrico e o glutamato son, en realidade, esenciais para o correcto funcionamento do corpo e só exercen efectos neurotóxicos a concentracións excesivas.
As neurotoxinas inhiben o control das neuronas sobre as concentacións dos ións e o seu paso a través da membrana plasmática,[6] ou a comunicación entre as neuronas na sinapse.[13] A patoloxía local da exposición a unha neurotoxina adoita presentar excitotoxicidade neuronal ou apoptose,[14] pero pode tamén incluír danos nas células gliais.[15] As manifestacións macroscópicas da exposición a neurotoxinas poden ser danos estendidos polo sistema nervioso central causantes de discapacidade intelectual,[5] trastornos persistentes da memoria,[16] epilepsia e demencia.[17] Ademais, os danos no sistema nervioso periférico causados polas neurotoxinas, como as neuropatías ou miopatías son comúns. Existen diversos tratamentos que serven para atenuar os danos causados polas neurotoxinas, como a administración de antioxidantes[8] ou antitoxinas.[18]
Neurotoxicidade
[editar | editar a fonte]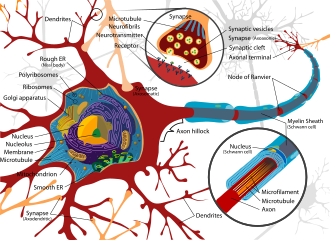
A exposición das sociedades humanas a neurotoxinas coñécese desde antigo nas civilizacións. Un exemplo notable é a posible exposición significativa ao chumbo durante a época do Imperio Romano, como resultado da construción de redes de tubaxes de chumbo para canalizar a auga potable e o costume de ferver viño avinagrado en potas de chumbo para adozalo, proceso que xeraba acetato de chumbo, coñecido como o "azucre de chumbo".[19]
O tecido nervioso é moi susceptible incluso a pequenas perturbacións na súa contorna. As propiedades que levan esta susceptibilidade inclúen unha elevada área superficial das neuronas, un alto contido lipídico que retén as toxinas lipófilas, un elevado fluxo sanguíneo no cerebro que incrementa a exposición ás toxinas e a persistencia das neuronas (que non se dividen) durante a vida do individuo, orixinando un conxunto de danos.[20] Por outra parte, o sistema nervioso ten diversos mecanismos deseñados para protexelo de danos de orixe interna e externa, como a barreira hematoencefálica.
A barreira hematoencefálica é un exemplo claro de protección, que impide que as toxinas e outros compostos adversos cheguen ao cerebro.[21] Polo torrente sanguíneo poderían chegar ao cerebro neurotoxinas que foron inxeridas, que poden inducir a morte dun número significativo de neuronas. Porén, existen unhas células protectoras denominadas astrocitos que rodean os capilares cerebrais e absorben nutrientes do sangue e transpórtanos ás neuronas, polo que illan o cerebro de diversos compostos potencialmente daniños.[21]
Esta barreira crea unha capa hidrófoba impermeable arredor dos capilares do cerebro, que inhibe o transporte de compostos grandes ou hidrófilos. Ademais da barreira hematoencefálica, o plexo coroideo proporciona unha capa protectora contra a absorción de toxinas no cerebro. Os plexos coroideos son capas vascularizadas de tecidos que se encontran nos ventrículso cerebrais terceiro, cuarto e lateral, que, por medio da función das súas células do epéndima, son responsables da síntese de líquido cefalorraquídeo.[22] Os plexos coroideos, por medio do paso selectivo de ións e de nutrientes ao seu través e atrapando os metais pesados como o chumbo, manteñen un ambiente estritamente regulado no cerebro e medula espiñal.[21][22]

Algúns compostos, incluíndo certas neurotoxinas, ao seren hidrófobos e pequenos ou inhibiren a función dos astrocitos, conseguen penetrar no cerebro e induciren danos significativos. Os científicos teñen que afrontar o reto de identificar e tratar as neurotoxinas, o que incrementou o interese polos estudos clínicos e neurotoxicolóxicos.[23] Aínda que a neurotoxicoloxía clínica é en gran parte un campo en expansión, fixéronse grandes progresos na identificación de moitas neurotoxinas ambientais que levaron á clasificación de entre 750 e 1000 novos compostos potencialmente neurotóxicos.[20] Debido á importancia fundamental de encontrar neurotoxinas en ambientes comúns, desenvolvéronse protocolos específicos para testar e determinar os efectos neurotóxicos dos compostos, e os sistemas in vitro proporcionaron importantes melloras en comparación cos sistemas in vivo máis comúns no pasado. Exemplos de melloras inclúen ambientes uniformes e manexables, e a eliminación de efectos contaminantes do metabolismo sistémico.[23] Porén, os sistemas in vitro tamén teñen problemas, xa que foi difícil replicar axeitadamente as complexidades do sistema nervioso, como as interaccións que axudan a astrocitos e neuronas a crear a barreira hematoencefálica.[24] Para complicar aínda máis o proceso de determinar as neurotoxinas cando se comproban in vitro, a neurotoxicidade e citotoxicidade poden ser difíciles de distinguir, xa que pode que non sexa posible expoñer as neuronas directamente aos compostos in vivo, como se fai in vitro. Ademais, a resposta das células aos compostos químicos pode non servir para distinguir entre neutotoxinas e citotoxinas, xa que os síntomas como o estrés oxidativo ou as modificacións no esqueleto poden ocorrer en resposta a ambos.[25]
Nun esforzo para afrontar esta complicación, propúxose recentemente que os brotes de neuritas (tanto axonais coma dendríticas) que aparecen en resposta á aplicación de certos compostos serven para distinguir con maior precisión entre as verdadeiras neurotoxinas e as citotoxinas en tests in vitro. Porén, debido a inexactitudes significativas asociadaa a este proceso, están tardando en conseguir un apoio xenaralizado.[26] Ademais, os mecanismos bioquímicos están sendo máis utilizados na comprobación de neurotoxinas, xa que eses compostos poden ser cribados para suficiencia para inducir o mecanismo celular da interferencia, como a inhibición da capacidade da acetilcolinesterase dos organofosfatos (incluídos o DDT e o gas sarin).[27] Aínda que os métodos para determinar a neurotoxicidade aínda requiren un desenvolvemento importante, a identificación dos síntomas da exposición a compostos nocivos e toxinas mellorou significativamente.
Aplicacións en neurociencias
[editar | editar a fonte]As neurotoxinas, aínda que son diversas en propiedades químicas e funcións, comparten a propiedade de actuar por medio dalgún mecanismo que orixina a alteración ou a destrución de compoñentes necesarios do sistema nervioso. Porén, as neurotoxinas, polo seu deseño poden ser útiles no campo das neurociencias. Como o sistema nervioso da maioría dos organismos é moi complexo e necesario para a supervivencia, foi a diana dos ataques químicos de depredadores e presas. Como as especies velenosas adoitan usar as súas neurotoxinas para dominar un predador ou presa moi rapidamente, as toxinas evolucionaron para ser moi específicas para as súas canles diana para que a toxina non se una facilmente a outras dianas.[28] As neurotoxinas proporcionan un medio efectivo polo cal certos elementos do sistema nervioso poden ser alcanzados de forma precisa e eficiente. Un exemplo inicial de estudar dianas baseándose no uso dunha neurotoxina utilizou a tetrodotoxina etiquetada radioactivamente para probar as canles de sodio e obter medidas exactas sobre a súa concentración ao longo das membranas celulares dos nervios.[28] Igualmente por medio do illamento de certas actividades das canles, as neurotoxinas proporcionaron unha maneira de mellorar o modelo de Hodgkin–Huxley orixinal da neurona, no cal se teorizaba que unha soa canle xenérica de sodio e potasio podía explicar boa parte do funcionamento do tecido nervioso.[28] A partir deste coñecemento básico, o uso de compostos comúns como a tetrodotoxina, o tetraetilamonio e as bungarotoxinas proporcionaron unha comprensión máis profunda dos distintos xeitos nos que se pode comportar unha neurona.
Mecanismos de actividade
[editar | editar a fonte]As neurotoxinas son compostos que afectan negativamente ao sistema nervioso; varios dos mecanismos por medio dos que actúan son a inhibición de procesos celulares da neurona. Estes procesos que quedan inhibidos van desde mecanismos de despolarización da membrana á comunicación interneuronal. Ao inhibiren a capacidade das neuronas de realizaren as súas funcións celulares habituais ou transmitiren un sinal á célula veciña, as neurotoxinas poden inducir unha parada no funcionamento do sistema nervioso sistémico, como no caso da toxina botúlica,[13] ou mesmo a morte do tecido nervioso.[29] O tempo necesario para que comecen a manifestarse os síntomas despois da exposición a unha neurotoxina pode varias segundo a toxina de que se trate, e no caso da toxina botúlica é de horas,[18] mentres que no caso do chumbo é de anos.[30]
| Clasificación das neurotoxinas | Neurotoxinas |
|---|---|
| Inhibidores das canles de sodio | Tetrodotoxina[6] |
| Inhibidores das canles de potasio | Tetraetilamonio[31] |
| Inhibidores das canles de cloro | Clorotoxina,[32] |
| Inhibidores das canles de calcio | Conotoxina[33] |
| Inhibidores da liberación de vesículas sinápticas | Toxina botúlica,[34] toxina tetánica[35] |
| Inhibidores de receptores | Bungarotoxina[36] |
| Agonistas de receptores | 25I-NBOMe[38] |
| Inhibidores da barreira hematoencefálica | Mercurio[40] |
| Interferencia co citoesqueleto | Arsénico,[41] amoníaco[42] |
| Citotoxicidade mediada por calcio | Chumbo[43] |
| Efectos múltiples | Etanol[44][45] |
| Fontes de neurotoxinas endóxenas | Óxido nítrico,[46] glutamato,[47] dopamina[48] |
Inhibidores
[editar | editar a fonte]Das canles de sodio
[editar | editar a fonte]Tetrodotoxina
[editar | editar a fonte]
A tetrodotoxina (TTX) é un veleno producido por algúns peixes pertencentes á orde dos tetraodontiformes, que inclúe os peixes globo, os mólidos e os diodóntidos.[49] No peixe globo, a TTX encóntrase no fígado, gónadas, intestinos e pel.[6][50] O consumo de TTX pode ser letal, e é unha forma de envelenamento en moitos países onde se comen os mencionados peixes. Entre os síntomas comúns da inxestión de TTX están a parestesia (xeralmente restrinxida á boca e os membros), debilidade muscular, náuseas e vómitos;[49] adoitan manifestarse aos 30 minutos da inxestión.[51] O mecanismo primario que fai que a TTX sexa tóxica é a inhibición do funcionamento das canles de sodio, o cal reduce a capacidade funcional das neuronas para comunicarse. Esta inhibición afecta principalmente a un conxunto de canles de sodio susceptibles coñecido como canles sensible á TTX (TTX-s), que tamén son as principais responsables de crear a corrente de sodio que impulsa a fase de despolarización do potencial de acción das neuronas.[6]
Outro tipo de canle de sodio é o das canles resistentes á TTX (TTX-r), que teñen unha sensibilidade limitada á TTX e atópanse fundamentalmente en axóns de pequeno diámetro como os das neuronas nociceptoras.[6] Cando se inxire unha cantidade significativa de TTX, esta únese ás canles de sodio das neuronas e reduce a permeabilidade da membrana ao sodio. Isto ten como resultado un incremento do limiar efectivo dos sinais excitatorios que cómpren para inducir un potencial de acción nunha neurona postsináptica.[6] O efecto deste incremento no limiar de sinalización é unha redución da excitabilidade da neurona postsináptica e a subseguinte perda da función motora e sensorial, o cal pode orixinar unha parálise e a morte. Aínda que a respiración asistida pode aumentar as posibilidades de supervivencia despois dunha exposición á TTX, actualmente non existe unha antitoxina. O uso do inhibidor da acetilcolinesterase Neostigmina ou o antagonista muscarínico da acetilcolina Atropina (que, non obstante, inhibe a actividade parasimpática), pode incrementar a actividade actividade nerviosa simpática dabondo como para aumentar as posibilidades de supervivencia despois da exposición á TTX.[49]
Das canles de potasio
[editar | editar a fonte]Tetraetilamonio
[editar | editar a fonte]O tetraetilamonio (TEA) é un composto que, igual que moitas neurotoxinas, foi identificado primeiramente polos seus efectos daniños sobre o sistema nervioso e ten a capacidade de inhibir o funcionamento dos nervios motores e, por tanto, da contracción da musculatura de maneira similar ao curare.[52] Ademais, mediante unha administración crónica de TEA, comprobouse que podía inducirse atrofia muscular.[52] Posteriormente, determinouse que o TEA funciona in vivo principalmente pola súa capacidade de inhibir tanto as canles de potasio responsables da corrente de potasio de saída rectificadora atrasada que se observa nun potencial de acción coma algunhas poboacións das canles de potasio dependentes do calcio.[31] É esta capacidade de inhibir o fluxo de potasio nas neuronas o que fixo do TEA unha das ferramentas máis importantes en neurociencia. Hipotetizouse que a capacidade do TEA de inhibir as canles de potasio deriva da súa estrutura similar á dos ións potasio.[52] É especialmente útil en neurociencia a súa capacidade específica de eliminar a actividade das canles de potasio, que permite estudar as contribucións que fan outras canles á resposta neuronal, como as canles de sodio reguladas por voltaxe.[53] Ademais dos seus moitos usos en investigación neurocientífica, o TEA é un tratamento efectivo para a enfermidade de Parkinson, xa que limita a progresión da enfermidade.[54]
Das canles de cloro
[editar | editar a fonte]Clorotoxina
[editar | editar a fonte]A clorotoxina (Cltx) é un composto activo que se encontra no veleno dos escorpións e é tóxico principalmente pola súa capacidade de inhibir a condutancia das canles de cloro.[32] A inxestión de volumes letais de Cltx causa parálise debido á alteración das canles de cloro. De xeito similar á toxina botúlica, a Cltx posúe un valor terapéutico importante. Demostrouse que a Cltx pode inhibir que os gliomas se infiltren no tecido nervioso san do cerebro, reducindo os danos causados polo potencial invasivo dos tumores.[55][56]
Das canles de calcio
[editar | editar a fonte]Conotoxina
[editar | editar a fonte]As conotoxinas son un tipo de velenos producidos polos caracois mariños conos e poden inhibir a actividade de varias canles iónicas como as de calcio, sodio ou potasio.[57][58] En moitos casos, as toxinas liberadas polos diferentes tipos de conos mariños inclúen diversos tipos de conotoxinas, que poden ser específicos para diferentes canles iónicas, creando así un veleno que pode realizar unha ampla interrupción da función nerviosa.[57] Un tipo de conotoxina, a ω-conotoxina (ω-CgTx) é altamente específica para as canles de calcio e é útil para illalos dun sistema en estudo.[59] Como o fluxo de calcio é necesario para a correcta excitabilidade dunha célula, calquera nivel significativo de inhibición podería impedir unha parte importante da súa funcionalidade. A ω-CgTx pode unirse a longo prazo e inhibir as canles de calcio dependentes de voltaxe localizadas nas membranas das neuronas, pero non as das células musculares.[60]
Da liberación de vesículas sinápticas
[editar | editar a fonte]Toxina botúlica
[editar | editar a fonte]
A toxina botúlica (BTX) é un grupo de neurotoxinas que consta de oito compostos distintos, denominados BTX-A, B, C, D, E, F, G, H, que son producidas pola bacteria Clostridium botulinum e orixinan unha parálise muscular.[61] Unha característica notable única da BTX é o seu uso terapéutico relativamente común no tratamento de trastornos de distonia e espasticidade,[61] e tamén induce a atrofia muscular,[11] malia ser a substancia máis velenosa coñecida.[18] A BTX funciona perifericamente inhibindo a liberacón de acetilcolina (ACh) na unión neuromuscular por medio da degradación das proteínas SNARE que cómpren para que se realice a fusión vesícula-membrana.[34] Como a toxina é moi activa bioloxicamente, unha dose estimada de 1μg/kg de peso corporal é dabondo para inducir a morte por asfixia.[13] Debido a esta alta toxicidade, as antitoxinas contra a BTX están sendo moi estudadas. Demostrouse que a capsaicina (composto activo responsable do sabor picante dos chiles) pode unirse ao receptor TRPV1 expresado en neuronas colinérxicas e inhibe os efectos tóxicos da BTX.[18]
Toxina tetánica
[editar | editar a fonte]A neurotoxina tetánica (TeNT) é un composto que reduce funcionalmente as transmisións inhibitorias no sistema nervioso orixinando tetania muscular. A TeNT é similar á BTX, e as súas estruturas e orixes son moi semellantes; ambas as dúas pertencen á mesma categoría de neurotoxinas clostridiais.[12] Igual que a BTX, a TeNT inhibe a comunicación interneuronal por medio da liberación de neurotransmisores vesiculares.[35] Unha notable diferenza entre os dos compostos é que mentres que a BTX inhibe a contracción muscular, a TeNT indúcea. Aínda que ambas as toxinas inhiben a liberación de vesículas nas sinapses neuronais, a razón para esta manifestación é diferente, xa que a BTX funciona principalmente no sistema nervioso periférico, mentres que a TeNT é principalmente activa no sistema nervioso central.[62] Isto é un resultado da migración da TeNT a través das motoneuronas ata as neuronas inhibitorias da medula espiñal despois de entrar nelas por endocitose.[63] O resultado é unha perda de función nas neuronas inhibitorias do sistema nervioso central que causa contraccións musculares sistémicas. De xeito similar ao prognóstico que ten unha dose letal de BTX, a TeNT orixina parálise e asfixia.[63]
Da barreira hematoencefálica
[editar | editar a fonte]Aluminio
[editar | editar a fonte]O comportamento neurotóxico do aluminio empeza coa súa entrada no sistema circulatorio, desde onde migra ao cerebro e inhibe algunhas das funcións esenciais da barreira hematoencefálica.[64] Unha perda de función da barreira hematoencefálica produce danos significativos ás neuronas do sistema nervioso central, xa que a barreira protexía o cerebro doutras toxinas que se encontran no sangue e xa non pode seguir realizando esta función. Aínda que este metal é neurotóxico, os seus efectos son xeralmente restrinxidos a pacientes que non poden elimiar o exceso de ións do sangue, como os que sofren insuficiencia renal.[65] Os pacientes que sofren toxicidade por aluminio poden presentar síntomas como trastornos na aprendizaxe e redución da coordinación motora.[66] Ademais, os niveis de aluminio sistémicos increméntanse coa idade e corelaciónanse coa enfermidade de Alzheimer, polo que está implicado como composto neurotóxico causante da enfermidade.[67] A pesar da súa coñecida toxicidade, o aluminio aínda se utiliza amplamente no empaquetado e preparación dos alimentos, mentres que o uso doutros metais tóxicos como o chumbo foi case completamente eliminado nestas industrias.
Mercurio
[editar | editar a fonte]O mercurio pode inducir danos no sistema nervioso central ao migrar ao cerebro ao cruzar a barreira hematoencefálica.[40] O mercurio está presente en diversos compostos, aínda que o metilmercurio (MeHg+), dimetilmercurio e dietilmercurio son as únicas formas significativamente neurotóxicas. O dietilmercurio e o dimetilmercurio son considerados algunhas das neurotoxinas máis potentes descubertas.[40] O MeHg+ entra no corpo normalmente por inxestión de alimentos mariños, xa que tende a concentrarse en organismos mariños situados no alto da cadea trófica.[68] O ión mercurio inhibe o transporte de aminoácidos e glutamato, o que pode producir efectos excitotóxicos.[69]
Agonistas e antagonistas de receptores
[editar | editar a fonte]Anatoxina-a
[editar | editar a fonte]Universidade de Nottingham |

As investigacións sobre a anatoxina-a, tamén chamada "Factor de Morte Moi Rápida" (abreviado VFDF, do inglés "Very Fast Death Factor"), empezou en 1961 despois de que ocorresen mortes de vacas que beberan auga dun lago no que se producira unha floración de algas, en Saskatchewan, Canadá.[70][71] Trátase dunha cianotoxina producida por polo menos catro xéneros de cianobacterias e informouse da súa presenza en Norteamérica, Europa, África, Asia e Nova Zelandia.[72]
Os efectos tóxicos da anatoxina-a progresan moi rapidamente porque actúa directamente sobre as neuronas. Os síntomas progresivos da exposición da anatoxina-a son a perda da coordinación, fasciculación, convulsións e morte rápida por paralise respiratoria. O tecido nervioso que comunica cos músculos contén un receptor chamado receptor de acetilcolina nicotínico. A estimulación destes receptores causa unha contracción muscular. A molécula de anatoxina-a ten unha forma que se axusta a este receptor, e deste modo imita ao neurotransmisor natural que utiliza normalmente o receptor, a acetilcolina. Unha vez que causou unha contracción, a anatoxina-a non permite que as neuronas volvan ao seu estado de repouso, porque non é degradada pola colinesterase, que normalmente realiza esta función. Como resultado, as células musculares contráense permanentemente, a comunicación entre o cerebro e os músculos queda alterada e a respiración pulmonar detense.[73][74]
Cando se descubriu, esta toxina foi chamada inicialmente Very Fast Death Factor (VFDF ou Factor de Morte Moi Rápida) porque cando era inxectado intraperitonealmente en ratos inducía tremores, parálise e a morte en poucos minutos. En 1977, determinouse a estrutura do VFDF, que era unha amina bicíclica alcaloide, e foi renomeado como anatoxina-a.[75][76] Estruturalmente, é similar á cocaína.[77] Hai un continuo interese sobre a anatoxina-a debido ao perigo que supón nas augas potables e de recreo e porque é unha molécula particularmente útil para investigar os receptores de acetilcolina no sistema nervioso.[78] A letalidade da toxina implica tamén que ten un alto potencial militar como arma toxicolóxica.[79]
Bungarotoxina
[editar | editar a fonte]A bungarotoxina é un composto que interacciona con receptores de acetilcolina nicotínicos (nAChRs), que constitúen unha familia de canles iónicas cuxa actividade depende de que se una a eles un neurotransmisor.[80] Existen diferentes formas de bungarotoxina producidas por serpes elápidas do xénero Bungarus, pero unha das formas correntemente usadas é a forma de cadea alfa longa, α-bungarotoxina, que se illa da serpe Bungarus fasciatus.[36] Aínda que a α-bungarotoxina é extremadamente tóxica se se inxire, demostrou ser moi útil en neurociencias porque é especialmente axeitada para illar nAChRs debido á súa alta afinidade con eses receptores.[36] Como existen múltiples formas de bungarotoxina, hai tamén distintas formas de nAChRs ás cales se pode unir, e a α-bungarotoxina é particularmente específica para o α7-nAChR.[81] O α7-nAChR funciona permitindo o fluxo de ión calcio cara ao interior das células e así, cando é bloqueado pola inxestión de bugarotoxina, producirá efectos daniños, porque a sinalización por acetilcolina quedará inhibida.[81] Igualmente, o uso de α-bungarotoxina pode ser moi útil en neurociencias cando o que se desexa é bloquear o fluxo de calcio para illar os efectos doutras canles. Ademais, diferentes formas de bungarotoxina poden ser útiles para estudar os nAChRs inhibidos e o seu fluxo de ión calcio resultante en diferentes sistemas do corpo. Por exemplo, a α-bungarotoxina é específica para os nAChRs que se encontra na musculatura e a κ-bungarotoxina é específica para os nAChRs que se encontran nas neuronas.[82]
Caramboxina
[editar | editar a fonte]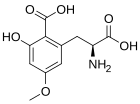
A caramboxina (CBX) é unha toxina que se encontra no froito da planta Averrhoa carambola (carambola). As persoas que padecen algún tipo de enfermidade renal son susceptibles a experimentar efectos neurolóxicos adversos como intoxicación, convulsións e mesmo a morte despois de comeren este froito ou beberen o seu zume. A caramboxina é unha nova toxína aminoacídica non peptídica que estimula os receptores de glutamato nas neuronas. A caramboxina é un agonista dos receptores de NMDA e de AMPA glutamatérxicos ionotrópicos con potentes propiedades excitatorias, convulsivas e neurodexenerativas.[83]
Curare
[editar | editar a fonte]O termo "curare" é ambiguo porque foi utilizado para describir varios velenos que no momento do seu nomeamento non se coñecían por separado tal como se coñecen hoxe. No pasado significaba veleno utilizado por certas tribos indias de América do Sur como pezoña para as súas frechas e dardos, pero despois pasou a significar un tipo de veleno específico que actúa sobre as unións neuromusculares inhibindo a súa sinalización, polo que induce a relaxación muscular.[84] Este tipo de neurotoxina comprende diversos velenos, aínda que todos eles foron orixinalmente purificados de plantas orixinarias de América do Sur.[84] O efecto co cal se asocia o curare inxectado é a parálise muscular con resultado de morte.[85] O curare funciona inhibindo os receptores de acetilcolina nicotínicos na unión neuromuscular. Normalmente, estas canles receptoras permiten que os ións sodio entren nas células musculares para iniciar un potencial de acción que orixina a contracción muscular. Como bloquea os receptores que causan a contracción, foi uilizado polos anestesistas para causar relaxación muscular.[86]
Interferencia co citoesqueleto
[editar | editar a fonte]Arsénico
[editar | editar a fonte]O arsénico é unha neurotoxina que xeralmente se concentra en áreas expostas á escorredura agrícola, sitios mineiros e fundicións (Martinez-Finley 2011). Un dos efectos da inxestión de arsénico durante o desenvolvemento do sistema nervioso é a inhibición do crecemento das neurita,[87] o cal pode acontecer nos sistemas nerviosos central e periférico.[88] Esta inhibición do crecemento das neuritas pode con frecuencia orixinar defectos na migración neural, e cambios morfolóxicos signiicativos nas neuronas durante o desenvolvemento,[89], que causan a miúdo defectos no tubo neural en neonatos.[90] O arsenito é un metabolito do arsénico que se forma despois da inxestión de arsénico e presenta toxicidade para as neuronas nunhas 24 horas despois da exposición. O mecanismo desta citoxicidade funciona por medio de incrementos nos niveis de calcio intracelular nas neurona inducidos polo arsenito, o cal pode despois reducir o potencial transmembrana mitocondrial que activa as caspases, desencadeando a morte celular.[89] Outra función coñecida do arsenito é a súa capacidade de destruír o citoesqueleto por medio da inhibición do transporte de neurofilamentos.[41] Isto é particularmente destrutivo, xa que os neurofilamentos se utilizan no soporte e estrutura da célula. Porén, a administración de litio demostrou ser prometedora para recuperar parte da motilidade perdida dos neurofilamentos.[91] Ademais, igual que outros tratamentos con neurotoxinas, a administración de certos antioxidantes pode ser beneficiosa para reducir a neurotoxicidade do arsénico inxerido.[89]
Amoníaco
[editar | editar a fonte]
A toxicidade do amoníaco pode producirse cando este conposto entra por dúas posibles vías de administración: consumo ou trastornos internos como a insuficiencia hepática.[92][93] Un caso notable no cal a toxicidade do amoníaco é común é na resposta á cirrose hepática, que ten como resultado encefalopatía hepática, e pode causar edema cerebral[94]. Este edema cerebral pode ser o resultado da remodelación das células nerviosas. Como consecuencia do incremento da súa concentración, a actividade do amoníaco in vivo induce o inchamento dos astrocitos no cerebro por medio do incremento da produción de GMPc nas células, que causa modificacións citoesqueléticas mediadas pola proteína quinase dependente de GMPc.[42] O efecto resultante desta toxicidade pode ser a redución do metaboismo enerxético cerebral e do seu funcionamento. Os efectos tóxicos do amoníaco sobre a remodelación dos astrocitos poden ser reducidos pola administración de L-carnitina.[92] Esta remodelación dos astrocitos parece ser mediada pola transición de permeabilidade mitocondrial inducida polo amoníaco. Esta transición mitocondrial é un resultado directo da actividade da glutamina, un composto que se forma a partir do amoníaco in vivo.[95] A administración de antioxidantes ou inhibidores da glutaminase pode reducir esta transición mitocondrial e potencialmente tamén a remodelación dos astrocitos.[95]
Citotoxicidade mediada polo calcio
[editar | editar a fonte]
Chumbo
[editar | editar a fonte]O chumbo é unha potente neurotoxina cuxa toxicidade é coñecida desde hai miles de anos.[96] Aínda que os efectos neurotóxicos do chumbo poden encontrarse en adultos e nenos, o desenvolvemento do cerebro é particularmente susceptible aos danos inducidos polo chumbo, efectos que poden incluír a apoptose e excitotoxicidade.[96] Un mecanismo subxacente polo cal o chumbo pode causar danos é a súa capacidade de ser transportado polas bombas de ATPase de calcio a través da barreira hematoencefálica, permitindo un contacto directo coas fráxiles células do sistema nervioso central.[97] A neurotoxicidade é resultado da capacidade do chumbo de actuar de maneira similar aos iós calcio, xa que o chumbo concentrado causa a captación celular de calcio, que altera a homeostase celular e induce a apoptose.[43] É este incremento de calcio intracelular o que activa a proteína quinase C (PKC), que se manifesta como déficits de aprendizaxe en nenos como resultado dunha exposición temperán ao chumbo.[43] Ademais de inducir a apoptose, o chumbo inbibe a sinalización das interneuronas por medio da alteración da liberación de neurotransmisores mediada polo calcio.[98]
Neurotoxinas con múltiples efectos
[editar | editar a fonte]Etanol
[editar | editar a fonte]
Como neurotoxina, o etanol induce danos no sistema nervioso e afecta o corpo de diversas maneiras. Os efectos coñecidos da exposición ao etanol son tanto transitorios coma consecuencias duradeiras. Algúns dos efectos duradeiros son a redución a longo prazo da neuroxénese no hipocampo,[99][100] unha extensa atrofia cerebral,[101] e inflamación inducida no cerebro.[102] A inxestión crónica de etanol induce ademais a reorganización dos constituíntes da membrana celular, que causa que na bicapa lipídica se incrementen as concentracións de colesterol e graxas saturadas.[45] Isto é importante porque o transporte de neurotransmisores pode ser alterado ou impedido por inhibición do transporte vesicular, causando un funcionamento reducido da rede neural. Un exemplo significativo de redución da comunicación interneuronal é a capacidade do etanol de inhibir os receptores de NMDA no hipocampo, tendo como resultado a redución da potenciación a longo prazo e da adquisición da memoria.[44] O NMDA xoga un papel importante na potenciación a longo prazo e consecuentemente na formación da memoria.[103] Porén, cunha inxestión crónica de etanol a susceptibilidade destes receptores de NMDA para inducir potenciación a longo prazo increméntase nas neuronas dopaminérxicas mesolímbicas de maneira dependente de inositol 1,4,5-trifosfato (IP3).[104] Este reorganización pode causar citotoxicidade neuronal tanto por hiperactivación de neuronas postsinápticas coma por adicción inducida polo consumo continuo de etanol. Ademais, o etanol reduce directamente a acumulación de ión calcio intracelular por medio da inhibición da actividade do receptor de NMDA e así reduce a capacidade de aparición da potenciación ao longo prazo.[105]
Ademais dos efectos neurotóxicos do etanol nos organismos maduros, a inxestión crónica pode inducir graves defectos do desenvolvemento. As primeiras probas da conexión entre o consumo crónico de etanol pola nai e os defectos nos seus fillos presentáronse en 1973.[106] Debido a este traballo definiuse a síndrome alcohólica fetal, unha doenza caracterizada por aberracións morfoxenéticas comúns, como defectos na formación craniofacial, o desenvolvemento dos membros e a formación do sistema cardiovascular. A magnitude da neurotoxicidade do etanol nos fetos orixinan a síndrome alcohólica fetal que depende dos niveis de antioxidantes no cerebro, como a vitamina E.[107] Como o cerebro fetal é relativamente fráxil e susceptible de inducir estreses, os graves efectos deletéreos da exposición ao alcohol poden verse en importantes áreas como o hipocampo e o cerebelo. A gravidade destes efectos é directamente dependente da cantidade e frecuencia do consumo de etanol pola nai e o estadio do desenvolvemento do feto.[108] Sábese que a exposición ao etanol ten como resultado a redución dos niveis de antioxidantes, disfunción mitocondrial,[109] e, finalmente, a morte neuronal, aparentemente como resultado do incremento da xeración de especies reactivas do oxíxeno.[29] Este é un mecanismo plausible, xa que hai unha redución de encimas antioxidantes no cerebro fetal, como a catalase e peroxidase.[110] Apoia esta explicación que a administración de altos niveis de vitamina E na dieta causa unha diminución ou eliminación dos efectos neurotóxicos inducidos polo etanol nos fetos.[8]
n-Hexano
[editar | editar a fonte]o n-hexano é unha neurotoxina que foi responsable do envelenamento de varios traballadores en fábricas electrónicas chinesas en 2010.[111][112][113][114]
Neurotoxinas selectivas de receptor
[editar | editar a fonte]MPP+
[editar | editar a fonte]O MPP+ é o metabolito tóxico do MPTP, que é unha neurotoxina selectiva que interfire coa fosforilación oxidativa en mitocondrias inhibindo o complexo I, que orixina a depleción do ATP e a subseguinte morte celular. Isto ocorre exclusivamente en neuronas dopaminérxicas da substancia negra, causando parkinsonismo permanente en suxeitos expostos 2 ou 3 días despois da súa administración.
Fontes de neurotoxinas endóxenas
[editar | editar a fonte]A diferenza da maioría das fontes comúns de neurotoxinas, que o corpo capta por inxestión, as neurotoxinas endóxenas orixínanse in vivo dentro do corpo. Ademais, aínda que a maioría dos velenos e neurotoxinas exóxenas raramente posúen capacidades útiles in vivo, as neurotoxinas endóxenas son utilizadas habitualemnte polo corpo de maneira útil e saudable como parte do funcionamento normal do corpo, como o óxido nítrico, que se usa na comunicación celular.[115] Só cando os compostos endóxenos están en concentracións anormalmente altas dan lugar a efectos perigosos.[9]
Óxido nítrico
[editar | editar a fonte]Aínda que o óxido nítrico (NO) é usado normalmente polo sistema nervioso na comunicación e sinalización interneuronal, pode ser activo en mecanismos que causan isquemia no cerebro.[115] A neurotoxicidade do NO está baseada na súa importancia na excitotoxicidade do glutamato, xa que o NO é xerado de maneira dependente do calcio en resposta á activación do NMDA mediada polo glutamato, que ocorre a unha taxa elevada na excitotoxicidade do glutamato.[46] Aínda que o NO facilita o incremento de fluxo sanguíneo a rexións potencialmente isquémicas do cerebro, pode tamén incrementar o estrés oxidativo,[116] inducindo danos no ADN e apoptose.[117] Así, un incremento da presenza de NO nunha área isquémica do sistema nervioso central pode producir efectos tóxicos significativos.
Glutamato
[editar | editar a fonte]O glutamato, igual que o óxido nítrico, é un composto producido endoxenamente utilizado polas neuronas para funcionar normalmente, e está presente en pequenas concentracións na materia gris do sistema nervioso central.[9] Un dos usos máis notables do glutamato endóxeno é como neurotransmisor excitatorio.[47] Porén, cando está máis concentrado, o glutamato convértese en tóxico para as neuronas que o rodean. Esta toxicidade pode ser o resultado da súa letalidade directa sobre as neuronas ou a consecuencia do fluxo de calcio inducido nas neuronas que orixina o inchamento e necrose.[47] Estes mecanismos parecen xogar un importante papel en doenzas e complicacións como a enfermidade de Huntington, epilepsia e accidente cerebrovascular.[9]
Dopamina
[editar | editar a fonte]A dopamina é un composto endóxeno que se utiliza como neurotransmisor para modular a recompensa que se espera. A dopamina pode matar neuronas ao interferir coa cadea de transporte electrónico das neuronas. Esta interferencia causa a inhibición da respiración celular, que leva á morte neuronal.
Notas
[editar | editar a fonte]- ↑ Sivonen, K (1999). "Toxins produced by cyanobacteria". Vesitalous 5: 11–18.
- ↑ Scottish Government Blue-Green Algae (Cyanobacteria) in Inland Waters: Assessment and Control of Risks to Public Health Retrieved 15 December 2011.
- ↑ Dorland's Medical Dictionary for Health Consumers
- ↑ 4,0 4,1 Spencer 2000
- ↑ 5,0 5,1 Olney 2002
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 Kiernan 2005
- ↑ Lidsky 2003
- ↑ 8,0 8,1 8,2 Heaton; Barrow, Marieta; Mitchell, J. Jean; Paiva, Michael (2000). "Amelioration of Ethanol-Induced Neurotoxicity in the Neonatal Rat Central Nervous System by Antioxidant Therapy". Alcoholism: Clinical and Experimental Research 24 (4): 512–18. doi:10.1111/j.1530-0277.2000.tb02019.x.
- ↑ 9,0 9,1 9,2 9,3 Choi 1987
- ↑ Zhang 1994
- ↑ 11,0 11,1 Rosales, Raymond L.; Arimura, Kimiyoshi; Takenaga, Satoshi; Osame, Mitsuhiro (1996). "Extrafusal and Intrafusal Muscle Effects in Experimental Botulinum Toxin-A Injection". Muscle & Nerve 19 (4): 488–96. doi:10.1002/(sici)1097-4598(199604)19:4<488::aid-mus9>3.0.co;2-8.
- ↑ 12,0 12,1 Simpson 1986
- ↑ 13,0 13,1 13,2 Arnon 2001
- ↑ Dikranian 2001
- ↑ Deng 2003
- ↑ Jevtovic-Todorovic 2003
- ↑ Nadler 1978
- ↑ 18,0 18,1 18,2 18,3 Thyagarajan 2009
- ↑ Hodge 2002
- ↑ 20,0 20,1 Dobbs 2009
- ↑ 21,0 21,1 21,2 Widmaier, Eric P., Hershel Raff, Kevin T. Strang, and Arthur J. Vander (2008) Vander's Human Physiology: the Mechanisms of Body Function.' Boston: McGraw-Hill Higher Education.
- ↑ 22,0 22,1 Martini 2009
- ↑ 23,0 23,1 Costa 2011
- ↑ Harry 1998
- ↑ Gartlon 2006
- ↑ Radio, Nicholas M.; Mundy, William R. (2008). "Developmental Neurotoxicity Testing in Vitro: Models for Assessing Chemical Effects on Neurite Out-growth". NeuroToxicology 29 (3): 361–376. PMID 18403021. doi:10.1016/j.neuro.2008.02.011.
- ↑ Lotti 2005
- ↑ 28,0 28,1 28,2 Adams 2003
- ↑ 29,0 29,1 Brocardo 2011
- ↑ Lewendon 2001
- ↑ 31,0 31,1 Haghdoost-Yazdi 2011
- ↑ 32,0 32,1 DeBin 1993
- ↑ McClesky 1987
- ↑ 34,0 34,1 Garcia-Rodriguez 2011
- ↑ 35,0 35,1 Williamson 1996
- ↑ 36,0 36,1 36,2 Dutertre 2006
- ↑ Koller 1988
- ↑ Rutgrere 2012
- ↑ Roller 1994
- ↑ 40,0 40,1 40,2 Aschner 1990
- ↑ 41,0 41,1 DeFuria 2006
- ↑ 42,0 42,1 Konopacka 2009
- ↑ 43,0 43,1 43,2 Bressler 1999
- ↑ 44,0 44,1 Lovinger, D.; White, G.; Weight, F. (1989). "Ethanol Inhibits NMDA-activated Ion Current in Hippocampal Neurons". Science 243 (4899): 1721–724. PMID 2467382. doi:10.1126/science.2467382.
- ↑ 45,0 45,1 Leonard, B. E. (1986). "Is Ethanol a Neurotoxin?: the Effects of Ethanol on Neuronal Structure and Function". Alcohol and Alcoholism 21 (4): 325–38. doi:10.1093/oxfordjournals.alcalc.a044638.
- ↑ 46,0 46,1 Garthwaite 1988
- ↑ 47,0 47,1 47,2 Choi 1990
- ↑ Ben-Shachar D, Zuk R, Glinka Y (1995). "Dopamine neurotoxicity: inhibition of mitochondrial respiration". J. Neurochem. 64 (2): 718–23. PMID 7830065. doi:10.1046/j.1471-4159.1995.64020718.x.
- ↑ 49,0 49,1 49,2 Chowdhury, F. R.; Ahasan, H A M. Nazmul; Rashid, A K M. Mamunur; Mamun, A. Al; Khaliduzzaman, S. M. (2007). "Tetrodotoxin Poisoning: a Clinical Analysis, Role of Neostigmine and Short-term Outcome of 53 Cases". Singapore Medical Journal 48 (9): 830–33.
- ↑ Ahasan 2004
- ↑ Lau 1995
- ↑ 52,0 52,1 52,2 Standfield 1983
- ↑ Roed 1989
- ↑ Haghdoost-Yasdi 2011
- ↑ Deshane 2003
- ↑ Soroceanu 1998
- ↑ 57,0 57,1 Jacob 2010
- ↑ Olivera 1987
- ↑ Cruz 1986
- ↑ McCleskey 1987
- ↑ 61,0 61,1 Brin, Mitchell F (1997) "Botulinum Toxin: Chemistry, Pharmacology, Toxicity, and Immunology." Muscle & Nerve, 20 (S6): 146–68.
- ↑ Montecucco 1986
- ↑ 63,0 63,1 Pirazzini 2011
- ↑ Banks 1988
- ↑ King 1981
- ↑ Rabe 1982
- ↑ Walton 2006
- ↑ Chan 2011
- ↑ Brookes 1988
- ↑ Carmichael 1978
- ↑ Carmichael 1975
- ↑ Yang 2007
- ↑ Wood 2007
- ↑ National Center for Environmental Assessment
- ↑ Devlin 1977
- ↑ Moore 1977
- ↑ Metcalf 2009
- ↑ Stewart 2008
- ↑ Dixit 2005
- ↑ Tsetlin 2003
- ↑ 81,0 81,1 Liu 2008
- ↑ Hue 2007
- ↑ Garcia-Cairasco, N.; Moyses-Neto, M.; Del Vecchio, F.; Oliveira, J. A. C.; Dos Santos, F. L.; Castro, O. W.; Arisi, G. M.; Dantas, M. R.; Carolino, R. O. G.; Coutinho-Netto, J.; Dagostin, A. L. A.; Rodrigues, M. C. A.; Leão, R. M.; Quintiliano, S. A. P.; Silva, L. F.; Gobbo-Neto, L.; Lopes, N. P. (2013). "Elucidating the Neurotoxicity of the Star Fruit". Angewandte Chemie International Edition 52 (49): 13067–13070. PMID 24281890. doi:10.1002/anie.201305382.
- ↑ 84,0 84,1 Bisset 1992
- ↑ Schlesinger 1946
- ↑ Griffith, Harold R.; Johnson, G. Enid (1942). "The Use Of Curare In General Anesthesia". Anesthesiology 3 (4): 418–420. doi:10.1097/00000542-194207000-00006.
- ↑ Liu 2009
- ↑ Vahidnia 2007
- ↑ 89,0 89,1 89,2 Rocha 2011
- ↑ Brender 2005
- ↑ DeFuria 2007
- ↑ 92,0 92,1 Matsuoka 1991
- ↑ Buzanska (2000)
- ↑ Haussinger 2006
- ↑ 95,0 95,1 Norenberg 2004
- ↑ 96,0 96,1 Lidskey 2003
- ↑ Bradbury 1993
- ↑ Lasley 1999
- ↑ Taffe 2010
- ↑ Morris 2009
- ↑ Bleich 2003
- ↑ Blanco 2005
- ↑ Davis 1992
- ↑ Bernier 2011
- ↑ Takadera 1990
- ↑ Jones 1973
- ↑ Mitchell 1999
- ↑ Gil-Mohapel 2010
- ↑ Chu 2007
- ↑ Bergamini 2004
- ↑ Workers poisoned while making iPhones ABC News, October 25, 2010
- ↑ Dirty Secrets Arquivado 2017-05-25 en Wayback Machine. ABC Foreign Correspondent, 2010-Oct-26
- ↑ Mr Daisey and the Apple Factory, This American Life, January 6, 2012
- ↑ Occupational Safety and Health Guideline for n-Hexane Arquivado 2011-12-18 en Wayback Machine., OSHA.gov
- ↑ 115,0 115,1 Iadecola 1998
- ↑ Beckman 1990
- ↑ Bonfoco 1995
- Referencias
- Adams, Michael E.; Olivera, Baldomero M. (1994). "Neurotoxins: Overview of an Emerging Research Technology". Trends in Neurosciences 17 (4): 151–55. doi:10.1016/0166-2236(94)90092-2.
- Arnon, Stephen S.; Schechter, Robert; Inglesby, Thomas V.; Henderson, Donald A.; Bartlett, John G.; Ascher, Michael S.; Eitzen, Edward; Fine, Anne D.; Hauer, Jerome; Layton, Marcelle; Lillibridge, Scott; Osterholm, Michael T.; O'Toole, Tara; Parker, Gerald; Perl, Trish M.; Russell, Philip K.; Swerdlow, David L.; Tonat, Kevin (2001). "Botulinum Toxin as a Biological Weapon". The Journal of the American Medical Association 285 (8): 1059–069. doi:10.1001/jama.285.8.1059.
- Aschner, M.; Aschner, J. (1990). "Mercury Neurotoxicity: Mechanisms of Blood-brain Barrier Transport". Neuroscience & Biobehavioral Reviews 14 (2): 169–76. doi:10.1016/s0149-7634(05)80217-9.
- Banks, William A.; Kastin, Abba J. (1989). "Aluminum-Induced Neurotoxicity: Alterations in Membrane Function at the Blood-Brain Barrier". Neuroscience & Biobehavioral Reviews 13 (1): 47–53. PMID 2671833. doi:10.1016/s0149-7634(89)80051-x.
- Baum-Baicker, Cynthia (1985). "The Health Benefits of Moderate Alcohol Consumption: A Review of the Literature". Drug and Alcohol Dependence 15 (3): 207–27. doi:10.1016/0376-8716(85)90001-8.
- Beckman, J. S. (1990). "Apparent Hydroxyl Radical Production by Peroxynitrite: Implications for Endothelial Injury from Nitric Oxide and Superoxide". Proceedings of the National Academy of Sciences 87 (4): 1620–624. PMC 53527. PMID 2154753. doi:10.1073/pnas.87.4.1620.
- Bergamini, Carlo M.; Gambetti, Stefani; Dondi, Alessia; Cervellati, Carlo (2004). "Oxygen, Reactive Oxygen Species and Tissue Damage". Current Pharmaceutical Design 10 (14): 1611–626. doi:10.2174/1381612043384664.
- Bernier Brian E., Whitaker Leslie R., Morikawa Hitoshi (2011). "Previous Ethanol Experience Enhances Synaptic Plasticity of NMDA Receptors in the Ventral Tegmental Area". The Journal of Neuroscience 31 (14): 5305–212. PMC 3086894. PMID 21471355. doi:10.1523/JNEUROSCI.5282-10.2011.
- Bisset, Norman G (1992). "War and Hunting Poisons of the New World. Part 1. Notes on the Early History of Curare". Journal of Ethnopharmacology 36 (1): 1–26. doi:10.1016/0378-8741(92)90056-w.
- Blanco, Ana M.; Valles, Soraya L.; Pascual, Maria; Guerri, Consuelo (2005). "Involvement of TLR4/Type I IL-1 Receptor Signaling in the Induction of Inflammatory Mediators and Cell Death Induced by Ethanol in Cultured Astrocytes". The Journal of Immunology 175 (10): 6893–899. PMID 16272348. doi:10.4049/jimmunol.175.10.6893.
- Bleich, S (2003). "Hyperhomocysteinemia as a New Risk Factor for Brain Shrinkage in Patients with Alcoholism". Neuroscience Letters 335 (3): 179–82. PMID 12531462. doi:10.1016/s0304-3940(02)01194-1.
- Bonfoco E (1995). "Apoptosis and Necrosis: Two Distinct Events Induced, Respectively, by Mild and Intense Insults with N-Methyl-D-Aspartate or Nitric Oxide/Superoxide in Cortical Cell Cultures". Proceedings of the National Academy of Sciences 92 (16): 7162–166. PMC 41299. PMID 7638161. doi:10.1073/pnas.92.16.7162.
- Bradbury, MW; Deane, R (1993). "Permeability of the blood±brain barrier to lead. [Review]". Neurotoxicology 14 (2–3): 131–6. PMID 8247388.
- Brender, J.; Suarez, L.; Felkner, M.; Gilani, Z.; Stinchcomb, D.; Moody, K.; Henry, J.; Hendricks, K. (2006). "Maternal Exposure to Arsenic, Cadmium, Lead, and Mercury and Neural Tube Defects in Offspring". Environmental Research 101 (1): 132–39. PMID 16171797. doi:10.1016/j.envres.2005.08.003.
- Bressler, J; Kim, KA; Chakraborti, T; Goldstein, G (1999). "Molecular mechanisms of lead neurotoxicity. [Review]". Neurochem Res 24 (4): 595–600. PMID 10227691. doi:10.1023/A:1022596115897.
- Brocardo, Patricia S.; Gil-Mohapel, Joana; Christie, Brian R. (2011). "The Role of Oxidative Stress in Fetal Alcohol Spectrum Disorders". Brain Research Reviews 67 (1–2): 209–25. PMID 21315761. doi:10.1016/j.brainresrev.2011.02.001.
- Brookes, N (1988). "Specificity and Reversibility of the Inhibition by HgCl of Glutamate Transport in Astrocyte Cultures". Journal of Neurochemistry 50 (4): 1117–122. PMID 2894409. doi:10.1111/j.1471-4159.1988.tb10581.x.
- Buzanska, L.; Zablocka, B.; Dybel, A.; Domanska-Janik, K.; Albrecht, J. (2000). "Delayed Induction of Apoptosis by Ammonia in C6 Glioma Cells". Neurochemistry International 37 (2–3): 287–97. doi:10.1016/s0197-0186(00)00030-9.
- Carmichael WW, Biggs DF, Gorham PR (1975). "Toxicology and pharmacological action of Anabaena flos-aquae toxin". Science 187 (4176): 542–544. PMID 803708. doi:10.1126/science.803708.
- Carmichael WW, Gorham PR (1978). "Anatoxins from clones of Anabaena flos-aquae isolated from lakes of western Canada.". Mitt. Infernal. Verein. Limnol 21: 285–295.
- Chan, H. M. (2011) "Mercury in Fish: Human Health Risks." Encyclopedia of Environmental Health: 697–704.
- Choi, D (1988). "Calcium-mediated Neurotoxicity: Relationship to Specific Channel Types and Role in Ischemic Damage". Trends in Neurosciences 11 (10): 465–69. doi:10.1016/0166-2236(88)90200-7.
- Choi, D. W.; Rothman, S. M. (1990). "The Role of Glutamate Neurotoxicity in Hypoxic-Ischemic Neuronal Death". Annual Review of Neuroscience 13 (1): 171–82. doi:10.1146/annurev.neuro.13.1.171.
- Choi, Dennis W (1987). "Ionic Dependence of Glutamate Neurotoxicity". The Journal of Neuroscience 7 (2): 369–79. doi:10.1523/JNEUROSCI.07-02-00369.1987.
- Choi, Dennis W.; Maulucci-Gedde, Margaret; Kriegstein, Arnold R. (1987). "Glutamate Neurotoxicity in Cortical Cell Culture". The Journal of Neuroscience 7 (2): 357–68. doi:10.1523/JNEUROSCI.07-02-00357.1987.
- Chu, Jennifer; Tong, Ming; Monte, Suzanne M. (2007). "Chronic Ethanol Exposure Causes Mitochondrial Dysfunction and Oxidative Stress in Immature Central Nervous System Neurons". Acta Neuropathologica 113 (6): 659–73. PMID 17431646. doi:10.1007/s00401-007-0199-4.
- Clancy, Barbara; Finlay, Barbara L.; Darlington, Richard B.; Anand, K.J.S. (2007). "Extrapolating Brain Development from Experimental Species to Humans". NeuroToxicology 28 (5): 931–37. PMC 2077812. PMID 17368774. doi:10.1016/j.neuro.2007.01.014.
- Costa, Lucio G., Gennaro Giordano, e Marina Guizzetti (2011) In Vitro Neurotoxicology: Methods and Protocols. Nova York: Humana.
- Coyle, Joseph T.; Schwarcz, Robert. "Lesion of Striatal Neurons with Kainic Acid Provides a Model for Huntington's Chorea". Nature 246: 244–46.
- Cruz, Lourdes J.; Olivera, Baldomero M. (1987). "Calcium Channel Antagonists ω-Conotoxin Defines a New High Affinity Site". The Journal of Biological Chemistry 14 (261): 6230–233.
- Davis, S.; Butcher, S. P.; Morris, R. (1992). "The NMDA Receptor Antagonist D-2-amino-5phosphonopentanoate (D-AP5) Impairs Spatial Learning and LTP in Vivo at Intracerebral Concentrations Comparable to Those That Block LTP in Vitro". The Journal of Neuroscience 12 (1): 21–34. doi:10.1523/JNEUROSCI.12-01-00021.1992.
- Dawson, V. L. (1991). "Nitric Oxide Mediates Glutamate Neurotoxicity in Primary Cortical Cultures". Proceedings of the National Academy of Sciences 88 (14): 6368–371. PMC 52084. PMID 1648740. doi:10.1073/pnas.88.14.6368.
- Debin, John A., John E. Maggio, e Gary R. Strichartz (1993) "Purification and Characterization of Chlorotoxin, a Chloride Channel Ligand from the Venom of the Scorpion." The American Physiological Society, pp. 361–69.
- DeFuria, Jason; Shea, Thomas B. (2007). "Arsenic Inhibits Neurofilament Transport and Induces Perikaryal Accumulation of Phosphorylated Neurofilaments: Roles of JNK and GSK-3β.". Brain Research 1181: 74–82. PMID 17961518. doi:10.1016/j.brainres.2007.04.019.
- Defuria, Jason (2006) "The Environmental Neurotoxin Arsenic Impairs Neurofilament Dynamics by Overactivation of C-JUN Terminal Kinase: Potential Role for Amyotrophic Lateral Sclerosis." UMI, pp. 1–16.
- Deng Wenbin, Poretz Ronald D (2003). "Oligodendroglia in Developmental Neurotoxicity". NeuroToxicology 24 (2): 161–78. PMID 12606289. doi:10.1016/s0161-813x(02)00196-1.
- Deshane, Jessy; Garner, Craig C.; Sontheimer, Harald (2003). "Chlorotoxin Inhibits Glioma Cell Invasion via Matrix Metalloproteinase-2". The Journal of Biological Chemistry 278 (6): 4135–144. PMID 12454020. doi:10.1074/jbc.m205662200.
- Devlin JP, Edwards OE, Gorham PR, Hunter NR, Pike RK, Stavric B (1977). "Anatoxin-a, a toxic alkaloid from Anabaena flos-aquae NRC-44h". Can. J. Chem. 55 (8): 1367–1371. doi:10.1139/v77-189. Arquivado dende o orixinal o 09 de xullo de 2012. Consultado o 21 de decembro de 2019.
- Dikranian, K (2001). "Apoptosis in the in Vivo Mammalian Forebrain". Neurobiology of Disease 8 (3): 359–79. PMID 11447994. doi:10.1006/nbdi.2001.0411.
- Dixit A, Dhaked RK, Alam SI, Singh L (2005). "Military potential of biological neurotoxins". Toxin Reviews 24 (2): 175–207. doi:10.1081/TXR-200057850.
- Dobbs, Michael R (2009) Clinical Neurotoxicology. Philadelphia: Saunders-Elsevier.
- Dutertre, S.; Lewis, R. (2006). "Toxin Insights into Nicotinic Acetylcholine Receptors". Biochemical Pharmacology 72 (6): 661–70. PMID 16716265. doi:10.1016/j.bcp.2006.03.027.
- Garcia-Rodriguez, C.; Geren, I. N.; Lou, J.; Conrad, F.; Forsyth, C.; Wen, W.; Chakraborti, S.; Zao, H.; Manzanarez, G.; Smith, T. J.; Brown, J.; Tepp, W. H.; Liu, N.; Wijesuriya, S.; Tomic, M. T.; Johnson, E. A.; Smith, L. A.; Marks, J. D. (2011). "Response Re: 'Neutralizing Human Monoclonal Antibodies Binding Multiple Serotypes of Botulinum Neurotoxin' by Garcia-Rodriguez Et Al., PEDS, 2011;24:321–331". Protein Engineering Design and Selection 24 (9): 633–34. doi:10.1093/protein/gzr012.
- Garthwaite, John; Charles, Sarah L.; Chess-Williams, Russel (1988). "Endothelim-derived Relaxing Factor Release on Activation of NMDA Receptors Suggests Role as Intercellular Messenger in the Brain". Nature 336 (24): 385–88. PMID 2904125. doi:10.1038/336385a0.
- Gartlon, J.; Kinsner, A.; Balprice, A.; Coecke, S.; Clothier, R. (2006). "Evaluation of a Proposed in Vitro Test Strategy Using Neuronal and Non-neuronal Cell Systems for Detecting Neurotoxicity". Toxicology in Vitro 20 (8): 1569–581. PMID 16959468. doi:10.1016/j.tiv.2006.07.009.
- Gil-Mohapel, Joana; Boehme, Fanny; Kainer, Leah; Christie, Brian R. (2010). "Hippocampal Cell Loss and Neurogenesis after Fetal Alcohol Exposure: Insights from Different Rodent Models". Brain Research Reviews 64 (2): 283–303. PMID 20471420. doi:10.1016/j.brainresrev.2010.04.011.
- Haghdoost-Yazdi, Hashem; Faraji, Ayda; Fraidouni, Negin; Movahedi, Mohadeseh; Hadibeygi, Elham; Vaezi, Fatemeh (2011). "Significant Effects of 4-aminopyridine and Tetraethylammonium in the Treatment of 6-hydroxydopamine-induced Parkinson's Disease". Behavioural Brain Research 223 (1): 70–74. PMID 21540059. doi:10.1016/j.bbr.2011.04.021.
- Harry, G. J.; Billingsley, Melvin; Bruinink, Arendd; Campbell, Iain L.; Classen, Werner; Dorman, David C.; Galli, Corrado; Ray, David; Smith, Robert A.; Tilson, Hugh A. (1998). "In Vitro Techniques for the Assessment of Neurotoxicity". Environmental Health Perspectives 106 (Suppl 1): 131–58. JSTOR 3433917. PMC 1533280. PMID 9539010. doi:10.2307/3433917.
- Häussinger, Dieter (2006). "Low Grade Cerebral Edema and the Pathogenesis of Hepatic Encephalopathy in Cirrhosis". Hepatology 43 (6): 1187–190. PMID 16729329. doi:10.1002/hep.21235.
- Hensley, K (1994). "A Model for β-Amyloid Aggregation and Neurotoxicity Based on Free Radical Generation by the Peptide: Relevance to Alzheimer Disease". Proceedings of the National Academy of Sciences 91 (8): 3270–274. PMC 43558. PMID 8159737. doi:10.1073/pnas.91.8.3270.
- Herbert, M. R. (2006) "Autism and Environmental Genomics." NeuroToxicology, pp. 671–84. Web.
- Hodge, A. Trevor (2002) Roman Aqueducts and Water Supply. Londres: Duckworth.
- How, C (2003). "Tetrodotoxin Poisoning". The American Journal of Emergency Medicine 21 (1): 51–54. PMID 12563582. doi:10.1053/ajem.2003.50008.
- Hue, Bernard; Buckingham, Steven D.; Buckingham, David; Sattelle, David B. (2007). "Actions of Snake Neurotoxins on an Insect Nicotinic Cholinergic Synapse". Invertebrate Neuroscience 7 (3): 173–78. PMID 17710455. doi:10.1007/s10158-007-0053-3.
- Iadecola Constantino (1997). "Bright and Dark Sides of Nitric Oxide in Ischemic Brain Injury". Trends in Neurosciences 20 (3): 132–39. doi:10.1016/s0166-2236(96)10074-6.
- Jacob, Reed B.; McDougal, Owen M. (2010). "The M-superfamily of Conotoxins: a Review". Cellular and Molecular Life Sciences 67 (1): 17–27. PMC 3741454. PMID 19705062. doi:10.1007/s00018-009-0125-0.
- Jevtovic-Todorovic, Vesna; Hartman, Richard E.; Izumi, Yukitoshi; Benshoff, Nicholas D.; Dikranian, Krikor; Zorumski, Charles F.; Olney, John W.; Wozniak, David F. (2003). "Early Exposure to Common Anesthetic Agents Causes Widespread Neurodegeneration in the Developing Rat Brain and Persistent Learning Deficits". The Journal of Neuroscience 23 (3): 876–82. doi:10.1523/JNEUROSCI.23-03-00876.2003.
- Jones, K (1973). "Pattern Of Malformation In Offspring Of Chronic Alcoholic Mothers". The Lancet 301 (7815): 1267–271. PMID 4126070. doi:10.1016/s0140-6736(73)91291-9.
- Kiernan, Matthew C.; Isbister, Geoffrey K.; Cindy; Lin, S.-Y.; Burke, David; Bostock, Hugh (2005). "Acute Tetrodotoxin-induced Neurotoxicity after Ingestion of Puffer Fish". Annals of Neurology 57 (3): 339–48. PMID 15732107. doi:10.1002/ana.20395.
- King, Steven W.; Savory, John; Wills, Michael R.; Gitelman, H. J. (1981). "The Clinical Biochemistry of Aluminum". Critical Reviews in Clinical Laboratory Sciences 14 (1): 1–20. PMID 7016437. doi:10.3109/10408368109105861.
- Konopacka, Agnieszka; Konopacki, Filip A.; Albrecht, Jan (2009). "Protein Kinase G Is Involved in Ammonia-induced Swelling of Astrocytes". Journal of Neurochemistry 109: 246–51. PMID 19393034. doi:10.1111/j.1471-4159.2009.05802.x.
- Lafon-Cazal, Mireille; Pietri, Sylvia; Culcasi, Marcel; Bockaert, Joel (1993). "NMDA-dependent Superoxide Production and Neurotoxicity". Nature 364 (6437): 535–37. PMID 7687749. doi:10.1038/364535a0.
- Lasley, SM; Green, MC; Gilbert, ME (1999). "Influence of exposure period on in vivo hippocampal glutamate and GABA release in rats chronically exposed to lead". Neurotoxicology 20 (4): 619–29. PMID 10499360.
- Lau, F. L.; Wong, C. K.; Yip, S. H. (1995). "Puffer Fish Poisoning". Emergency Medicine Journal 12 (3): 214–15. PMC 1342486. PMID 8581253. doi:10.1136/emj.12.3.214.
- Lewendon, G.; Kinra, S.; Nelder, R.; Cronin, T. (2001). "Should Children with Developmental and Behavioural Problems Be Routinely Screened for Lead?". Archives of Disease in Childhood 85 (4): 286–88. PMC 1718950. PMID 11567935. doi:10.1136/adc.85.4.286.
- Lidsky Theodore I (2003). "Lead Neurotoxicity in Children: Basic Mechanisms and Clinical Correlates". Brain 126 (1): 5–19. PMID 12477693. doi:10.1093/brain/awg014.
- Liu, Kuang-Kai; Chen, Mei-Fang; Chen, Po-Yi; Lee, Tony J F.; Cheng, Chia-Liang; Chang, Chia-Ching; Ho, Yen-Peng; Jui-I, Chao (2010). "Alpha-bungarotoxin Binding to Target Cell in a Developing Visual System by Carboxylated Nanodiamond". Nanotechnology 19 (20): 205102. PMID 21825732. doi:10.1088/0957-4484/19/20/205102.
- Liu, Yuan; McDermott, Suzanne; Lawson, Andrew; Aelion, C. Marjorie (2010). "The Relationship between Mental Retardation and Developmental Delays in Children and the Levels of Arsenic, Mercury and Lead in Soil Samples Taken near Their Mother's Residence during Pregnancy". International Journal of Hygiene and Environmental Health 213 (2): 116–23. PMC 2836425. PMID 20045663. doi:10.1016/j.ijheh.2009.12.004.
- Lorenzo, A (1994). "β-Amyloid Neurotoxicity Requires Fibril Formation and Is Inhibited by Congo Red". Proceedings of the National Academy of Sciences 91 (25): 12243–2247. PMC 45413. PMID 7991613. doi:10.1073/pnas.91.25.12243.
- Lotti, Marcello, e Angelo Moretto (1989) "Organophosphate-Induced Delayed Polyneuropathy." Toxicological Reviews, 24 (1) (2005): 37–49.
- Martinez-Finley, Ebany J.; Goggin, Samantha L.; Labrecque, Matthew T.; Allan, Andrea M. (2011). "Reduced Expression of MAPK/ERK Genes in Perinatal Arsenic-exposed Offspring Induced by Glucocorticoid Receptor Deficits". Neurotoxicology and Teratology 33 (5): 530–37. PMC 3183307. PMID 21784148. doi:10.1016/j.ntt.2011.07.003.
- Martini, Frederic, Michael J. Timmons, e Robert B. Tallitsch (2009) Human Anatomy. San Francisco: Pearson/Benjamin Cummings.
- Matsuoka, Masato; Igisu, Hideki; Kohriyama, Kazuaki; Inoue, Naohide (1991). "Suppression of Neurotoxicity of Ammonia by L-carnitine". Brain Research 567 (2): 328–31. PMID 1817738. doi:10.1016/0006-8993(91)90814-c.
- McCleskey, E. W. (1987). "Omega-conotoxin: Direct and Persistent Blockade of Specific Types of Calcium Channels in Neurons but Not Muscle". Proceedings of the National Academy of Sciences 84 (12): 4327–331. PMC 305078. PMID 2438698. doi:10.1073/pnas.84.12.4327.
- Meldrum, B.; Garthwaite, J. (1990). "Excitatory Amino Acid Neurotoxicity and Neurodegenerative Disease". Trends in Pharmacological Sciences 11 (9): 379–87. PMID 2238094. doi:10.1016/0165-6147(90)90184-a.
- Metcalf, James S.; Codd, Geoffrey A. (2009). "Cyanobacteria, neurotoxins and water resources: Are there implications for human neurodegenerative disease?". Amyotrophic Lateral Sclerosis 10: 74–78. PMID 19929737. doi:10.3109/17482960903272942.
- Mitchell, J.Jean; Paiva, Michael; Barrow Heaton, Marieta (1999). "The Antioxidants Vitamin E and β-Carotene Protect Against Ethanol-Induced Neurotoxicity in Embryonic Rat Hippocampal Cultures". Alcohol 17 (2): 163–68. doi:10.1016/s0741-8329(98)00051-2.
- Moore RE (1977). "Toxins from blue-green algae". BioScience 27 (12): 797–802. JSTOR 1297756. doi:10.2307/1297756.
- Montecucco C (1986). "How Do Tetanus and Botulinum Toxins Bind to Neuronal Membranes?". Trends in Biochemical Sciences 11 (8): 314–17. doi:10.1016/0968-0004(86)90282-3.
- Morris, Stephanie A., David W. Eaves, Aleksander R. Smith, e Kimberly Nixon (2009) "Alcohol Inhibition of Neurogenesis: A Mechanism of Hippocampal Neurodegeneration in an Adolescent Alcohol Abuse Model." Hippocampus: NA.
- Nadler; Victor, J.; Perry, Bruce W.; Cotman, Carl W. (1978). "Intraventricular Kainic Acid Preferentially Destroys Hippocampal Pyramidal Cells". Nature 271 (5646): 676–77. doi:10.1038/271676a0.
- National Center for Environmental Assessment (2006) "Toxicological Reviews of Cyanobacterial Toxins: Anatoxin-a" NCEA-C-1743
- Norenberg, M. D.; Rao, K. V. Rama; Jayakumar, A. R. (2004). "Ammonia Neurotoxicity and the Mitochondrial Permeability Transition". Journal of Bioenergetics and Biomembranes 36 (4): 303–07. PMID 15377862. doi:10.1023/b:jobb.0000041758.20071.19.
- Olivera, Baldomero M.; Cruz, Lourdes J.; De Santos, Victoria; LeCheminant, Garth; Griffin, David; Zeikus, Regina; McIntosh, J. Michael; Galyean, Robert; Varga, Janos (1987). "Neuronal Calcium Channel Antagonists. Discrimination between Calcium Channel Subtypes Using .omega.-conotoxin from Conus Magus Venom". Biochemistry 26 (8): 2086–090. PMID 2441741. doi:10.1021/bi00382a004.
- Olney, John W (2002). "New Insights and New Issues in Developmental Neurotoxicology". NeuroToxicology 23 (6): 659–68. PMID 12520755. doi:10.1016/s0161-813x(01)00092-4.
- Pirazzini, Marco, Ornella Rossetto, Paolo Bolognese, Clifford C. Shone, e Cesare Montecucco (2011) "Double Anchorage to the Membrane and Intact Inter-chain Disulfide Bond Are Required for the Low PH Induced Entry of Tetanus and Botulinum Neurotoxins into Neurons." Cellular Microbiology: No. Print.
- Rabe, Ausma; He Lee, Moon; Shek, Judy; Wisniewski, Henryk M. (1982). "Learning Deficit in Immature Rabbits with Aluminum-induced Neurofibrillary Changes". Experimental Neurology 76 (2): 441–46. doi:10.1016/0014-4886(82)90220-5.
- Rocha, R. A.; Gimeno-Alcaniz, J. V.; Martín-Ibanez, Raymond; Canals, J. M.; Vélez, D.; Devesa, V. (2011). "Arsenic and Fluoride Induce Neural Progenitor Cell Apoptosis". Toxicology Letters 203 (3): 237–44. PMID 21439358. doi:10.1016/j.toxlet.2011.03.023.
- Roed, A (1989). "The Effects of Tetraethylammonium during Twitch and Tetanic Stimulation of the Phrenic Nerve Diaphragm Preparation in the Rat". Neuropharmacology 28 (6): 585–92. doi:10.1016/0028-3908(89)90137-8.
- Rothman, S.; Thurston, J.; Hauhart, R. (1987). "Delayed Neurotoxicity of Excitatory Amino Acids In Vitro". Neuroscience 22 (2): 471–80. doi:10.1016/0306-4522(87)90347-2.
- Schlesinger, Edward B (1946). "Curare A Review of Its Therapeutic Effects and Their Physiological Basis". The American Journal of Medicine 1 (5): 518–30. doi:10.1016/0002-9343(46)90073-3.
- Siebler, M.; Koller, H.; Schmalenbach, C.; Muller, H. (1988). "GABA Activated Chloride Currents in Cultured Rat Hippocampal and Septal Region Neurons Can Be Inhibited by Curare and Atropine". Neuroscience Letters 93 (2–3): 220–24. doi:10.1016/0304-3940(88)90085-7.
- Simpson, L. L. (1986). "Molecular Pharmacology of Botulinum Toxin and Tetanus Toxin". Annual Review of Pharmacology and Toxicology 26 (1): 427–53. doi:10.1146/annurev.pharmtox.26.1.427.
- Soroceanu, Liliana; Gillespie, Yancey; Khazaeli, M. B.; Sontheimer, Harold (1998). "Use of Chlorotoxin for Targeting of Primary Brain Tumors". Cancer Research 58: 4871–879.
- Spencer PS, Schaumburg HH, Ludolph AC (Eds) (2000) Experimental and Clinical Neurotoxicology. Oxford University Press, Oxford, pp. 1310.
- Stanfield, Peter R (1983). "Tetraethylammonium Ions and the Potassium Permeability of Excitable Cells". Reviews of Physiology, Biochemistry & Pharmacology 97: 1–49.
- Stewart I, Seawright AA, Shaw GR (2008). "Cyanobacterial poisoning in livestock, wild mammals and birds – an overview" (PDF). Cyanobacterial Harmful Algal Blooms: State of the Science and Research Needs. Advances in Experimental Medicine and Biology 619: 613–637. ISBN 978-0-387-75864-0. PMID 18461786. doi:10.1007/978-0-387-75865-7_28.
- Taffe, M. A.; Kotzebue, R. W.; Crean, R. D.; Crawford, E. F.; Edwards, S.; Mandyam, C. D. (2010). "From the Cover: Long-lasting Reduction in Hippocampal Neurogenesis by Alcohol Consumption in Adolescent Nonhuman Primates". Proceedings of the National Academy of Sciences 107 (24): 11104–1109. PMC 2890755. PMID 20534463. doi:10.1073/pnas.0912810107.
- Takadera, Tsuneo; Suzuki, Risa; Mohri, Tetsuro (1990). "Protection by Ethanol of Cortical Neurons from N-methyl-d-aspartate-induced Neurotoxicity Is Associated with Blocking Calcium Influx". Brain Research 537 (1–2): 109–14. PMID 1982237. doi:10.1016/0006-8993(90)90346-d.
- Thyagarajan, B.; Krivitskaya, N.; Potian, J. G.; Hognason, K.; Garcia, C. C.; McArdle, J. J. (2009). "Capsaicin Protects Mouse Neuromuscular Junctions from the Neuroparalytic Effects of Botulinum Neurotoxin A.". Journal of Pharmacology and Experimental Therapeutics 331 (2): 361–71. PMC 2775269. PMID 19654265. doi:10.1124/jpet.109.156901.
- Tymianski, Michael; Charlton, Milton P.; Carlen, Peter L.; Tator, Charles H. (2003). "Source Specificity of Early Calcium Neurotoxicity in Cultured Embryonic Spinal Neurons". The Journal of Neuroscience 13 (5): 2095–104.
- Tsetlin, V.I; Hucho, F. (2004). "Snake and Snail Toxins Acting on Nicotinic Acetylcholine Receptors: Fundamental Aspects and Medical Applications". FEBS Letters 557 (1–3): 9–13. PMID 14741333. doi:10.1016/s0014-5793(03)01454-6.
- USEPA (United States Environmental Protection Agency) (1998) Health Effects Test Guidelines. OPPTS 870.6200. Neurotoxicity screening battery. Washington DC, USEPA.
- Vahidnia, A., G.B. Van Der Voet, e F.A. De Wolff (2007) "Arsenic Neurotoxicity A Review." Human & Experimental Toxicology, 26 (10) : 823–32.
- Walton, J (2006). "Aluminum in Hippocampal Neurons from Humans with Alzheimer's Disease". NeuroToxicology 27 (3): 385–94. PMID 16458972. doi:10.1016/j.neuro.2005.11.007.
- Widmaier, Eric P., Hershel Raff, Kevin T. Strang, e Arthur J. Vander (2008) Vander's Human Physiology: the Mechanisms of Body Function.' Boston: McGraw-Hill Higher Education.
- Williamson, Lura C.; Halpern, Jane L.; Montecucco, Cesare; Brown, J. E.; Neale, Elaine A. (1996). "Clostridial Neurotoxins and Substrate Proteolysis in Intact Neurons". The Journal of Biological Chemistry 271 (13): 7694–699. doi:10.1074/jbc.271.13.7694.
- Wood S. A.; Rasmussen J. P.; Holland P. T.; Campbell R.; Crowe A. L. M. (2007). "First Report of the Cyanotoxin Anatoxin-A from Aphanizomenon issatschenkoi (cyanobacteria)". Journal of Phycology 43 (2): 356–365. doi:10.1111/j.1529-8817.2007.00318.x.
- Yamada, Kiyofumi; Tanaka, Tomoko; Han, Daiken; Senzaki, Kouji; Kameyama, Tsutomu; Nabeshima, Toshitaka (1999). "Protective Effects of Idebenone and α-tocopherol on β-amyloid-(1–42)-induced Learning and Memory Deficits in Rats: Implication of Oxidative Stress in β-amyloid-induced Neurotoxicity In vivo". European Journal of Neuroscience 11 (1): 83–90. doi:10.1046/j.1460-9568.1999.00408.x.
- Yan; Du, Shi; Chen, Xi; Fu, Jin; Chen, Ming; Zhu, Huaijie; Roher, Alex; Slattery, Timothy; Zhao, Lei; Nagashima, Mariko; Morser, John; Migheli, Antonio; Nawroth, Peter; Stern, David; Marie Schmidt, Ann (1996). "RAGE and Amyloid-β Peptide Neurotoxicity in Alzheimer's Disease". Nature 382 (6593): 685–91. PMID 8751438. doi:10.1038/382685a0.
- Yang, X (2007) Occurrence of the cyanobacterial neurotoxin, anatoxin-a, in New York State waters[Ligazón morta] ProQuest. ISBN 978-0-549-35451-2.
- Zhang, J.; Dawson, V.; Dawson, T.; Snyder, S. (1994). "Nitric Oxide Activation of Poly(ADP-ribose) Synthetase in Neurotoxicity". Science 263 (5147): 687–89. PMID 8080500. doi:10.1126/science.8080500.
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Neurotoxina |
Bibliografía
[editar | editar a fonte]- Brain Facts Book de The Society for Neuroscience
- Neuroscience Texts na Escola de Medicina da Universidade de Texas
- In Vitro Neurotoxicology: An Introduction en Springerlink
- Biology of the NMDA Receptor no NCBI
- Advances in the Neuroscience of Addiction, 2ª edición no NCBI
Ligazóns externas
[editar | editar a fonte]- Environmental Protection Agency na Axencia de Protección Ambiental dos Estados Unidos
- Alcohol and Alcoholism en Oxford Medical Journals
- Neurotoxicology en Elsevier Journals
- Neurotoxin Institute no Neurotoxin Institute
- Neurotoxins en Toxipedia
