Canle de potasio

As canles de potasio son o tipo máis amplamente distribuído de canle iónica que se atopa en virtualmente todos os organismos.[1] Forman poros selectivos ao potasio que abranguen o grosor da membrana plasmática. As canles de potasio atópanse na maioría dos tipos de células e controlan unha ampla variedade de funcións celulares.[2][3]
Función[editar | editar a fonte]
A función das canles de potasio é conducir ións potasio ao seu través a favor de gradiente electroquímico, de faorma rápida (ata a velocidade de difusión de ións K+ nunha masa de auga) e selectiva (excluíndo, principalmente, o sodio malia a súa diferenza sub-ángstrom en raio iónico).[4] Bioloxicamente, estas cales actúan para establecer ou restablecer o potencial de repouso en moitas células. En células excitables, como as neuronas, o contrafluxo atrasado de ións potasio dá forma ao potencial de acción.
Como contribúen á regulación da duración do potencial de acción cardíaco no músculo cardíaco, o funcionamento incorreco das canles de potasio pode causar arritmias que poden ser mortais. As canles de potasio poden tamén estar implicadas no mantemento do ton vascular.
Tamén regulan procesos celulares como a secreción de hormonas (por exemplo, a insulina liberada polas células beta do páncreas), así que o seu mal funcionamento pode orixinar doenzas, como a diabetes.
Algunhas toxinas, como a dendrotoxina, deben a súa potencia a que bloquean as canles de potasio.[5]
Tipos[editar | editar a fonte]
Hai catro grandes calses de canles de potasio:
- Canle de potasio activada por calcio, que se abre en resposta á presenza de ións calcio ou outras moléculas de sinalización.
- Canle de ión potasio rectificadora interna, que pasa corrente (de cargas positivas) máis facilmente na dirección cara ao interior da célula.
- Canle de potasio de dominio de poro en tándem, que está aberta constitutivmente (permanentemente) ou posúe unha alta activación basal, como as "canles de potasio en repouso" ou as "canles de fuga" que establecen o potencial de membrana negativa das neuronas.
- Canle de potasio dependente de voltaxe, que é unha canle iónica dependente de voltaxe que se abre ou pecha en resposta a cambios na voltaxe transmembrana.
A seguinte táboa contén unha comparación das grandes clases de canles de potasio con exemplos representativos (para unha lista completa de canles dentro de cada clase ver os artigos respectivos de cada clase).
Para máis exemplos de moduladores farmacolóxicos das canles de potasio ver bloqueante das canles de potasio e abridor das canles de potasio.
| Clase | Subclases | Función | Bloqueantes | Activadores |
|---|---|---|---|---|
| Activado por calcio 6T & 1P |
|
|
| |
| Rectificadora interna 2T & 1P |
|
|
||
|
|
|||
|
|
|||
|
[Cómpre referencia] | |||
| Dominio de poro en tándem 4T & 2P |
|
|
[Cómpre referencia] | |
| Dependente de voltaxe 6T & 1P |
|
|
|
Estrutura[editar | editar a fonte]

As canles de potasio teñen unha estrutura tetrámera na cal se asocian catro subunidades proteicas idénticas para formar un complexo simétrico cuaternario (C4) disposto arredor dun poro central condutor de ións (é dicir, un homotetrámero). Alternativamente, catro subunidades proteicas relacionadas pero non idénticas poden asociarse para formar complexos heterotetrámeros con simetría pseudo-C4. Todas as subunidades das canles de potasio teñen unha estrutura de bucle-poro distintiva que tapiza a parte superior do poro e é responsable da permeabilidade selectiva para o potasio.
Hai uns 80 xenes de mamíferos que codifican as subunidades da canle de potasio. Porén, as canles de potasio atopadas en bacterias están entre as canles iónicas máis estudadas en canto á súa estrutura molecular. Usando cristalografía de raios X,[55][56] conseguise moita información de como pasan os ions de potasio a través destas canles e por que os ións sodio (que son máis pequenos) non pasan.[57] O Premio Nobel de Química de 2003 concedéuselle a Rod MacKinnon polo seu traballo pioneiro nesta área.[58]
Filtro de selectividade[editar | editar a fonte]
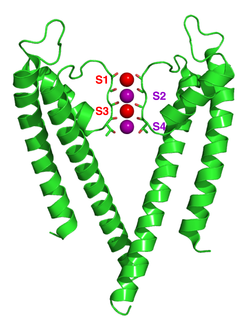
As canles de ión potasio retiran a cuberta de hidratación (solvatación) do ión cando este entra no filtro de selectividade. O filtro de selectividade está formado por unha secuencia de cinco residuos, TVGYG, denominada secuencia sinatura, que se encontra en cada unha das catro subunidades. Esta secuencia de sinatura está dentro dun bucle entre a hélice do poro e o TM2/6, denominado historicamente bucle P. Esta secuencia sinatura está altamente conservada, coa excepción de que un residuo de valina presente en canles de potasio procariotas adoita estar substituído por un residuo de isoleucina nas canles eucariotas. Esta secuencia adopta unha estrutura de cadea principal única, estruturalmente análoga ao motivo estrutural de niño proteico. Os catro conxuntos de átomos de oxíxeno do carbonilo electronegativos están aliñados cara ao centro do poro filtro e forman un antiprisma cadrado similar ao da cuberta de auga solvatante que rodea a cada sitio de unión do potasio. A distancia entre os oxíxenos do carbonilo e os ións potasio nos sitios de unión do filtro de selectividade é a mesma que entre os oxíxenos da auga da primeira cuberta de hidratación e un ión potasio en solución acuosa, proporcionando unha ruta enerxeticamente favorable para a des-solvatación dos ións. Porén, os ións sodio son demasiado pequenos para encher o espazo entre os átomos do oxíxeno carbonilo. Así, é enerxeticamente favorable para os ións sodio permaneceren unidos a moléculas de auga no espazo extracelular, en vez de pasaren a través do poro iónico selectivo ao potaasio.[60] Esta anchura parce que se mantén pola formación de enlaces de hidróxeno e forzas de van der Waals entre unha lámina de residuos de aminoácidos aromáticos que rodean o filtro de selectividade.[55][61] O filtro de selectividade ábrese cara a solución extracelular, expoñendo catro oxíxenos do carbonilo nun residuo de glicina (Gly79 na canle KcsA). O seguinte residuo cara ao lado extracelular da proteína é o Asp80 (KcsA) cargado negtivamente. Este residuo xunto cos cinco residuos do filtro forman o poro que conecta a cavidade chea de auga do centro da proteína coa solución extracelular.[62]
Mecanismo de selectividade[editar | editar a fonte]
O mecanismo de selectividade da canle de potasio segue estando en continua discusión. Os oxíxenos carbonilo son fortemente electronegativos e atractores de catións. O filtro pode acomodar ións potasio en 4 sitios xeralmente etiquetados como S1 a S4 empezando polo lado extracelular. Ademais, na cavidade pode unirse un ión no sitio chamado SC ou un ou máis ións no lado extracelular a sitios máis ou menos ben definidos chamados S0 ou Sext. Son posibles varias ocupacións diferentes destes sitios. Como as estruturas de raios X son medias obtidas de moitas moléculas, non é posible deducir as ocupacións reais directamente de dita estrutura. En xeral, hai algunha desvantaxe debido á repulsión electrostática para que dous sitios veciños estean ocupados por ións. Fixéronse propostas sobre o mecanismo de selectividade baseándose en simulacións da dinámica molecular,[63] modelos de xoguete de unión de ións,[64] cálculos termodinámicos,[65] consideracións topolóxicas,[66][67] e diferenzas estruturais[68] entre canles selectivas e non selectivas.
O mecanismo para a translocación de ións en KcsA foi estudado amplamente por cálculos teóricos e simulacións.[62][69] A predición dun mecanismo de condución de ións no cal os dous estados dobremente ocupados (S1, S3) e (S2, S4) xogan un papel esencial foi sinalado por ambas as técnicas. As simulacións de dinámica molecular suxiren que os dous estados extracelulares, Sext e S0, que reflicten ións que entran e saen do filtro, son tamén actores importantes na condución de ións.
Rexión hidrofóbica[editar | editar a fonte]
Esta rexión neutraliza o ambiente arredor do ión potasio para que non sexa atraído por ningunha carga. Á súa vez, acelera a reacción.
Cavidade central[editar | editar a fonte]
Preto do centro da canle transmembrana está localizado un poro central de 10 Å de ancho, onde a barreira de enerxía é maior para o ión que atravesa debido á hidrofobicidade da parede da canle. A cavidade chea de auga e o C-terminal polar das hélices do poro reducen a barreira enerxética para o ión. A repulsión producida por múltiples ións potasio precedentes pénsase que axuda ao rendemento dos ións. A presenza da cavidade pode comprenderse intuitivamente como un dos mecanismos da canle para superar a barreira dieléctrica ou a repulsión pola membrana dielectricamente baixa, ao manter o ión K+ nun ambiente acuoso e dielectricamente alto.
Regulación[editar | editar a fonte]
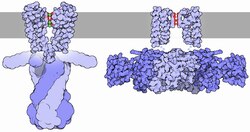
O fluxo de ións a través do poro da canle de potasio é regulado por dous procesos relacionados, denominados apertura/peche (gating) e inactivación. A apertura/peche da canle faise en resposta a estímulos, mentres que a inactivación é o cesamento rápido da corrente desde unha canle de potasio aberta e a supresión da capacidade da canle de volver a conducilos. Aínda que ambos os procesos serven para regular a condutancia da canle, cada proceso pode depender de varios mecanismos.
Xeralmente, a apertura/peche pénsase que depende de dominios estruturais adicionais que perciben os estímulos e á súa vez abren o poro da canle. Entre estes dominios están os dominios RCK das canles BK,[70][71][72] e os dominios de sensor de voltaxe das canles de K+ dependenes de voltaxe. Estes dominios pénsase que responden a estímulos abrindo fisicamente a porta intracelular do dominio do poro, deixando así que os ións potasio atravesen a membrana. Algunhas canles teñen moitos dominios regulatorios ou proteínas accesorias, que poden actuar para modular a resposta ao estímulo. Aínda que se continúan discutindo os posibles mecanismos, coñécense as estruturas de varios destes dominios reguladores, como a dos dominios RCK de canles procariotas[73][74][75] e eucariotas,[70][71][72] dominio de apertura por pH de KcsA,[76] dominios de apertura/peche de nucleótido cíclico,[77] e canles de potasio dependentes de voltaxe.[78][79]
A inactivación de tipo N é tipicamente o mecanismo de inactivación máis rápido e chámase modelo de "bóla e cadea".[80] A inactivación de tipo N implica a interacción do N-terminal da canle ou unha proteína asociada, que interacciona co dominio do poro e oclúe a vía de condución de ións como unha "bóla". Alternativamente, a inactivación de tipo C pénsase que ocorre dentro do propio filtro de selectividade, no que cambios estruturais no filtro fan que sexa non condutivo. Hai varios modelos estruturais de filtros de canles de K+ inactivados de tipo C,[81][82][83] aínda que o mecanismo preciso segue estando pouco claro.
Farmacoloxía[editar | editar a fonte]
Bloqueantes[editar | editar a fonte]
Os bloqueantes da canle de potasio inhiben o fluxo de ións potasio a través da canle. Compiten coa unión do potasio co filtro de selectividade ou únense fóra do filtro para ocluír a condución. Un exemplo dun destes competidores son os ións de amonio cuaternario, que se unen á face extracelular[84][85] ou cavidade central da canle.[86] Como bloquean na cavidade central os ións de amonio cuaternario tamén se coñecen como bloqueantes da canle aberta, xa que a unión require clasicamente a pevia apertura da porta citoplasmática.[87]
Os ións de bario poden tamén bloquear as correntes da canle de potasio,[88][89] ao unirse con alta afinidade no filtro de selectividade.[90][91][92][93] Esta estreita unión pénsase que explica a toxicidade do bario ao inhibir a actividade da canle de potasio en células excitables.
Medicamente os bloqueantes da canle de potasio, como a 4-aminopiridina e a 3,4-diaminopiridina, foron investigados para o tratamento de condicións como a esclerose múltiple.[49] Os efectos de fármacos fóra de diana poden orixinar a síndrome de QT longa inducida por fármacos, unha condicións que pode ser mortal. Isto débese xeralmente á acción da canle de potasio hERG no corazón. En consecuencia, todos os novos fármacos son testados preclinicamente para ver se son seguros para o corazón.
Activadores[editar | editar a fonte]

Algúns exemplos son:
- Diazoxida[94] vasodilatador usado para a hipertensión e relaxación da actividade do músculo liso.
- Minoxidil[95] vasodilatador usado para a hipertensión, tamén usado para tratar a perda de cabelo.
- Nicorandil[96] vasodilatador usado para tratar a anxina de peito.
- Pinacidil.[97]
- Retigabina,[98][99] un anticonvulsivo
- Flupirtina, analxésico con propiedades relaxantes musculares e anticonvulsivas.
Canle de potasio muscarínico[editar | editar a fonte]
Algúns tipos de canle de potasio son activadas por receptoes muscarínicos e denomínanse canles de potasio muscarínicos (IKACh). Estas canles son un heterotetrámero composto por dúas subunidades GIRK1 e outras dúas GIRK4.[100][101] Exemplos son as canles de potasio no corazón, que, cando son activadas por sinais parasimpáticos a través de receptores muscarínicos M2, causan unha corrente de potasio cara ao exterior, que diminúe a frecuencia cardíaca.[102][103]
Na arte[editar | editar a fonte]
Roderick MacKinnon encargou a escultura Birth of an Idea (Nacemento dunha idea), de 1,5 m de altura, baseada na canle de potasio KcsA.[104] A obra de arte consiste nun obxecto de arame que representa o interior da canle cun obxecto de vidro soprado que representa a cavidade principal da estrutura da canle.
Notas[editar | editar a fonte]
- ↑ Littleton JT, Ganetzky B (abril de 2000). "Ion channels and synaptic organization: analysis of the Drosophila genome". Neuron 26 (1): 35–43. PMID 10798390. doi:10.1016/S0896-6273(00)81135-6.
- ↑ Hille, Bertil (2001). "Chapter 5: Potassium Channels and Chloride Channels". Ion channels of excitable membranes. Sunderland, Mass: Sinauer. pp. 131–168. ISBN 978-0-87893-321-1.
- ↑ Jessell TM, Kandel ER, Schwartz JH (2000). "Chapter 6: Ion Channels". Principles of Neural Science (4th ed.). New York: McGraw-Hill. pp. 105–124. ISBN 978-0-8385-7701-1.
- ↑ Lim C, Dudev T (2016). Sigel A, Sigel H, Sigel RK, eds. "Chapter 10. Potassium Versus Sodium Selectivity in Monovalent Ion Channel Selectivity Filters". The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences (Springer) 16: 325–347. PMID 26860305. doi:10.1007/978-3-319-21756-7_9.
- ↑ citado indirectamente das referencias números 3,4,5,6 de Rehm H, Lazdunski M (xullo de 1988). "Purification and subunit structure of a putative K+-channel protein identified by its binding properties for dendrotoxin I". Proceedings of the National Academy of Sciences of the United States of America 85 (13): 4919–4923. Bibcode:1988PNAS...85.4919R. PMC 280549. PMID 2455300. doi:10.1073/pnas.85.13.4919.
- ↑ 6,00 6,01 6,02 6,03 6,04 6,05 6,06 6,07 6,08 6,09 6,10 6,11 6,12 6,13 Rang, HP (2015). Pharmacology (8 ed.). Edinburgh: Churchill Livingstone. p. 59. ISBN 978-0-443-07145-4.
- ↑ Thompson J, Begenisich T (maio de 2000). "Electrostatic interaction between charybdotoxin and a tetrameric mutant of Shaker K(+) channels". Biophysical Journal 78 (5): 2382–2391. Bibcode:2000BpJ....78.2382T. PMC 1300827. PMID 10777734. doi:10.1016/S0006-3495(00)76782-8.
- ↑ Naranjo D, Miller C (xaneiro de 1996). "A strongly interacting pair of residues on the contact surface of charybdotoxin and a Shaker K+ channel". Neuron 16 (1): 123–130. PMID 8562075. doi:10.1016/S0896-6273(00)80029-X.
- ↑ Yu M, Liu SL, Sun PB, Pan H, Tian CL, Zhang LH (xaneiro de 2016). "Peptide toxins and small-molecule blockers of BK channels". Acta Pharmacologica Sinica 37 (1): 56–66. PMC 4722972. PMID 26725735. doi:10.1038/aps.2015.139.
- ↑ Candia S, Garcia ML, Latorre R (agosto de 1992). "Mode of action of iberiotoxin, a potent blocker of the large conductance Ca(2+)-activated K+ channel". Biophysical Journal 63 (2): 583–590. Bibcode:1992BpJ....63..583C. PMC 1262182. PMID 1384740. doi:10.1016/S0006-3495(92)81630-2.
- ↑ Stocker M, Krause M, Pedarzani P (abril de 1999). "An apamin-sensitive Ca2+-activated K+ current in hippocampal pyramidal neurons". Proceedings of the National Academy of Sciences of the United States of America 96 (8): 4662–4667. Bibcode:1999PNAS...96.4662S. PMC 16389. PMID 10200319. doi:10.1073/pnas.96.8.4662.
- ↑ McLeod JF, Leempoels JM, Peng SX, Dax SL, Myers LJ, Golder FJ (novembro de 2014). "GAL-021, a new intravenous BKCa-channel blocker, is well tolerated and stimulates ventilation in healthy volunteers". British Journal of Anaesthesia 113 (5): 875–883. PMID 24989775. doi:10.1093/bja/aeu182.
- ↑ Dopico AM, Bukiya AN, Kuntamallappanavar G, Liu J (2016). "Modulation of BK Channels by Ethanol". International Review of Neurobiology 128: 239–279. ISBN 9780128036198. PMC 5257281. PMID 27238266. doi:10.1016/bs.irn.2016.03.019.
- ↑ 14,0 14,1 Patnaik, Pradyot (2003). Handbook of inorganic chemicals. McGraw-Hill. pp. 77–78. ISBN 978-0-07-049439-8.
- ↑ Sackin H, Syn S, Palmer LG, Choe H, Walters DE (febreiro de 2001). "Regulation of ROMK by extracellular cations". Biophysical Journal 80 (2): 683–697. Bibcode:2001BpJ....80..683S. PMC 1301267. PMID 11159436. doi:10.1016/S0006-3495(01)76048-1.
- ↑ Dhamoon AS, Jalife J (marzo de 2005). "The inward rectifier current (IK1) controls cardiac excitability and is involved in arrhythmogenesis". Heart Rhythm 2 (3): 316–324. PMID 15851327. doi:10.1016/j.hrthm.2004.11.012.
- ↑ 17,0 17,1 17,2 17,3 17,4 17,5 Swale DR, Kharade SV, Denton JS (abril de 2014). "Cardiac and renal inward rectifier potassium channel pharmacology: emerging tools for integrative physiology and therapeutics". Current Opinion in Pharmacology 15: 7–15. PMC 4097192. PMID 24721648. doi:10.1016/j.coph.2013.11.002.
- ↑ Xynogalos P, Seyler C, Scherer D, Koepple C, Scholz EP, Thomas D, et al. (decembro de 2014). "Class III antiarrhythmic drug dronedarone inhibits cardiac inwardly rectifying Kir2.1 channels through binding at residue E224". Naunyn-Schmiedeberg's Archives of Pharmacology 387 (12): 1153–1161. PMID 25182566. doi:10.1007/s00210-014-1045-6.
- ↑ Koepple C, Scherer D, Seyler C, Scholz E, Thomas D, Katus HA, Zitron E (maio de 2017). "Dual Mechanism for Inhibition of Inwardly Rectifying Kir2.x Channels by Quinidine Involving Direct Pore Block and PIP2-interference". The Journal of Pharmacology and Experimental Therapeutics 361 (2): 209–218. PMID 28188270. doi:10.1124/jpet.116.238287.
- ↑ Caballero R, Dolz-Gaitón P, Gómez R, Amorós I, Barana A, González de la Fuente M, et al. (agosto de 2010). "Flecainide increases Kir2.1 currents by interacting with cysteine 311, decreasing the polyamine-induced rectification". Proceedings of the National Academy of Sciences of the United States of America 107 (35): 15631–15636. PMC 2932566. PMID 20713726. doi:10.1073/pnas.1004021107.
- ↑ Kobayashi T, Washiyama K, Ikeda K (marzo de 2006). "Inhibition of G protein-activated inwardly rectifying K+ channels by ifenprodil". Neuropsychopharmacology 31 (3): 516–524. PMID 16123769. doi:10.1038/sj.npp.1300844.
- ↑ Soeda F, Fujieda Y, Kinoshita M, Shirasaki T, Takahama K (maio de 2016). "Centrally acting non-narcotic antitussives prevent hyperactivity in mice: Involvement of GIRK channels". Pharmacology, Biochemistry, and Behavior 144: 26–32. PMID 26892760. doi:10.1016/j.pbb.2016.02.006.
- ↑ Yamamoto G, Soeda F, Shirasaki T, Takahama K (abril de 2011). "[Is the GIRK channel a possible target in the development of a novel therapeutic drug of urinary disturbance?]". Yakugaku Zasshi 131 (4): 523–532. PMID 21467791. doi:10.1248/yakushi.131.523.
- ↑ Kawaura K, Honda S, Soeda F, Shirasaki T, Takahama K (maio de 2010). "[Novel antidepressant-like action of drugs possessing GIRK channel blocking action in rats]". Yakugaku Zasshi 130 (5): 699–705. PMID 20460867. doi:10.1248/yakushi.130.699.
- ↑ Jin W, Lu Z (setembro de 1998). "A novel high-affinity inhibitor for inward-rectifier K+ channels". Biochemistry 37 (38): 13291–13299. PMID 9748337. doi:10.1021/bi981178p.
- ↑ Kawaura K, Ogata Y, Inoue M, Honda S, Soeda F, Shirasaki T, Takahama K (decembo de 2009). "The centrally acting non-narcotic antitussive tipepidine produces antidepressant-like effect in the forced swimming test in rats". Behavioural Brain Research 205 (1): 315–318. PMID 19616036. doi:10.1016/j.bbr.2009.07.004.
- ↑ Kaufmann K, Romaine I, Days E, Pascual C, Malik A, Yang L, et al. (setembro de 2013). "ML297 (VU0456810), the first potent and selective activator of the GIRK potassium channel, displays antiepileptic properties in mice". ACS Chemical Neuroscience 4 (9): 1278–1286. PMC 3778424. PMID 23730969. doi:10.1021/cn400062a.
- ↑ Serrano-Martín X, Payares G, Mendoza-León A (decembro de 2006). "Glibenclamide, a blocker of K+(ATP) channels, shows antileishmanial activity in experimental murine cutaneous leishmaniasis". Antimicrobial Agents and Chemotherapy 50 (12): 4214–4216. PMC 1693980. PMID 17015627. doi:10.1128/AAC.00617-06.
- ↑ Lawrence CL, Proks P, Rodrigo GC, Jones P, Hayabuchi Y, Standen NB, Ashcroft FM (agosto de 2001). "Gliclazide produces high-affinity block of KATP channels in mouse isolated pancreatic beta cells but not rat heart or arterial smooth muscle cells". Diabetologia 44 (8): 1019–1025. PMID 11484080. doi:10.1007/s001250100595.
- ↑ 30,0 30,1 30,2 30,3 30,4 30,5 Enyedi P, Czirják G (abril de 2010). "Molecular background of leak K+ currents: two-pore domain potassium channels". Physiological Reviews 90 (2): 559–605. PMID 20393194. doi:10.1152/physrev.00029.2009.
- ↑ 31,0 31,1 31,2 31,3 31,4 31,5 Lotshaw DP (2007). "Biophysical, pharmacological, and functional characteristics of cloned and native mammalian two-pore domain K+ channels". Cell Biochemistry and Biophysics 47 (2): 209–256. PMID 17652773. doi:10.1007/s12013-007-0007-8.
- ↑ Fink M, Lesage F, Duprat F, Heurteaux C, Reyes R, Fosset M, Lazdunski M (xuño de 1998). "A neuronal two P domain K+ channel stimulated by arachidonic acid and polyunsaturated fatty acids". The EMBO Journal 17 (12): 3297–3308. PMC 1170668. PMID 9628867. doi:10.1093/emboj/17.12.3297.
- ↑ Goldstein SA, Bockenhauer D, O'Kelly I, Zilberberg N (marzo de 2001). "Potassium leak channels and the KCNK family of two-P-domain subunits". Nature Reviews. Neuroscience 2 (3): 175–184. PMID 11256078. doi:10.1038/35058574.
- ↑ Sano Y, Inamura K, Miyake A, Mochizuki S, Kitada C, Yokoi H, et al. (xullo de 2003). "A novel two-pore domain K+ channel, TRESK, is localized in the spinal cord". The Journal of Biological Chemistry 278 (30): 27406–27412. PMID 12754259. doi:10.1074/jbc.M206810200.
- ↑ Czirják G, Tóth ZE, Enyedi P (abril de 2004). "The two-pore domain K+ channel, TRESK, is activated by the cytoplasmic calcium signal through calcineurin". The Journal of Biological Chemistry 279 (18): 18550–18558. PMID 14981085. doi:10.1074/jbc.M312229200.
- ↑ Kindler CH, Yost CS, Gray AT (abril de 1999). "Local anesthetic inhibition of baseline potassium channels with two pore domains in tandem". Anesthesiology 90 (4): 1092–1102. PMID 10201682. doi:10.1097/00000542-199904000-00024.
- ↑ 37,0 37,1 37,2 Meadows HJ, Randall AD (marzo de 2001). "Functional characterisation of human TASK-3, an acid-sensitive two-pore domain potassium channel". Neuropharmacology 40 (4): 551–559. PMID 11249964. doi:10.1016/S0028-3908(00)00189-1.
- ↑ Kindler CH, Paul M, Zou H, Liu C, Winegar BD, Gray AT, Yost CS (xullo de 2003). "Amide local anesthetics potently inhibit the human tandem pore domain background K+ channel TASK-2 (KCNK5)". The Journal of Pharmacology and Experimental Therapeutics 306 (1): 84–92. PMID 12660311. doi:10.1124/jpet.103.049809.
- ↑ Punke MA, Licher T, Pongs O, Friederich P (xuño de 2003). "Inhibition of human TREK-1 channels by bupivacaine". Anesthesia and Analgesia 96 (6): 1665–1673. PMID 12760993. doi:10.1213/01.ANE.0000062524.90936.1F.
- ↑ Lesage F, Guillemare E, Fink M, Duprat F, Lazdunski M, Romey G, Barhanin J (marzo de 1996). "TWIK-1, a ubiquitous human weakly inward rectifying K+ channel with a novel structure". The EMBO Journal 15 (5): 1004–1011. PMC 449995. PMID 8605869. doi:10.1002/j.1460-2075.1996.tb00437.x.
- ↑ Duprat F, Lesage F, Fink M, Reyes R, Heurteaux C, Lazdunski M (setembro de 1997). "TASK, a human background K+ channel to sense external pH variations near physiological pH". The EMBO Journal 16 (17): 5464–5471. PMC 1170177. PMID 9312005. doi:10.1093/emboj/16.17.5464.
- ↑ Reyes R, Duprat F, Lesage F, Fink M, Salinas M, Farman N, Lazdunski M (novembro de 1998). "Cloning and expression of a novel pH-sensitive two pore domain K+ channel from human kidney". The Journal of Biological Chemistry 273 (47): 30863–30869. PMID 9812978. doi:10.1074/jbc.273.47.30863.
- ↑ Meadows HJ, Benham CD, Cairns W, Gloger I, Jennings C, Medhurst AD, et al. (abril de 2000). "Cloning, localisation and functional expression of the human orthologue of the TREK-1 potassium channel". Pflügers Archiv 439 (6): 714–722. PMID 10784345. doi:10.1007/s004240050997.
- ↑ "UniProtKB - Q9NPC2 (KCNK9_HUMAN)". Uniprot. Consultado o 2019-05-29.
- ↑ 45,0 45,1 Kennard LE, Chumbley JR, Ranatunga KM, Armstrong SJ, Veale EL, Mathie A (marzo de 2005). "Inhibition of the human two-pore domain potassium channel, TREK-1, by fluoxetine and its metabolite norfluoxetine". British Journal of Pharmacology 144 (6): 821–829. PMC 1576064. PMID 15685212. doi:10.1038/sj.bjp.0706068.
- ↑ Patel AJ, Honoré E, Lesage F, Fink M, Romey G, Lazdunski M (maio de 1999). "Inhalational anesthetics activate two-pore-domain background K+ channels". Nature Neuroscience 2 (5): 422–426. PMID 10321245. doi:10.1038/8084.
- ↑ Gray AT, Zhao BB, Kindler CH, Winegar BD, Mazurek MJ, Xu J, et al. (xuño de 2000). "Volatile anesthetics activate the human tandem pore domain baseline K+ channel KCNK5". Anesthesiology 92 (6): 1722–1730. PMID 10839924. doi:10.1097/00000542-200006000-00032.
- ↑ Kirsch GE, Narahashi T (xuño de 1978). "3,4-diaminopyridine. A potent new potassium channel blocker". Biophysical Journal 22 (3): 507–512. Bibcode:1978BpJ....22..507K. PMC 1473482. PMID 667299. doi:10.1016/s0006-3495(78)85503-9.
- ↑ 49,0 49,1 Judge SI, Bever CT (xullo de 2006). "Potassium channel blockers in multiple sclerosis: neuronal Kv channels and effects of symptomatic treatment". Pharmacology & Therapeutics 111 (1): 224–259. PMID 16472864. doi:10.1016/j.pharmthera.2005.10.006.
- ↑ Tiku PE, Nowell PT (decembro de 1991). "Selective inhibition of K(+)-stimulation of Na,K-ATPase by bretylium". British Journal of Pharmacology 104 (4): 895–900. PMC 1908819. PMID 1667290. doi:10.1111/j.1476-5381.1991.tb12523.x.
- ↑ Hille B (maio de 1967). "The selective inhibition of delayed potassium currents in nerve by tetraethylammonium ion". The Journal of General Physiology 50 (5): 1287–1302. PMC 2225709. PMID 6033586. doi:10.1085/jgp.50.5.1287.
- ↑ Armstrong CM (outubro de 1971). "Interaction of tetraethylammonium ion derivatives with the potassium channels of giant axons". The Journal of General Physiology 58 (4): 413–437. PMC 2226036. PMID 5112659. doi:10.1085/jgp.58.4.413.
- ↑ "Amiodarone". Drugbank. Consultado o 2019-05-28.
- ↑ Rogawski MA, Bazil CW (xullo de 2008). "New molecular targets for antiepileptic drugs: alpha(2)delta, SV2A, and K(v)7/KCNQ/M potassium channels". Current Neurology and Neuroscience Reports 8 (4): 345–352. PMC 2587091. PMID 18590620. doi:10.1007/s11910-008-0053-7.
- ↑ 55,0 55,1 Doyle DA, Morais Cabral J, Pfuetzner RA, Kuo A, Gulbis JM, Cohen SL, et al. (abril de 1998). "The structure of the potassium channel: molecular basis of K+ conduction and selectivity". Science 280 (5360): 69–77. Bibcode:1998Sci...280...69D. PMID 9525859. doi:10.1126/science.280.5360.69.
- ↑ MacKinnon R, Cohen SL, Kuo A, Lee A, Chait BT (abril de 1998). "Structural conservation in prokaryotic and eukaryotic potassium channels". Science 280 (5360): 106–109. Bibcode:1998Sci...280..106M. PMID 9525854. doi:10.1126/science.280.5360.106.
- ↑ Armstrong C (abril de 1998). "The vision of the pore". Science 280 (5360): 56–57. PMID 9556453. doi:10.1126/science.280.5360.56.
- ↑ "The Nobel Prize in Chemistry 2003". The Nobel Foundation. Consultado o 2007-11-16.
- ↑ Zhou Y, Morais-Cabral JH, Kaufman A, MacKinnon R (novembro de 2001). "Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0 A resolution". Nature 414 (6859): 43–48. Bibcode:2001Natur.414...43Z. PMID 11689936. doi:10.1038/35102009.
- ↑ Lodish H, Berk A, Kaiser C, Krieger M, Bretscher A, Ploegh H, et al. (2016). Molecular Cell Biology (8th ed.). New York, NY: W. H. Freeman and Company. p. 499. ISBN 978-1-4641-8339-3.
- ↑ Sauer DB, Zeng W, Raghunathan S, Jiang Y (outubro de 2011). "Protein interactions central to stabilizing the K+ channel selectivity filter in a four-sited configuration for selective K+ permeation". Proceedings of the National Academy of Sciences of the United States of America 108 (40): 16634–16639. Bibcode:2011PNAS..10816634S. PMC 3189067. PMID 21933962. doi:10.1073/pnas.1111688108.
- ↑ 62,0 62,1 Hellgren M, Sandberg L, Edholm O (marzo de 2006). "A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study". Biophysical Chemistry 120 (1): 1–9. PMID 16253415. doi:10.1016/j.bpc.2005.10.002.
- ↑ Noskov SY, Roux B (febreiro de 2007). "Importance of hydration and dynamics on the selectivity of the KcsA and NaK channels". The Journal of General Physiology 129 (2): 135–143. PMC 2154357. PMID 17227917. doi:10.1085/jgp.200609633.
- ↑ Noskov SY, Bernèche S, Roux B (outubro de 2004). "Control of ion selectivity in potassium channels by electrostatic and dynamic properties of carbonyl ligands". Nature 431 (7010): 830–834. Bibcode:2004Natur.431..830N. PMID 15483608. doi:10.1038/nature02943.
- ↑ Varma S, Rempe SB (agosto de 2007). "Tuning ion coordination architectures to enable selective partitioning". Biophysical Journal 93 (4): 1093–1099. Bibcode:2007BpJ....93.1093V. PMC 1929028. PMID 17513348. arXiv:physics/0608180. doi:10.1529/biophysj.107.107482.
- ↑ Thomas M, Jayatilaka D, Corry B (outubro de 2007). "The predominant role of coordination number in potassium channel selectivity". Biophysical Journal 93 (8): 2635–2643. Bibcode:2007BpJ....93.2635T. PMC 1989715. PMID 17573427. doi:10.1529/biophysj.107.108167.
- ↑ Bostick DL, Brooks CL (maio de 2007). "Selectivity in K+ channels is due to topological control of the permeant ion's coordinated state". Proceedings of the National Academy of Sciences of the United States of America 104 (22): 9260–9265. Bibcode:2007PNAS..104.9260B. PMC 1890482. PMID 17519335. doi:10.1073/pnas.0700554104.
- ↑ Derebe MG, Sauer DB, Zeng W, Alam A, Shi N, Jiang Y (xaneiro de 2011). "Tuning the ion selectivity of tetrameric cation channels by changing the number of ion binding sites". Proceedings of the National Academy of Sciences of the United States of America 108 (2): 598–602. Bibcode:2011PNAS..108..598D. PMC 3021048. PMID 21187421. doi:10.1073/pnas.1013636108.
- ↑ Morais-Cabral JH, Zhou Y, MacKinnon R (novembro de 2001). "Energetic optimization of ion conduction rate by the K+ selectivity filter". Nature 414 (6859): 37–42. Bibcode:2001Natur.414...37M. PMID 11689935. doi:10.1038/35102000.
- ↑ 70,0 70,1 Yuan P, Leonetti MD, Pico AR, Hsiung Y, MacKinnon R (xullo de 2010). "Structure of the human BK channel Ca2+-activation apparatus at 3.0 A resolution". Science 329 (5988): 182–186. Bibcode:2010Sci...329..182Y. PMC 3022345. PMID 20508092. doi:10.1126/science.1190414.
- ↑ 71,0 71,1 Wu Y, Yang Y, Ye S, Jiang Y (xullo de 2010). "Structure of the gating ring from the human large-conductance Ca(2+)-gated K(+) channel". Nature 466 (7304): 393–397. Bibcode:2010Natur.466..393W. PMC 2910425. PMID 20574420. doi:10.1038/nature09252.
- ↑ 72,0 72,1 Jiang Y, Pico A, Cadene M, Chait BT, MacKinnon R (marzo de 2001). "Structure of the RCK domain from the E. coli K+ channel and demonstration of its presence in the human BK channel". Neuron 29 (3): 593–601. PMID 11301020. doi:10.1016/S0896-6273(01)00236-7.
- ↑ Jiang Y, Lee A, Chen J, Cadene M, Chait BT, MacKinnon R (maio de 2002). "Crystal structure and mechanism of a calcium-gated potassium channel". Nature 417 (6888): 515–522. Bibcode:2002Natur.417..515J. PMID 12037559. doi:10.1038/417515a.
- ↑ Kong C, Zeng W, Ye S, Chen L, Sauer DB, Lam Y, et al. (decembro de 2012). "Distinct gating mechanisms revealed by the structures of a multi-ligand gated K(+) channel". eLife 1: e00184. PMC 3510474. PMID 23240087. doi:10.7554/eLife.00184.
- ↑ Cao Y, Jin X, Huang H, Derebe MG, Levin EJ, Kabaleeswaran V, et al. (marzo de 2011). "Crystal structure of a potassium ion transporter, TrkH". Nature 471 (7338): 336–340. Bibcode:2011Natur.471..336C. PMC 3077569. PMID 21317882. doi:10.1038/nature09731.
- ↑ Uysal S, Cuello LG, Cortes DM, Koide S, Kossiakoff AA, Perozo E (xullo de 2011). "Mechanism of activation gating in the full-length KcsA K+ channel". Proceedings of the National Academy of Sciences of the United States of America 108 (29): 11896–11899. Bibcode:2011PNAS..10811896U. PMC 3141920. PMID 21730186. doi:10.1073/pnas.1105112108.
- ↑ Clayton GM, Silverman WR, Heginbotham L, Morais-Cabral JH (novembro de 2004). "Structural basis of ligand activation in a cyclic nucleotide regulated potassium channel". Cell 119 (5): 615–627. PMID 15550244. doi:10.1016/j.cell.2004.10.030.
- ↑ Jiang Y, Lee A, Chen J, Ruta V, Cadene M, Chait BT, MacKinnon R (maio de 2003). "X-ray structure of a voltage-dependent K+ channel". Nature 423 (6935): 33–41. Bibcode:2003Natur.423...33J. PMID 12721618. doi:10.1038/nature01580.
- ↑ Long SB, Campbell EB, Mackinnon R (agosto de 2005). "Crystal structure of a mammalian voltage-dependent Shaker family K+ channel". Science 309 (5736): 897–903. Bibcode:2005Sci...309..897L. PMID 16002581. doi:10.1126/science.1116269.
- ↑ Antz C, Fakler B (agosto de 1998). "Fast Inactivation of Voltage-Gated K(+) Channels: From Cartoon to Structure". News in Physiological Sciences 13 (4): 177–182. PMID 11390785. doi:10.1152/physiologyonline.1998.13.4.177.
- ↑ Cheng WW, McCoy JG, Thompson AN, Nichols CG, Nimigean CM (marzo de 2011). "Mechanism for selectivity-inactivation coupling in KcsA potassium channels". Proceedings of the National Academy of Sciences of the United States of America 108 (13): 5272–5277. Bibcode:2011PNAS..108.5272C. PMC 3069191. PMID 21402935. doi:10.1073/pnas.1014186108.
- ↑ Cuello LG, Jogini V, Cortes DM, Perozo E (xullo de 2010). "Structural mechanism of C-type inactivation in K(+) channels". Nature 466 (7303): 203–208. Bibcode:2010Natur.466..203C. PMC 3033749. PMID 20613835. doi:10.1038/nature09153.
- ↑ Cuello LG, Jogini V, Cortes DM, Pan AC, Gagnon DG, Dalmas O, et al. (xullo de 2010). "Structural basis for the coupling between activation and inactivation gates in K(+) channels". Nature 466 (7303): 272–275. Bibcode:2010Natur.466..272C. PMC 3033755. PMID 20613845. doi:10.1038/nature09136.
- ↑ Luzhkov VB, Aqvist J (febreiro de 2005). "Ions and blockers in potassium channels: insights from free energy simulations". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics 1747 (1): 109–120. PMID 15680245. doi:10.1016/j.bbapap.2004.10.006.
- ↑ Luzhkov VB, Osterberg F, Aqvist J (novembro de 2003). "Structure-activity relationship for extracellular block of K+ channels by tetraalkylammonium ions". FEBS Letters 554 (1–2): 159–164. PMID 14596932. doi:10.1016/S0014-5793(03)01117-7.
- ↑ Posson DJ, McCoy JG, Nimigean CM (febreiro de 2013). "The voltage-dependent gate in MthK potassium channels is located at the selectivity filter". Nature Structural & Molecular Biology 20 (2): 159–166. PMC 3565016. PMID 23262489. doi:10.1038/nsmb.2473.
- ↑ Choi KL, Mossman C, Aubé J, Yellen G (marzo de 1993). "The internal quaternary ammonium receptor site of Shaker potassium channels". Neuron 10 (3): 533–541. PMID 8461140. doi:10.1016/0896-6273(93)90340-w.
- ↑ Piasta KN, Theobald DL, Miller C (outubro de 2011). "Potassium-selective block of barium permeation through single KcsA channels". The Journal of General Physiology 138 (4): 421–436. PMC 3182450. PMID 21911483. doi:10.1085/jgp.201110684.
- ↑ Neyton J, Miller C (novembro de 1988). "Potassium blocks barium permeation through a calcium-activated potassium channel". The Journal of General Physiology 92 (5): 549–567. PMC 2228918. PMID 3235973. doi:10.1085/jgp.92.5.549.
- ↑ Lockless SW, Zhou M, MacKinnon R (maio de 2007). "Structural and thermodynamic properties of selective ion binding in a K+ channel". PLOS Biology 5 (5): e121. PMC 1858713. PMID 17472437. doi:10.1371/journal.pbio.0050121.
- ↑ Jiang Y, MacKinnon R (marzo de 2000). "The barium site in a potassium channel by x-ray crystallography". The Journal of General Physiology 115 (3): 269–272. PMC 2217209. PMID 10694255. doi:10.1085/jgp.115.3.269.
- ↑ Lam YL, Zeng W, Sauer DB, Jiang Y (agosto de 2014). "The conserved potassium channel filter can have distinct ion binding profiles: structural analysis of rubidium, cesium, and barium binding in NaK2K". The Journal of General Physiology 144 (2): 181–192. PMC 4113894. PMID 25024267. doi:10.1085/jgp.201411191.
- ↑ Guo R, Zeng W, Cui H, Chen L, Ye S (agosto de 2014). "Ionic interactions of Ba2+ blockades in the MthK K+ channel". The Journal of General Physiology 144 (2): 193–200. PMC 4113901. PMID 25024268. doi:10.1085/jgp.201411192.
- ↑ Mizutani S, Prasad SM, Sellitto AD, Schuessler RB, Damiano RJ, Lawton JS (agosto de 2005). "Myocyte volume and function in response to osmotic stress: observations in the presence of an adenosine triphosphate-sensitive potassium channel opener". Circulation 112 (9 Suppl): I219–23. PMID 16159820. doi:10.1161/CIRCULATIONAHA.104.523746.
- ↑ Wang T (febeiro de 2003). "The effects of the potassium channel opener minoxidil on renal electrolytes transport in the loop of henle". J. Pharmacol. Exp. Ther. 304 (2): 833–40. PMID 12538840. doi:10.1124/jpet.102.043380.
- ↑ Sudo H, Yogo K, Ishizuka N, Otsuka H, Horie S, Saito K (novembro de 2008). "Nicorandil, a potassium channel opener and nitric oxide donor, improves the frequent urination without changing the blood pressure in rats with partial bladder outlet obstruction". Biol. Pharm. Bull. 31 (11): 2079–82. PMID 18981577. doi:10.1248/bpb.31.2079.
- ↑ Stojnic N, Gojkovic-Bukarica L, Peric M, et al. (xuño de 2007). "Potassium channel opener pinacidil induces relaxation of the isolated human radial artery". J. Pharmacol. Sci. 104 (2): 122–9. PMID 17538231. doi:10.1254/jphs.FP0061434.
- ↑ Rundfeldt C (outubro de 1997). "The new anticonvulsant retigabine (D-23129) acts as an opener of K+ channels in neuronal cells". European Journal of Pharmacology 336 (2–3): 243–9. PMID 9384239. doi:10.1016/S0014-2999(97)01249-1.
- ↑ Main MJ, Cryan JE, Dupere JR, Cox B, Clare JJ, Burbidge SA (agosto de 2000). "Modulation of KCNQ2/3 potassium channels by the novel anticonvulsant retigabine". Molecular Pharmacology 58 (2): 253–62. PMID 10908292. doi:10.1124/mol.58.2.253.
- ↑ Krapivinsky G, Gordon EA, Wickman K, Velimirović B, Krapivinsky L, Clapham DE (marzo de 1995). "The G-protein-gated atrial K+ channel IKACh is a heteromultimer of two inwardly rectifying K(+)-channel proteins". Nature 374 (6518): 135–141. Bibcode:1995Natur.374..135K. PMID 7877685. doi:10.1038/374135a0.
- ↑ Corey S, Krapivinsky G, Krapivinsky L, Clapham DE (febreiro de 1998). "Number and stoichiometry of subunits in the native atrial G-protein-gated K+ channel, IKACh". The Journal of Biological Chemistry 273 (9): 5271–5278. PMID 9478984. doi:10.1074/jbc.273.9.5271.
- ↑ Kunkel MT, Peralta EG (novembro de 1995). "Identification of domains conferring G protein regulation on inward rectifier potassium channels". Cell 83 (3): 443–449. PMID 8521474. doi:10.1016/0092-8674(95)90122-1.
- ↑ Wickman K, Krapivinsky G, Corey S, Kennedy M, Nemec J, Medina I, Clapham DE (abril de 1999). "Structure, G protein activation, and functional relevance of the cardiac G protein-gated K+ channel, IKACh". Annals of the New York Academy of Sciences 868 (1): 386–398. Bibcode:1999NYASA.868..386W. PMID 10414308. doi:10.1111/j.1749-6632.1999.tb11300.x. Arquivado dende o orixinal o 2006-01-29.
- ↑ Ball P (marzo de 2008). "The crucible: Art inspired by science should be more than just a pretty picture". Chemistry World 5 (3): 42–43. Consultado o 2009-01-12.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
- Canle de calcio
- Canle de ión potasio rectificadora interna
- O potasio en bioloxía
- Familia do transportador de potasio (Trk)
- Permease de captación de potasio
- Canle de sodio
Ligazóns externas[editar | editar a fonte]
- Proteopedia channel Potassium channel en 3D
- Potassium Channels Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- Neuromuscular Disease Center (2008-03-04). "Potassium Channels". Washington University in St. Louis. Consultado o 2008-03-10.
