Anemia drepanocítica
| Advertencia: A Wikipedia non dá consellos médicos. Se cre que pode requirir tratamento, por favor, consúltello ao médico. |
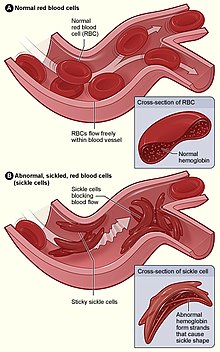
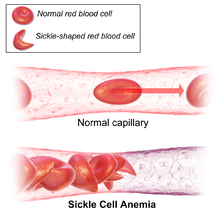


A anemia drepanocítica (tamén chamada anemia causada por drepanocitos, enfermidade da hemogloblina SS, enfermidade de células falciformes ou anemia falciforme) é unha enfermidade hereditaria, é dicir, que se transmite de pais a fillos e que se caracteriza por unha alteración da hemoglobina, proteína encargada de transportar o osíxeno no sangue. Os glóbulos vermellos cambian e adoptan unha forma semellante a unha fouce, de aquí o nome de anemia falciforme (falcem é fouce en latín).
Causas
[editar | editar a fonte]A anemia drepanocítica é causada por un tipo anormal de hemoglobina chamada hemoglobina S, que distorsiona a forma dos glóbulos vermellos e produce alteracións no fluxo sanguíneo.
Esta enfermidade hérdase como un trazo autosómico recesivo, aparece cando un individuo herda o alelo da enfermidade dos dous proxenitores. Todas as persoas temos normalmente 23 pares de cromosomas, en cada par un cromosoma é herdado da nai e outro do pai; isto quere dicir que, por exemplo, para un trazo determinado temos un xene materno e outro paterno. Os xenes teñen variantes chamadas alelos; no caso da hemoglobina o alelo normal chámase A e o alelo alternativo é o S. Os individuos AA son normais. En caso de que un dos xenes leve o alelo dominante (con funcionalidade normal) e o outro o recesivo, isto significa que a persoa non padece a enfermidade (no mesmo grao, pero pode presentar síntomas máis leves chamados trazo falciforme), pola contra, padécea cando herda o alelo defectuoso de ámbolos dous proxenitores.
O defecto xenético causante é unha mutación no xene da β-globina que afecta a un só nucleótido, na cal unha adenina (A) substitúese por unha timina (T), facendo que un codón para o glutamato (E ou Glu) sexa substituído por un codón para a valina (V ou Val) na posición 6 (substitución E6V).[1][nota 1] A hemoglobina S con esta mutación denomínase HbS, en oposición á hemoglobina adulta normal HbA. Esta é normalmente unha mutación benigna que non causa efectos aparentes nas estruturas secundaria, terciaria e cuaternaria da hemoglobina en condicións normais de concentración de osíxeno. Porén en concentracións baixas de osíxeno, a HbS polimerízase e forma precipitados fibrosos (agregados liñais) porque a forma desoxi da hemoglobina expón un tramo hidrófobo da proteína entre as hélices E e F (Phe 85, Leu 88).[2] Este tipo de polimerización é escasa nos heterocigotos, pero importante nos homocigotos, nos cales a presenza de polímeros de cadea longa distorsiona a forma dos glóbulos vermellos, que se fan falciformes (forma de lúa crecente ou outras formas anormais) e aparece a enfermidade.
A mutación probablemente se orixinou espontaneamente en diferentes áreas xeográficas, como indican as análises con endonucleases de restrición, creando diversas variantes. Estas variantes denomínanse Camerún, Senegal, Benin, Bantú e Saudita-Asiática. As variantes teñen importancia clínica, porque algunhas, como a Senegal e Saudita-Asiática tenden a producir anemias máis leves.[3]
A mutación é máis frecuente en países onde hai unha gran prevalencia da malaria ou en persoas que proceden deles. Parece que a mutación foi seleccionada durante a evolución nesas poboacións porque os heterocigotos están protexidos da malaria (que só lles poduce síntomas leves) e non teñen anemia grave.[4][5]
Incidencia
[editar | editar a fonte]Esta doenza é máis común en determinados grupos étnicos, por exemplo, en Estados Unidos, afecta sobre todo aos individuos de raza negra, aproximadamente 1 de cada 400 a padece.
Tamén ten unha elevada frecuencia en rexións de África, área mediterránea e Oriente Medio.
Sintomatoloxía
[editar | editar a fonte]Aínda que a enfermidade está presente ó nacer, os síntomas polo xeral, comezan a acontecer sobre os 4/6 meses de idade e consisten na distensión do abdome, dilatación do corazón e edema de mans e pés. Tamén pode producirse un atraso da maduración sexual na adolescencia.
Os síntomas débense as alteracións na hemoglobina, que cambia de forma cando a cantidade de osíxeno no sangue se reduce debido a calquera razón.
Poden presentarse episodios dolorosos que aparecen como consecuencia de vasos sanguíneos bloqueados ou órganos danados. Existen varios tipos de crise:
- Crise hemolítica: acontece cando se danan os glóbulos vermellos.
- Crise de secuestro esplénico: cando o bazo se agranda e atrapa células sanguíneas.
- Crise aplásica: cando unha infección fai que a medula ósea deixe de producir glóbulos vermellos.
Estas crises ocorren en case todos os pacientes nalgún momento das súas vidas, poden durar de horas a días e afectan aos ósos das costas, aos ósos longos e ao tórax. As crises repetitivas poden ocasionar danos nos riles, nos pulmóns, nos ósos, o fígado e no sistema nervioso central.
Os síntomas máis comúns son:
- Ataques de dor abdominal.
- Dor de ósos.
- Dor no peito.
- Atraso do crecemento e da maduración sexual na adolescencia.
- Febre.
- Fatiga.
- Visión deficiente.
- Taquicardia.
- Palidez.
- Susceptibilidade ás infeccións.
- Úlceras nas pernas.
- Ouriños sanguinolentos (hematuria).
- Sede desmesurada.
- Micción frecuente (poliúria).
- Erección dolorosa (priapismo).
Tratamento
[editar | editar a fonte]O tratamento baséase na paliación dos síntomas, manexar e controlar os mesmos, así como, intentar diminuír a frecuencia das crises. Requírese un tratamento continuo cun suplemento de ácido fólico, esencial na produción das células. Tamén se administran vacinas e antibióticos para evitar as infección bacterianas nos nenos con enfermidade drepanocítica.
Os transplantes de medula ósea poden curar a enfermidade, pero só son recomendados nunha pequena parte dos pacientes, sobre todo debido ao alto risco, xa que, as drogas que se precisan para realizar o transplante son moi tóxicas e resulta complicado encontrar doadores axeitados. Ademais, é un procedemento moi custoso comparado cós outros tratamentos.
Complicacións
[editar | editar a fonte]- Síndrome torácico agudo.
- Cegueira.
- Morte.
- Disfunción eréctil.
- Cálculos.
- Infeccións.
- Destrución articular.
- Úlceras nas pernas.
- Perda do funcionamento do bazo.
- Enfermidade multisistémica.
- Consumo excesivo de narcóticos.
- Síntomas neurolóxicos.
- Crises hemolítica e aplásica recorrente que produce anemia e cálculos.
- Necrose nos riles.
As causas da morte son a infección e a insuficiencia dos órganos, algunhas persoas afectadas padecen episodios menores, pouco frecuentes e que duran pouco tempo e, pola contra, outras experimentan episodios máis graves, de máis tempo e con moita frecuencia que ocasionan importantes complicacións.
Notas e referencias
[editar | editar a fonte]Notas
[editar | editar a fonte]- ↑ A numeración histórica da posición dos residuos de aminoácidos da proteína poñía o residuo de ácido glutámico na posición 6 debido a que se saltaban a metionina (M ou Met) do codón de iniciación. Porén, na nomenclatura actual cóntase a metionina como primeiro aminoácido, polo que o ácido glutámico estaría en posición 7. Moitas referencias aínda indican a posición antiga, 6, e outras a moderna, 7.
Referencias
[editar | editar a fonte]- ↑ Clancy S (2008). "Genetic mutation". Nature Education 1 (1): 187.
- ↑ Odièvre MH, Verger E, Silva-Pinto AC, Elion J (outubro de 2011). "Pathophysiological insights in sickle cell disease". The Indian Journal of Medical Research 134 (1): 532–537. PMC 3237253. PMID 22089617. doi:10.1007/bf00168807.
- ↑ Green NS, Fabry ME, Kaptue-Noche L, Nagel RL (outubro de 1993). "Senegal haplotype is associated with higher HbF than Benin and Cameroon haplotypes in African children with sickle cell anemia". American Journal of Hematology 44 (2): 145–146. PMID 7505527. doi:10.1002/ajh.2830440214.
- ↑ Kwiatkowski DP (agosto de 2005). "How malaria has affected the human genome and what human genetics can teach us about malaria". American Journal of Human Genetics 77 (2): 171–192. PMC 1224522. PMID 16001361. doi:10.1086/432519.
- ↑ Allison AC (October 2009). "Genetic control of resistance to human malaria". Current Opinion in Immunology 21 (5): 499–505. PMID 19442502. doi:10.1016/j.coi.2009.04.001.

