Hemoglobina A

A hemoglobina A (HbA), tamén chamada hemoglobina adulta, hemoglobina A1 ou α2β2, é o tetrámero máis común da hemoglobina humana, supoñendo un 97% da hemoglobina total dos glóbulos vermellos.[1] A hemoglobina é unha proteína que se une ao oxíxeno, que se atopa dentro dos glóbulos vermellos ou eritrocitos, que transporta oxíxeno desde os pulmóns aos tecidos.[2] A hemoglobina A contén dúas subunidades alfa e dúas beta (α2β2).[3] A hemoglobina A2 (HbA2) é unha forma menos común de hemoglobina nos adultos e está composta por dúas subunidades alfa e dúas subunidades de delta-globina. Esta hemoglobina constitúe o 1-3% da hemoglobina nos adultos.[4]
Estrutura e función
[editar | editar a fonte]A hemoglobina A (HbA) é un tetrámero formado por dúas subunidades alfa e dúas beta (α2β2).[3] Cada subunidade contén un grupo hemo con ferro ao cal se unen moléculas de oxíxeno diatómico (O2).[5] Ademais do oxíxeno, a ensamblaxe da subunidade e a estrutura cuaternaria é importante para a afinidade para a unión de moléculas. Cando a hemoglobina se une ao O2 (oxihemoglobina), únese ao ión de ferro II (Fe2+) do hemo para transportalo e liberalo nos tecidos.[2] Todas as subunidades deben estar presentes para que a hemoglobina capte e libere o oxíxeno en condicións normais.[6]
Síntese
[editar | editar a fonte]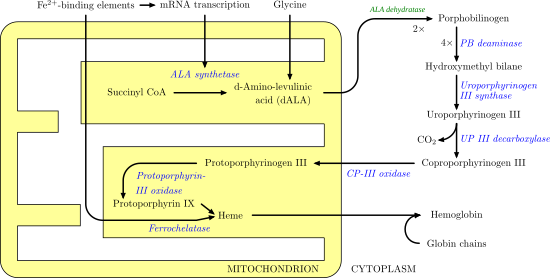
Síntese do hemo
[editar | editar a fonte]A síntese do hemo implica unha serie de pasos encimáticos que teñen lugar dentro da mitocondria e no citosol da célula. Primeiro, nas mitocondrias ten lugar a condensación do succinil-CoA e a glicina pola ALA sintase para producir ácido 5-aminolevulínico (ALA). O ALA móvese despois ao citosol e despois dunha serie de reaccións crea o coproporfirinóxeno III. Esta molécula trasládase de volta ás mitocondrias, onde reacciona coa protoporfirina-III oxidase para producir a protoporfirina IX. O ferro é despois inserido encimaticamente na protoporfirina pola ferroquelatase para producir o hemo.[7]
Síntese da globina
[editar | editar a fonte]A síntese da globina ten lugar nos ribosomas do citosol. Dúas cadeas de globina que teñen grupos hemo combínanse para formar a hemoglobina. Unha das cadeas é unha cadea alfa e a outra é unha cadea non alfa. A natureza da cadea non alfa nas moléculas de hemoglobina varía debido a diferentes variables. Os fetos teñen unha cadea distinta da alfa, chamada gamma (e forman a hemoglobina F) e despois do nacemento en vez da gamma pasan a formar a cadea beta (e forman hemoglobina A). Este cambio de hemoglobina F á hemoglobina A ocorre cinco ou seis meses despois do nacemento. Os xenes que codifican as cadeas alfa están localizados no cromosoma 16, mentres que os que codifican as cadeas non alfa están no cromosoma 11.[7]
Importancia clínica
[editar | editar a fonte]Debido aos numerosos pasos e procesos que hai na síntese da hemoglobina, hai moitos sitios onde poden ocorrer erros. A síntese do hemo implica acción de múltiples encimas e cando estes encimas son deficientes ou non funcionan axeitadamente, como consecuencia de mutacións ou delecións, ou cando ocorre o mesmo cos xenes da globina, poden ocorrer varias enfermidades.[2] Os trastornos dos xenes da globina orixinan hemoglobinopatías que poden ser causadas por variantes anormais da globina (anemia falciforme) ou pola redución da síntese da cadea en células eritroides (talasemia) durante a hematopoese.[8] Estas hemoglobinopatías adoitan ser trazos autosómicos recesivos.[9]
Notas
[editar | editar a fonte]- ↑ "Hemoglobinopathies". Consultado o 2009-02-06.
- ↑ 2,0 2,1 2,2 Farid, Yostina; Lecat, Paul (2019). Biochemistry, Hemoglobin Synthesis. StatPearls (StatPearls Publishing). PMID 30725597. Consultado o 2019-04-10.
- ↑ 3,0 3,1 Immigrant medicine. Walker, Patricia Frye., Barnett, Elizabeth D. (Elizabeth Day). St. Louis, Mo.: Elsevier Mosby. 2007. ISBN 9780323034548. OCLC 489070888.
- ↑ Kato, Gregory J.; Piel, Frédéric B.; Reid, Clarice D.; Gaston, Marilyn H.; Ohene-Frempong, Kwaku; Krishnamurti, Lakshmanan; Smith, Wally R.; Panepinto, Julie A.; Weatherall, David J. (2018-03-15). "Sickle cell disease" (PDF). Nature Reviews Disease Primers 4: 18010. ISSN 2056-676X. PMID 29542687. doi:10.1038/nrdp.2018.10. hdl:10044/1/57817.
- ↑ Barrick, Doug; Lukin, Jonathan A; Simplaceanu, Virgil; Ho, Chien (2004). Nuclear Magnetic Resonance Spectroscopy in the Study of Hemoglobin Cooperativity. Methods in Enzymology 379 (Elsevier). pp. 28–54. ISBN 9780121827830. PMID 15051350. doi:10.1016/s0076-6879(04)79002-3.
- ↑ "Hemoglobin Overview". sickle.bwh.harvard.edu. Consultado o 2019-04-10.
- ↑ 7,0 7,1 "Hemoglobin Synthesis". sickle.bwh.harvard.edu. Consultado o 2019-04-11.
- ↑ Weatherall, D. J. (1980–1981). "The thalassemia syndromes". Texas Reports on Biology and Medicine 40: 323–333. ISSN 0040-4675. PMID 7034274.
- ↑ Farashi, Samaneh; Harteveld, Cornelis L. (May 2018). "Molecular basis of α-thalassemia". Blood Cells, Molecules and Diseases 70: 43–53. PMID 29032940. doi:10.1016/j.bcmd.2017.09.004.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Variantes da hemoglobina:
Subunidades proteicas da hemoglobina (xenes):
Ligazóns externas
[editar | editar a fonte]- Hemoglobin A Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
