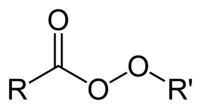
Peróxido orgánico

Os peróxidos orgánicos son compostos orgánicos que conteñen o grupo funcional peróxido (ROOR′). Se R′ é hidróxeno, os compostos denomínanse hidroperóxidos orgánicos. Os perésteres teñen a estrutura xeral RC(O)OOR. O enlace O−O rompe facilmente, producindo radicais libres da forma RO• (o punto representa un electrón desapareado). Así, os peróxidos orgánicos son útiles como iniciadores en varios tipos de polimerización, como as resinas epoxi usadas en plásticos reforzados con vidro. Para este propósito utilízanse comunmente o MEKP e o peróxido de benzoílo. Porén, a mesma propiedade tamén determina que os peróxidos orgánicos poidan intencionalmente ou non iniciar unha polimerización explosiva en materiais con enlaces químicos insaturados, e este proceso pode utilizarse en explosivos. Os peróxidos orgánicos, igual que os inorgánicos, son potentes axentes branqueantes.[1]

Propiedades[editar | editar a fonte]
A lonxitude do enlace O−O nos peróxidos é duns 1,45 Å con ángulos R−O−O (onde R = H, C) duns 110° (similar aos da auga). Caracteristicamente, os ángulos diedros C−O−O−R (R = H, C) son duns 120°. O enlace O−O é relativamente feble, cunha enerxía de disociación de enlace de 45–50 kcal/mol, que é menos da metade da forza dos enlaces C−C, C−H e C−O.[2][3]
As principais clases de peróxidos orgánicos son:
- Hidroperóxidos, compostos coa funcionalidade ROOH (R = alquilo).
- Peroxiácidos e peroxiésteres, compostos coa funcionalidade RC(O)OOH e RC(O)OOR' (R,R' = alquilo, arilo).
- Diacilperóxidos, compostos coa funcionalidade RC(O)OOC(O)R (R = alquilo, arilo).
- Dialquilperóxidos, compostos coa funcionalidade ROOR (R = alquilo).
Estes compostos aparecen na natureza ou son útiles en comercialmente. Coñécense tamén outros compostos peroxi máis especializados.[4]
Bioloxía[editar | editar a fonte]

Os peróxidos desempeñan un importante papel en bioloxía. Coñécense centos de peróxidos e hidroperóxidos, que derivan de ácidos graxos, esteroides e terpenos. Por exemplo, derivan de ácidos graxos varios 1,2-dioxenos. A biosíntese de prostaglandins realízase a través dun endoperóxido, un tipo de peróxido bicíclico.[5] No vagalume, a oxidación da luciferina, que é catalizada polo enzima luciferase, rende un composto peroxi, o 1,2-dioxetano. O dioxetano é inestable e descomponse espontaneamente a dióxido de carbono e cetonas excitadas, as cales liberan o exceso de enerxía emitindo luz (bioluminescencia).[6]

Usos industriais[editar | editar a fonte]
En química de polímeros[editar | editar a fonte]
O peróxido de dibenzoílo utilízase como iniciador de radical que axuda á polimerización de acrilatos. As resinas industriais baseadas en ésteres de ácido metaacrilico e/ou acrílicos prodúcense invariablemente por polimerización de radical con peróxidos orgánicos a elevadas temperaturas.[7] A velocidade de polimerización axústase elixindo unha temperatura e tipo de peróxidos axeitados.[8]
O peróxido de metiletilcetona, o peróxido de benzoílo e en menos medida o peróxido de acetona utilízanse como iniciadores para a polimerización de radical dalgunhas resinas, por exemplo, o poliéster e a silicona, que se encontran a miúdo cando se fabrica fibra de vidro. O hidroperóxido de pinano utilízase na produción de estireno-butadieno (caucho sintético).
Axentes branqueantes e desinfectantes[editar | editar a fonte]
O peróxido de benzoílo e o peróxido de hidróxeno utilízanse como axentes branqueantes e de "maduración" para tratar a fariña para facer que o gran de trigo libere máis doadamente o glute; a alternativa é deixar que a fariña se oxide lentamente ao aire, o cal é un proceso demasiado lento para as necesidades da era industrial. O peróxido de benzoílo é un eficaz medicamento tópico para tratar maioría das formas de acne.
Preparación[editar | editar a fonte]
A partir de peróxido de hidróxeno[editar | editar a fonte]
Os dialquilsulfatos reaccionan co peróxido de hidróxeno alcalino.[9] Neste método, o sulfato de alquilo doa o grupo alquilo e o ión sulfato forma o grupo que sae:
Este método pode tamén render peróxidos cíclicos.[10] Os dioxetanos de catro membros poden obterse por cicloadición 2+2 de oxíxeno a alquenos.[11]
Reaccións[editar | editar a fonte]
Os organoperóxidos poden ser reducidos a alcohois con hidruro de litio aluminio, como se describe nesta ecuación idealizada:
- 4 ROOH + LiAlH4 → LiAlO2 + 2 H2O + 4 ROH
Os ésteres de fosfito e fosfinas terciarias tamén efectúan a redución:
- ROOH + PR3 → OPR3 + ROH
Clivaxe de cetonas e alcohois no rearranxo de Kornblum–DeLaMare
Algúns peróxidos son fármacos cuxa acción está baseada na formación de radicais en lugares desexados do organismo. Por exemplo, a artemisinina e os seus derivados, como o artesunato, posúen a acción máis rápida de todos os fármacos actuais contra a malaria por Plasmodium falciparum.[12] O artesunato tamén é eficaz reducindo a produción de ovos do trematodo na infección por Schistosoma haematobium.[13]

Utilízanse varios métodos analíticos para a determinación cuantitativa e cualitativa de peróxidos.[14] Unha detección cualitativa simple de peróxidos lévase a cabo coa reacción do ioduro-amidón.[15] Aquí, os peróxidos, hidroperóxidos ou perácidos oxidan o ioduro potásico engadido a iodo, o cal reacciona co amidón producindo unha cor azul escura. Existen indicadores de papel comerciais que usan esta reacción. Este método é tamén axeitado para a avaliación cuantitativa, pero pode non distinguir entre diferentes tipos de compostos peróxido. A decoloración de varias tinturas índigo en presenza de peróxidos utilízase para este propósito.[16] Por exemplo, a perda da cor azul no leuco-azul de metileno é selectiva para o peróxido de hidróxeno.[17]
A análise cuantitativa de hidroperóxidos pode realizarse usando titulación potenciométrica con hidruro de litio aluminio.[18] Outro modo de avaliar o contido de perácidos e peróxidos é a titulación volumétrica con alcóxidos como o etóxido de sodio.[19]
Oxíxeno activo en peróxidos[editar | editar a fonte]
O grupo peróxido considérase que contén un átomo de oxíxeno activo. O concepto de contido de oxíxeno activo é útil para comparar a concentración relativa de grupos peróxido en formulacións, que está relacionado co contido en enerxía. En xeral, o contido de enerxía increméntase á vez que o contido en oxíxeno activo e así canto maior é o peso molecular dos grupos orgánicos, menor é o contido en enerxía e, normalmente, menor a perigosidade do produto.
O termo oxíxeno activo utilízase para especificar a cantidade de peróxido presente en calquera formulación de peróxidos orgánicos. Un dos átomos de oxíxeno de cada grupo peróxido considérase "activo". A cantidade teórica de oxíxeno activo pode describirse pola seguinte ecuación:[20]
- A[O]teórico (%) = 16p/m × 100,
onde p é o número de grupos peróxido da molécula e m é a masa molecular do peróxido puro.
Os peróxidos orgánicos véndense xeralmente en formulacións que inclúen un ou máis axentes flegmatizantes (desensibilizadores ou estabilizadores). É dicir, por motivos de seguridade ou polos beneficios nas prestacións do produto as propiedades dunha formulación de peróxidos orgánicos son normalmente modificadas por meido do uso de aditivos para flegmatizar, estabilizar ou ás veces potenciar o peróxido orgánico para o seu uso comercial. As formulacións comerciais constan en ocasións de mesturas de peróxidos orgánicos, as cales poden ser flegmatizadas ou non.
Descomposición térmica de peróxidos orgánicos[editar | editar a fonte]
Os peróxidos orgánicos son útiles en síntese química debido á súa propensión á descomposición térmica. Ao descompoñérense xeran radicais libres útiles que poden iniciar a polimerización para crear polímeros, modificar polímeros por enxerto ou visbreaking (~viscorredución) ou o establecemento de enlaces cruzados para crear un polímero termoestable (thermoset). Cando se utilizan para estes propósitos, o peróxido está moi diluído, polo que a calor xerada pola descomposición exotérmica é absorbida con seguridade polo medio que o rodea (por exemplo, un composto polímero ou emulsión). Mais cando o peróxido está nunha forma máis pura, a calor creada pola súa descomposición pode que non se disipe tan rapidamente como se xera, o cal pode ter como resultado un incremento da temperatura, o cal intensifica máis a velocidade de descomposición exotérmica. Isto pode crear unha situación perigosa coñecida como descomposición autoacelerante.
Prodúcese unha descomposición autoacelerante cando a velocidade de descomposición do peróxido é dabondo alta como para xerar calor a unha velocidade máis rápida que a de disipación no ambiente. A temperatura é o principal factor na velocidade de descomposición. A temperatura máis baixa á que un peróxido orgánico empaquetado sofre unha descomposición autoacelerante nun período dunha semana defínese como temperatura de descomposición autoacelerante.
Seguridade[editar | editar a fonte]
Os peróxidos son tamén fortes oxidantes e reaccionan facilamente coa pel, polpa de la e algodón.[21] Por razóns de seguridade, os compostos peroxídicos son almacenados en contedores ou recipientes fríos e opacos, xa que a calor e a iluminación aceleran as súas reaccións químicas. As pequenas cantidades de peróxidos, que se orixinan nos recipientes de almacenamento ou reacción poden neutralizarse usando axentes redutores como o sufato de ferro(II). Entre as medidas de seguridade en plantas industriais que producen grandes cantidades de peróxidos están as seguintes:
1) O equipamento está localizado dentro de estruturas de formigón reforzado con fiestras con lámina metálica, que aliviarían a presión e non se fragmentarían en caso de explosión.
2) Os produtos son embotellados en recipientes pequenos e levados a un sitio fresco pouco despois da súa síntese.
3) Os recipientes están feitos de materiias non reactivos como o aceiro inoxidable, certas aliaxes de aluminio ou vidro escuro.[22]
Para unha manipulación con seguridade de peróxidos orgánicos concentrados un parámetro importante é a temperatura da mostra, que debería manterse por debaixo da temperatura de descomposición autoacelerante do composto.[23]
O tansporte de peróxidos orgánicos está restrinxido e regulado en moitos países.
Notas[editar | editar a fonte]
- ↑ Klenk, Herbert; Götz, Peter H.; Siegmeier, Rainer; Mayr, Wilfried, "Peroxy Compounds, Organic", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH
- ↑ Bach, Robert D.; Ayala, Philippe Y.; Schlegel, H. B. (1996). "A Reassessment of the Bond Dissociation Energies of Peroxides. An ab Initio Study". J. Am. Chem. Soc. 118 (50): 12758–12765. doi:10.1021/ja961838i.
- ↑ Otto Exner (1983). "Stereochemical and conformational aspects of peroxy compounds". En Saul Patai. PATAI'S Chemistry of Functional Groups. Wiley. pp. 85–96. ISBN 9780470771730. doi:10.1002/9780470771730.ch2.
- ↑ Saul Patai, ed. (1983). PATAI'S Chemistry of Functional Groups: Peroxides. Wiley. ISBN 9780470771730.
- ↑ D. A. Casteel (1992). "Peroxy Natural Products". Natural Product Reports 9 (4): 289–312. doi:10.1039/np9920900289.
- ↑ Aldo Roda Chemiluminescence and Bioluminescence: Past, Present and Future, p. 57, Royal Society of Chemistry, 2010, ISBN 1-84755-812-7
- ↑ Thomas Brock, Michael Groteklaes, Peter Mischke Lehrbuch der Lacktechnologie, Vincentz Network GmbH & Co KG, 2000, ISBN 3-87870-569-7 p. 67
- ↑ Organische Peroxide für die Polymerisation Arquivado 29 de xuño de 2016 en Wayback Machine.. pergan.com (en alemán)
- ↑ Medwedew, S. S.; Alexejewa, E. N. (1932). "Organic peroxides II. Of the reaction between benzoyl hydroperoxide or benzoyl peroxide and triphenylmethyl". Berichte der Deutschen Chemischen Gesellschaft (A and B Series) 65 (2): 137. doi:10.1002/cber.19320650204.
- ↑ Criegee, Rudolf; Müller, Gerhard (1956). "1.2-Dioxan". Chemische Berichte 89 (2): 238. doi:10.1002/cber.19560890209.
- ↑ Heinz G. O. Becker Organikum, Wiley-VCH, 2001, ISBN 3-527-29985-8, p. 323
- ↑ White NJ (1997). "Assessment of the pharmacodynamic properties of antimalarial drugs in vivo". Antimicrob. Agents Chemother. 41 (7): 1413–22. PMC 163932. PMID 9210658. doi:10.1128/AAC.41.7.1413.
- ↑ Boulangier D, Dieng Y, Cisse B, et al. (2007). "Antischistosomal efficacy of artesunate combination therapies administered as curative treatments for malaria attacks". Trans R Soc Trop Med Hyg 101 (2): 113–16. PMID 16765398. doi:10.1016/j.trstmh.2006.03.003.
- ↑ Légrádi, L.; Légrádi, J. (1970). "Detection of peroxides, hydroperoxides and peracids". Microchimica Acta 58: 119–122. doi:10.1007/BF01218105.
- ↑ Lea, C. H. (1931). "The Effect of Light on the Oxidation of Fats". Proceedings of the Royal Society B: Biological Sciences 108 (756): 175–189. doi:10.1098/rspb.1931.0030.
- ↑ Veibel, S. Analytik organischer Verbindungen, Akademie-Verlag, Berlin, 1960, p. 262
- ↑ Eiss, M. I.; Giesecke, Paul (1959). "Colorimetric Determination of Organic Peroxides". Analytical Chemistry 31 (9): 1558. doi:10.1021/ac60153a038.
- ↑ Higuchi, T.; Zuck, Donald Anton (1951). "Behaviors of Several Compounds as Indicators in Lithium Aluminum Hydride Titration of Functional Groups". Journal of the American Chemical Society 73 (6): 2676. doi:10.1021/ja01150a073.
- ↑ Martin, A. J. (1957). "Potentiometric titration of hydroperoxide and peracid in Anhydrous Ethylenediamine". Analytical Chemistry 29: 79–81. doi:10.1021/ac60121a022.
- ↑ "ASTM E298, Standard Test Methods for Assay of Organic Peroxides". ASTM. 2010.
- ↑ Heinz G. O. Becker Organikum, Wiley-VCH, 2001, ISBN 3-527-29985-8 pp. 741–762
- ↑ Ozonelab Peroxide compatibility
- ↑ Organic Peroxide Producers Safety Division (2012-08-06). "Safety and Handling of Organic Peroxides" (PDF). The Society of the Plastics Industry, Inc. Arquivado dende o orixinal (PDF) o 20 de xuño de 2013. Consultado o 29 de xuño de 2019.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- OSH Preguntas – peróxidos orgánicos
- "The Perils of Peroxides". carolina.com. Burlington, NC: Carolina Biological Supply Company. Arquivado dende o orixinal o 18 de decembro de 2007. Consultado o 29 de xuño de 2019.
- Eliminación de peróxidos Arquivado 09 de outubro de 2011 en Wayback Machine.
- Organic Peroxide Producers Safety Division. Oct. 2011. The Society of the Plastics Industry. 24 Oct. 2011.