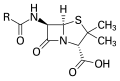
Composto organosulfurado
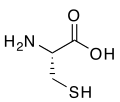
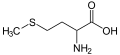
Os compostos organosulfurados ou compostos de organoxofre son compostos orgánicos que conteñen xofre.[1] Cando o composto de organoxofre leva un grupo funcional coa estrutura R-O-SO3− (no que o S está unido a O, pero non a C) denomínase organosulfato. Os compostos organosulfurados a miúdo desprenden fortes cheiros desgradables, pero maioría dos compostos máis doces son derivados organosulfurados, como a sacarina. Na natureza abundan estes compostos e o xofre é un elemento esencial para a vida. Dos 20 aminoácidos comúns hai dous, a cisteína e a metionina, que son compostos organosulfurados, e os antibióticos penicilina e as sulfamidas conteñen tamén xofre. Aínda que os antibióticos que conteñen xofre salvan moitas vidas, outros compostos con xofre non, como o gas mostaza, que é un axente químico bélico mortal. Os combustibles fósiles como o carbón, petróleo e gas natural, que derivan da descomposición de antigos organismos vivos, comteñen compostos sulfurados, e a súa combustión pode xerar óxidos de xofre e estes orixinar chuvia ácida. A desulfuración para eliminalos é un proceso fundamental nas refinerías de petróleo e centrais térmicas.
O xofre forma parte do grupo dos elementos calcóxenos ou anfíxenos, xunto co oxíxeno, selenio e telurio, polo que é de esperar que os compostos organosulfurados teñan propiedades semellantes ás dos compostos de carbono–oxíxeno, carbono–selenio e carbono–telurio.
Unha proba química clásica para a detección de compostos sulfurados é o método do halóxeno de Carius.
Clases de compostos organosulfurados[editar | editar a fonte]
Os compostos organosulfurados poden clasificarse segundo o grupo funcional con xofre que conteñan, que na táboa figuran (aproximadamente) en orde decrecente de frecuencia de aparición. Inclúense tamén sulfatos nos que o S está enlazado con O e non con C.
- Véxase tamén: Organosulfato.
| Clases de organosulfurados | Exemplos | |||
|---|---|---|---|---|
| Fórmula xeral | Grupo de substancias | Número de oxidación | Fórmula estrutural | Nome |
| R–SH | Alcanotiois[2] | −II | Etanotiol[2] | |
| Ar–SH | Tiofenol[2] | −II | 
|
Tiofenol[2] |
| R–S–R' | Sulfuro (ou Tioéter)[3] | −II | Etilmetilsulfuro | |
| R–S–S–R' | Disulfuros[4] | −I | 
|
4,4'-Dinitrodifenildisulfuro |
| R–SO–OH | Ácido sulfínico[5] | +II | 
|
Ácido etanosulfínico |
| R–SOO–OH | Ácido sulfónico[6] | +IV | 
|
Ácido propanosulfónico |
| R–SOO–X | Derivado de ácido sulfónico[7][8] | +IV | 
|
Cloruro de bencenosulfonilo[9] |
| R–SO–R' | Sulfóxido[10] | 0 | 
|
Dimetilsulfóxido[11] |
| R–SOO–R' | Sulfona[11] | +II | 
|
Dietilsulfona |
| R–S–OH | Ácido sulfénico[12] | 0 | Ácido etanosulfénico | |
| R–O–SO3H | Alquilsulfatos[13] | +VI | 
|
Etanilsulfato |
| R–O–SO2–O–R' | Dialquilsulfatos | +VI | 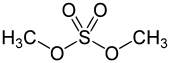
|
Dimetilsulfato[14] |
| R2N–CS–R'2 | Tioureas[15] | 
|
Tiourea[15] | |
- Exemplos ilustrativos de compostos organosulfurados
-
Alicina, o composto oloroso activo do allo esmagado
-
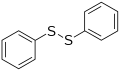
Difenil disulfuro, un disulfuro representativo
-
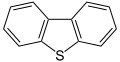
Dibenzotiofeno, un compoñente do petróleo cru
-
Ácido perfluorooctanosulfónico, un surfactante controvertido
-
Estrutura central da penicilina, na que "R" é o grupo variable
-
Sulfanilamida, unha sulfonamida (ou sulfamida) antibacteriana
-
Gas mostaza ou mostaza sulfurada, un axente da guerra química
Tioéteres, tioésteres e tioacetais[editar | editar a fonte]
Estes compostos caracterízanse por ter a secuencia de enlaces C−S−C.[16][17] Comparados cos enlaces C−C, os enlaces C−S son máis longos, porque o átomo de S é máis grande que o de carbono, e o enlace un 10% máis feble. Lonxitudes de enlace representativos en compostos con xofre son 183 pm para o enlace simple S−C no metanetiol e 173 pm no tiofeno. A enerxía de disociación de enlace do C−S para o tiometano é 89 kcal/mol (370 kJ/mol) comparado coa do metano que é 100 kcal/mol (420 kJ/mol) e cando o hidróxeno está substituído por un grupo metilo a enerxía diminúe a 73 kcal/mol (305 kJ/mol).[18] O enlace simple carbono-oxíxeno é máis curto que o enlace C−C. A enerxía de disociación de enlace para o dimetil sulfuro e dimetil éter son respectivamente 73 e 77 kcal/mol (305 e 322 kJ/mol).
Os tioéteres prepáranse normalmente por alquilación de tiois. Poden tamén prepararse polo rearranxo de Pummerer. Na chamada reacción de Ferrario o fenil éter convértese en fenoxatiina por acción do xofre elemental e cloruro de aluminio.[19]
Os tioacetais e tiocetais presentan a secuencia de enlaces C−S−C−S−C. Representan unha subclase de tioéteres. Os tioacetais son útiles no "umpolung" (inversión de polaridade) de grupos carbonilo. Os tioacetais e tiocetais poden tamén usarse para protexer un grupo carbonilo en síntese orgánica.
Os tioésteres teñen a estrutura xeral R−CO−S−R. Están relacionados con ésteres regulares pero son máis reactivos.
As clases anteriores de compostos sulfurados tamén existen en estruturas heterocíclicas saturadas e insaturadas, a miúdo en combinación con outros heteroátomos, como se observa nos tiiranos, tiirenos, tietanos, tietos, ditietanos, tiolanos, tianos, ditianos, tiepanos, tiepinas, tiazoles, isotiazoles e tiofenos, entre outros. Os últimos tres compostos representan unha clase especial de heterociclos que conteñen xofre que son aromáticos. A estabilización de resonancia do tiofeno é 29 kcal/mol (121 kJ/mol) comparada cos 20 kcal/mol (84 kJ/mol) do análogo con oxíxeno, o furano. A razón desta diferenza é a maior electronegatividade do oxíxeno que arrastra electróns cara a el a expensas do anel aromático. Porén, como substituínte aromático o grupo tio é menos efectivo como grupo activador que o grupo alcoxi. O dibenzotiofeno é un heterociclo tricíclico que consta de dous aneis de benceno fusionados a un anel tiofeno central que aparece frecuentemente en fraccións máis pesadas do petróleo, xunto cos seus derivados alquilo substituídos.
Tiois, disulfuros e polisulfuros[editar | editar a fonte]
O grupo tiol contén a funcionalidade R−SH. Os tiois son estruturalmente similares ao grupo alcohol, pero estas funcionalidades son moi diferentes nas súas propiedades químicas. Os tiois son máis nucleofílicos, máis ácidos e oxídanse máis facilmente. Esta acidez pode diferir en 5 unidades de pKa.[20]
A diferenza de electronegatividade entre o xofre (2,58) e o hidróxeno (2,20) é pequena e, por tanto, os enlaces de hidróxeno nos tiois non son moi importantes. Os tiois alifáticos forman monocapas sobre o ouro, que son tópicos en nanotecnoloxía.
Certos tiois aromáticos poden formarse pola reacción de Herz.
Os disulfuros R−S−S−R cun enlace covalente entre os xofres son importantes no establecemento de enlaces cruzados. En bioquímica son importantes para o pregamento e estabilidade dalgunhas proteínas e en química de polímeros para os enlaces cruzados nas gomas.
Coñécense cadeas de xofre máis longas, como no produto natural varacina, que contén un raro anel pentatiepina (cadea de 5 xofres ciclada sobre un anel bencénico).
Sulfóxidos, sulfonas e tiosulfinatos[editar | editar a fonte]
Un sulfóxido, R−S(O)−R, é o óxido de S dun tioéter. Unha sulfona, R−S(O)2−R, é o dióxido S,S dun tioéter. Un tiosulfinato, R−S(O)−S−R, é o óxido de S dun disulfuro. Un tiosulfonato, R−S(O)2−S−R, é o dióxido S,S dun disulfuro. Exemplos destes compostos son a dimetil sulfóxido, a dimetil sulfona e a alicina.
Sulfimidas, sulfoximidas, sulfonadiiminas[editar | editar a fonte]
As sulfimidas (tamén chamadas sulfiliminas) son compostos de xofre e nitróxeno coa estrutura R2S=NR′, que son o análogo con nitróxeno dos sulfóxidos. Son interesantes en parte polas súas propiedades farmacolóxicas. Cando dous diferentes grupos R están unidos ao xofre, as sulfimidas son quirais. As sulfimidaes forman α-carbanións estables.[21]
As sulfoximidas (tamén chamadas sulfoximinas) son compostos de xofre e nitróxeno tetracoordinados, isoelectrónicas con sulfonas, nas cales un átomo de oxíxeno da sulfona é cambiado por un átomo de nitróxeno substituído, por exemplo, R2S(O)=NR′. Cando dous grupos R diferentes están unidos ao xofre, as sulfoximidas son quirais. Esta clase de compostos son interesantes porque se descubriu que a metionina sulfoximida (ou metionina sulfoximina) é un inhibidor do encima glutamina sintetase.[22]
As sulfonadiiminas (tamén chamadas sulfodiiminas, sulfodiimidas ou sulfonadiimidas) son compostos de xofre e nitróxeno tetracoordinados, isoelectrónicos coas sulfonas, nas cales ambos os átomos de oxíxeno da sulfona son cambiados por un átomo de nitróxeno substituído, por exemplo, R2S(=NR′)2. Son importantes pola súa actividade biolóxica e como bloques de construción para a síntese heterocíclica.[23]
S-Nitrosotiois[editar | editar a fonte]
Os S-nitrosotiois, tamén coñecidos como tionitritos, son compostos que conteñen un grupo nitroso unido a un átomo de xofre dun tiol, por exemplo, R−S−N=O. Recibiron moita atención en bioquímica porque serven como doantes do ión nitrosonio, NO+, e óxido nítrico, NO, que poden servir como moléculas sinalizadoras en sistemas vivos, especialmente relacionadas coa vasodilatación.[24]
Haluros de xofre[editar | editar a fonte]
Unha ampla variedade de compostos organosulfurados conteñen un ou máis átomos de halóxenos (representados por "X" nas fórmulas químicas que seguen) enlazado a un só átomo de xofre, por exemplo: sulfenil haluros, RSX; sulfinil haluros, RS(O)X; sulfonil haluros, RSO2X; alquil e arilxofre tricloruros, RSCl3 e trifluoruros, RSF3;[25] e alquil e arilxofre pentafluoruros, RSF5.[26] Menos coñecidos son os dialquilxofre tetrahaluros, representados principalmente por tetrafluoruros, por exemplo, R2SF4.[27]
Tiocetonas, tioaldehidos e compostos relacionados[editar | editar a fonte]
Compostos con dobres enlaces entre o carbono e xofre son relativamente pouco comúns, pero inclúen os importantes compostos carbono disulfuro, carbonil sulfuro e tiofosxeno. As tiocetonas (RC(=S)R′) son pouco comúns con substituíntes alquilo, pero un exemplo é a tiobenzofenona. Os tioaldehidos son aínda máis raros, reflectindo a súa falta de protección estérica (o "tioformaldehido" aparece como un trímero cíclico). As tioamidas, coa fórmula R1C(=S)N(R2)R3 son máis comúns. Prepáranse normalmente pola reacción de amidas co reactico de Lawesson. Os isotiocianatos, con fórmula R−N=C=S, encóntranse na natureza. Alimentos vexetais con aromas característicos debidos aos isotiocianatos son o wasabi, ravo picante, mostaza, ravo, coles de Bruxelas, agrón, Tropaeolum e alcaparras.
S-óxidos e S,S-dióxidos de compostos tiocarbonilos[editar | editar a fonte]
Os S-óxidos de compostos tiocarbonilos coñécense como tiocarbonilo S-óxidos ou sulfinas, R2C=S=O, e tiocarbonil S,S-dióxidos ou sulfenos, R2C=SO2. Exemplos destes compostos son o sin-propanetial-S-óxido e o sulfeno.
Enlaces triplos entre o carbono e o xofre[editar | editar a fonte]
Os enlaces triplos entre o xofre e o carbono nos sulfaalquinos son pouco frecuentes e poden encontrarse no monosulfuro de carbono (CS) [28] e suxeriuse que están presentes nos compostos F3CCSF3 [29][30] e F5SCSF3.[31] O composto HCSOH tamén se representa cun triplo enlace formal deste tipo.[32]
Ácidos tiocarboxílicos e tioamidas[editar | editar a fonte]
Os ácidos tiocarboxílicos (RC(O)SH) e ditiocarboxílicos (RC(S)SH) son estruturalmente similares aos ácidos carboxílicos pero con máis carácter ácido. As tioamidas son análogas ás amidas.
Ácidos sulfónicos, sulfínicos e sulfénicos, ésteres, amidas e compostos relacionados[editar | editar a fonte]
Os ácidos sulfónicos teñen a funcionalidade R−S(=O)2−OH.[33] Son ácidos fortes tipicamente solubles en solventes orgánicos. Os ácidos sulfónicos como o ácido trifluorometanosulfónico é un reactivo frecuentemente usado en química orgánica. Os ácidos sulfínicos teñen a funcionalidade R−S(O)−H e os ácidos sulfénicos teñen a R−S−OH. Na serie ácido sulfónico—sulfínico—sulfénico, tanto a forza de ácido coma a estabilidade diminúen en dita orde.[34][35] As sulfonamidas, sulfinamidas e sulfenamidas, con fórmulas R−SO2NR′2, R−S(O)NR′2 e R−SNR′2, respectivamente, teñen todas unha rica química. Por exemplo, as sulfamidas son sulfonamidas derivadas por sulfonación aromática. As sulfinamidas quirais utilízanse en síntese asimétrica, mentres que as sulfenamidas utilízanse amplamente no proceso de vulcanización para axudar á formación de enlaces cruzados. Os tiocianatos, R−S−CN, están relacionados con sulfenil haluros e ésteres en canto á reactividade.
Sulfonio, oxosulfonio e sales relacionados[editar | editar a fonte]
Un ión sulfonio é un ión con carga positiva con tres substituíntes orgánicos unidos ao xofre, coa fórmula [R3S]+. Xunto co anión correspondente, os compostos denomínanse sales de sulfonio. Un ión oxosulfonio é un ión positivo que presenta tres substituíntes orgánicos e un oxíxeno unidos ao xofre, coa fórmula [R3S=O]+. Xunto co anión correspondente, os compostos denomínanse sales de oxosulfonio. Entre as especies relacionadas están os ións alcoxisulfonio e clorosulfonio, [R2SOR]+ e [R2SCl]+, respectivamente.
Iluros de sulfonio, oxosulfonio e tiocarbonilo[editar | editar a fonte]
A desprotonación de sales de sulfonio e oxosulfonio orixina iluros, coa estrutura R2S+−C−−R′2 e R2S(O)+−C−−R′2. Mentres que os iluros de sulfonio, por exemplo en reaccións como a reacción de Johnson–Corey–Chaykovsky usado para sintetizar oxiranos, son ás veces debuxados con dobre enlace C=S, por exemplo, R2S=CR′2, o enlace carbono–xofre ilúrico está moi polarizado e descríbese mellor como iónico. Os iluros de sulfonio son intermediarios clave no sinteticamente útil rearranxo de Stevens. Os iluros de tiocarbonilo (RR′C=S+−C−−RR′) poden formarse pola abertura do anel de tiiranos, fotociclación de sulfuros de arilo vinilo,[36] e por outros procesos.
Sulfuranos e persulfuranos[editar | editar a fonte]
Os sulfuranos teñen grupos funcionais relativamente especializados que son compostos de xofre tetravalentes e hipervalentee, coa fórmula SR4[37] e igualmente os persulfuranos son SR6 hexavalentes. Os complexos hexavalentes de todo carbono son os representantes máis pesados do grupo dos calcóxenos, por exemplo o composto hexametilpertelurano (Te(Me)6), que se descubriu en 1990[38] por reacción do tetrametiltelurio con difluoruro de xenon dando TeF2(CH3)4 seguido de reacción co dimetilzinc. O análogo de xofre hexametilpersulfurano (S(CH3)6) predíxose que é estable[39] pero aínda non foi sintetizado.
O primeiro persulfurano de todo carbono realmente sintetizado no laboratorio tiña dous metilos e dous ligandos bifenilos:[40]
Prepárase a partir do correspondente sulfurano (1) con difluoruro de xenon / trifluoruro de boro en acetonitrilo dando o dicatión sulfuranilo (2) seguido dunha reacción co metillitio en tetrahidrofurano dando un persulfurano (estable) (3) en forma de isómero cis. A difracción de raios X mostra lonxitudes de enlaces C−S que están entre 189 e 193 pm (máis longos que a lonxitude de enlace estándar) co átomo de xofre central nunha xeometría molecular octaédrica distorsionada.
As simulacións por computador suxiren que estes enlaces son moi polares e as cargas negativas residen no carbono.
Compostos organosulfurados que aparecen na natureza[editar | editar a fonte]
Non todos os compostos organosulfurados son contaminantes que cheiran moi mal. A penicilina e a cefalosporina son antibióticos que salvan vidas, obtidos de fungos. A gliotoxina é unha micotoxina que contén xofre producida por varias especies de fungos, que están investigándose como axentes antivirais. Compostos como a alicina e ajoeno son responsables do olor do allo e a lentionina contribúe ao aroma dos cogomelos shiitake. Os compostos organosulfurados volátiles tamén contribúen ao aroma característico do viño, noces, queixo cheddar, chocolate, café e froitos tropicais.[41] Moitos destes produtos naturais tamén teñen importantes propiedades medicinais como previr a agregación das plaquetas ou na loita contra o cancro.
Compostos organosulfurados e contaminación[editar | editar a fonte]
A maioría dos compostos orgánicos sulfurados que se encontran no medio ambiente son de orixe natural, xa que o xofre é un elmento esencial para a vida e dous aminoácidos (cisteína e metionina) conteñen ese elemento.
Algúns compostos organosulfurados do medio ambiente xéranse como subprodutos menores de procesos industriais como a fabricación de plásticos e pneumáticos.
Procesos que producen cheiros son os que emiten compostos organosulfurados producidos por coqueo de carbón deseñados para eliminar compostos sulfurosos e outras impurezas volátiles para producir "carbono limpo" (coque), que se usa principalmente para a produción de aceiro.
Compostos organosulfurados en combustibles fósiles[editar | editar a fonte]
A emisión de cheiros prodúcese tamén durante o procesamenteo químico do carbón ou o petróleo cru para orixinar precursores químicos para usos industriais posteriores (por exemplo, plásticos ou produción farmacéutica) e na destilación do petróleo para obter gasolinas, combustible diésel e outros combustibles derivados.
Os compostos de organoxofre poden considerarse contaminantes aromáticos que deben ser eliminados do gas natural antes de darlle un uso comercial, por medio de escapes exhaust stacks and exhaust vents antes da descarga. Neste último contexto, os compostos organosulfurados poden dar orixe a contaminantes que producen chuvia ácida sulfurosa, ou de forma equivalente a contaminantes presentes nos combustibles fósiles, especialmente o carbón.
O composto organosulfurado común maioritario presente en todas as fraccións do petróleo é o tiofeno (C4H4S), un líquido aromático e cíclico. Ademais, as fraccións pesadas do petróleo conteñen benzotiofeno (C8H6S, tianafteno) e dibenzotiofeno. A maioría destes últimos compostos son sólidos e cheiran como o naftaleno. Moitos derivados metilados, dimetilados e dietilados do benzotiofeno están presentes no diésel e fueloil, o que fai que o fueloil sexa difícil de limpar.
Todos estes tioéteres heterocíclicos supoñen de 200 a 500 ppm do petróleo natural, os dibenzotiofenos derivados moi substituídos permanecen despois da hidrodesulfuración (HDS) e supoñen de 10 a 20 ppm. Estas moléculas tamén se encontran en carbóns e deben ser eliminados antes do seu uso.
O molibdeno reducido e o níquel úsanse actualmente para eliminar tiofenos do petróleo debido á súa grande afinidade polo xofre. Ademais, o volframio e o níquel e cobalto úsanse para a hidrodesulfuración (HDS) nas grandes refinerías. O mecanismo de adsorción do tiofeno a metais de transición propúxose que ocorre por medio do sistema π, no que o composto organosulfurado se deposita case paralelo á superficie do metal. Moitos investigadores centran os seus esforzos en optimizar o estado de oxidación dos metais de transición para a HDS, como o Cu(I) e a Ag(II), que xunto co Pd(0) son máis específicos para os enlaces π con tiofenos de todas clases.
Causa do cheiro dos compostos organosulfurados[editar | editar a fonte]
Os humanos e outros animais teñen un sentido do olfacto moi sensible aos cheiros dos composots organosulfurados de baixa valencia como tiois, tioéteres e disulfuros. Os tiois volátiles fedorentos son produtos da degradación das proteínas que se encontran na comida podre, polo que a identificación sensitiva destes compostos é esencial para evitar intoxicacións. Os compostos de xofre de baixa valencia volátiles tamén se encontran en áreas nas que os niveis de oxíxeno no aire son baixos, o que supón un risco de asfixia. Descubriuse que nos ratos o cobre é necesario para a detección moi sensible polos receptores olfactorios de certos tiois volátiles e compostos organosulfurados relacionados. Non se sabe se os humanos requiren tamén cobre para a detección sensitiva de tiois.[42]
Notas[editar | editar a fonte]
- ↑ Block, E. (1978). Reactions of Organosulfur Compounds. Academic Press. ISBN 0-12-107050-6.
- ↑ 2,0 2,1 2,2 2,3 Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 473−476, ISBN 3-342-00280-8.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 477−479, ISBN 3-342-00280-8.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 144, ISBN 3-7776-0406-2.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 480−481, ISBN 3-342-00280-8.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 480−487, ISBN 3-342-00280-8.
- ↑ Ácidos sulfónicos y sus derivados. En: Tratado de química orgánica. F. Klages. Editorial Reverté. ISBN 8429173153. Pág. 763
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 484−485, ISBN 3-342-00280-8.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 485, ISBN 3-342-00280-8.
- ↑ Siegfried Hauptmann3: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 479−480, ISBN 3-342-00280-8.
- ↑ 11,0 11,1 Hauptmann, p.3
- ↑ Siegfried Hauptmann9: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 485, ISBN 3-342-00280-8.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 235−236, ISBN 3-7776-0406-2.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 137, ISBN 3-7776-0406-2.
- ↑ 15,0 15,1 Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 471−472, ISBN 3-342-00280-8.
- ↑ Organic chemistry IUPAC Blue Book. Rules C-5: Compounds Containing Bivalent Sulfur http://www.acdlabs.com/iupac/nomenclature/79/r79_25.htm
- ↑ "Thiocarboxylic and thiocarbonic acids". www.acdlabs.com. Consultado o 2020-05-04.
- ↑ Handbook of Chemistry and Physics (81st ed.). CRC Press. ISBN 0-8493-0481-4.
- ↑ Suter, C. M.; Maxwell, Charles E. "Phenoxthin [Phenoxathiin]". Org. Synth. 18. doi:10.15227/orgsyn.018.0064. CV2P0485.
- ↑ Cremlyn, R. J. (1996). An Introduction to Organosulfur Chemistry. Chichester: John Wiley and Sons. ISBN 0-471-95512-4.
- ↑ García Ruano, J. L.; Cid, M. B.; Martín Castro, A. M.; Alemán, J. (2008). "Acyclic S,S-Dialkylsulfimides". En Kambe, N. Science of Synthesis 39. Thieme. pp. 352–375. ISBN 978-1-58890-530-7.
- ↑ Drabowicz, J.; Lewkowski, J.; Kudelska, W.; Girek, T. (2008). "S,S-Dialkylsulfoximides". En Kambe, N. Science of Synthesis 39. Thieme. pp. 154–173. ISBN 978-1-58890-530-7.
- ↑ Drabowicz, J.; Lewkowski, J.; Kudelska, W.; Girek, T. (2008). "S,S-Dialkylsulfonediimines". En Kambe, N. Science of Synthesis 39. Thieme. pp. 173–180. ISBN 978-1-58890-530-7.
- ↑ Zhang, Y.; Hogg, N. (2005). "S-Nitrosothiols: cellular formation and transport". Free Radical Biol. Med. 38 (7): 831–838. PMID 15749378. doi:10.1016/j.freeradbiomed.2004.12.016.
- ↑ Braverman, S.; Cherkinsky, M.; Levinger, S. (2008). "Alkylsulfur Trihalides". En Kambe, N. Science of Synthesis 39. Thieme. pp. 187–188. ISBN 978-1-58890-530-7.
- ↑ Sheppard, W. A. (1962). "Arylsulfur Pentafluorides". J. Am. Chem. Soc. 84: 3064–3072. doi:10.1021/ja00875a006.
- ↑ Drabowicz, J.; Lewkowski, J.; Kudelska, W.; Girek, T. (2008). "Dialkylsulfur Tetrahalides". En Kambe, N. Science of Synthesis 39. Thieme. pp. 123–124. ISBN 978-1-58890-530-7.
- ↑ Moltzen, E. K.; Klabunde, K. J.; Senning, A. (1988). "Carbon monosulfide: a review". Chem. Rev. 88 (2): 391. doi:10.1021/cr00084a003.
- ↑ Pötter, B.; Seppelt, K. (1984). "Trifluoroethylidynesulfur Trifluoride, F3C−C≡SF3". Angew. Chem. Int. Ed. Engl. 23 (2): 150. doi:10.1002/anie.198401501.
- ↑ Buschmann, J.; Damerius, R.; Gerhardt, R.; Lentz, D.; Luger, P.; Marschall, R.; Preugschat, D.; Seppelt, K.; Simon, A. (1992). "(Trifluoroethylidyne)sulfur trifluoride, F3CC≡SF3: two solid-state structures and reactivity as a carbene". J. Am. Chem. Soc. 114 (24): 9465. doi:10.1021/ja00050a027.
- ↑ Gerhardt, R.; Gerlbig, T.; Buschamann, J.; Luger, P.; Seppelt, K. (1988). "The SF5-Unit as Steric Protecting Group; Synthesis and Structure of F5S−C≡SF3". Angew. Chem. Int. Ed. Engl. 27 (11): 1534. doi:10.1002/anie.198815341.
- ↑ Schreiner, P.; Reisenauer, H.; Romanski, J.; Mloston, G. (2009). "A formal carbon–sulfur triple bond: H−C≡S−O−H.". Angew. Chem. Int. Ed. Engl. 48 (43): 8133–8136. PMID 19768827. doi:10.1002/anie.200903969.
- ↑ Organic chemistry IUPAC Blue Book. C-6 Sulfur Halides, Sulfoxides, Sulfones, and Sulfur Acids and Their Derivatives http://www.acdlabs.com/iupac/nomenclature/79/r79_26.htm
- ↑ Braverman, S.; Cherkinsky, M.; Levinger, S. (2008). "Alkanesulfinic Acids and Salts". En Kambe, N. Science of Synthesis 39. Thieme. pp. 196–211. ISBN 978-1-58890-530-7.
- ↑ Drabowicz, J.; Kiełbasiński, P.; Łyżwa, P.; Zając, A.; Mikołajczyk, M. (2008). "Alkanesulfenic Acids". En Kambe, N. Science of Synthesis 39. Thieme. pp. 550–557. ISBN 978-1-58890-530-7.
- ↑ Schultz, A. G.; DeTar, M. B. (1976). "Thiocarbonyl ylides. Photogeneration, rearrangement, and cycloaddition reactions". J. Am. Chem. Soc. 98: 3564–3572. doi:10.1021/ja00428a029.
- ↑ Martin, J. C.; Arhart, R. J.; Franz, J. A.; Perozzi, E. F.; Kaplan, L. J. "Bis[2,2,2-trifluoro-1-phenyl-1-(trifluoromethyl)ethoxy]diphenyl sulfurane". Org. Synth. 57. doi:10.15227/orgsyn.057.0022. cv6p0163.
- ↑ Ahmed, Latif; Morrison, John A. (1990). "Synthesis and characterization of hexamethyltellurium(VI)". J. Am. Chem. Soc. 112 (20): 7411–7413. doi:10.1021/ja00176a061.
- ↑ Fowler, J. E.; Schaefer, H. F., III; Raymond, K. N. (1996). "The S6 Point Group Conformers of the Hexamethylchalcogens: Me6S, Me6Se, Me6Te". Inorg. Chem. 35 (2): 279–281. doi:10.1021/ic940240d.
- ↑ Sato, S.; Matsunaga, K.; Horn, E.; Furukawa, N.; Nabeshima, T. (2006). "Isolation and Molecular Structure of the Organo-persulfuranes [12-S-6(C6)]". J. Am. Chem. Soc. 128 (21): 6778–6779. doi:10.1021/ja060497y.
- ↑ Qian, M. C.; Fan, X.; Mahattanatawee, K., eds. (2011). Volatile Sulfur Compounds in Food. ACS Symposium Series 1068. American Chemical Society. ISBN 978-0-8412-2616-6. doi:10.1021/bk-2011-1068.
- ↑ Duan, X.; Block, E.; Li, Z.; Connelly, T.; Zhang, J.; Huang, Z.; Su, X.; Pan, Y.; Wu, L.; Chi, Q.; Thomas, S.; Zhang, S.; Ma, M.; Matsunami, H.; Chen, G.-Q.; Zhang, H. (2012). "Crucial role of copper in detection of metal-coordinating odorants.". Proc. Natl. Acad. Sci. USA 109: 3492–3497. Bibcode:2012PNAS..109.3492D. PMC 3295281. PMID 22328155. doi:10.1073/pnas.1111297109.