Carbanión

Un carbanión é un anión no cal o carbono ten un par de electróns non compartidos e ten carga negativa, xeralmente con tres substituíntes dun total de oito electróns de valencia.[1] O carbanión ten unha xeometría piramidal trigonal. Formalmente, un carbanión é a base conxugada dun ácido de carbono (carbon acid).
- R3C-H + B− → R3C− + H-B
onde B é a base. Un carbanión é un intermediario reactivo en química orgánica.
Estabilidade e reactividade[editar | editar a fonte]
Un carbanión é un nucleófilo. A estabilidade e reactividade dun carbanión está determinada por varios factores, entre os que están os seguintes:
- O efecto indutivo. Os átomos electronegativos adxacentes á carga estabilizan a carga.
- Hibridación do átomo que leva a carga. Canto maior é o carácter s do átomo que leva a carga, máis estable é o anión.
- A extensión da conxugación do anión. Os efectos de resonancia poden estabilizar o anión. Isto é especialmente certo cando o anión está estabilizado como resutado de aromaticidade.
Un carbanión é un intermediario reactivo e intervén en reaccións de química orgánica, por exemplo na reacción de eliminación E1cB, e en química organometálica, por exemplo na reacción de Grignard, ou na química de alquil litio. Existen tamén os carbanións estables. En 1984 Olmstead presentou o sal de litio éter coroa do trifenilmetil carbanión a partir do trifenilmetano, n-butilitio e 12-coroa-4 a baixas temperaturas:[2]

Engadindo n-butilitio ao trifenilmetano en THF a baixas temperaturas seguido do 12-coroa-4 prodúcese como resultado unha solución vermella e o complexo do sal precipita a −20 °C. As lonxitudes de enlace do C-C central son 145 pm co anel fenilo nun ángulo de como media 31,2°. Esta forma é menos pronunciada cun contraión tetrametilamonio.[3]
Unha ferramenta para a detección de carbanións en solución é a resonancia magnética nuclear de protóns.[4] Un espectro do ciclopentadieno en DMSO mostra catro protóns vinílicos a 6,5 ppm e dous protóns pontes de metileno a 3 ppm, mentres que o anión ciclopentadienil ten unha soa resonancia a 5.50 ppm.
Ácidos de carbono[editar | editar a fonte]
Calquera molécula que conteña un C-H pode perder un protón formando un carbanión. Por tanto, calquera hidrocarburo que conteña enlaces C-H pode considerarse un ácido cun valor correspondente de pKa. O metano non é desde logo un ácido no seu significado clásico, aínda que o seu pKa estimado é 56. Pode compararse este valor co do ácido acético, cuxo pKa é 4,76. Os mesmos factores que determinan a estabilidade do carbanión tamén determinan a orde nos pKa de ácidos de carbono. Estes valores determínanse para os compostos ou ben en auga para comparalos cos ácidos ordinarios, ou ben en dimetil sulfóxido (DMSO), no cal a maioría dos ácidos de carbono e os seus anións son solubles ou están na fase de gas. Con DMSO a fiestra de acidez para os solutos está limitada ao seu propio pKa de 35,5.
| nome | fórmula | fórmula estrutural | pKa |
|---|---|---|---|
| Metano | CH4 | 
|
~ 56 |
| Etano | C2H6 | 
|
~ 50 |
| Anisol | C7H8O | 
|
~ 49 |
| Ciclopentano | C5H10 | ~ 45 | |
| Propeno | C3H6 | ~ 44 | |
| Benceno | C6H6 | ~ 43 | |
| Tolueno | C6H5CH3 | ~ 43 | |
| Dimetil sulfóxido | (CH3)2SO | 
|
35,5 |
| Difenilmetano | C13H12 | 
|
32,3 |
| Anilina | C6H5NH2 | 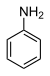
|
30,6 |
| Trifenilmetano | C19H16 | 
|
30,6 |
| Xanteno | C13H10O | 
|
30 |
| Etanol | C2H5OH | 29,8 | |
| Fenilacetileno | C8H6 | 
|
28,8 |
| Tioxanteno | C13H10S | 28,6 | |
| Acetona | C3H6O | 
|
26,5 |
| Acetileno | C2H2 | 
|
25 |
| Benzoxazol | C7H5NO | 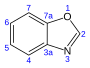
|
24,4 |
| Fluoreno | C13H10 | 22,6 | |
| Indeno | C9H8 | 20,1 | |
| Ciclopentadieno | C5H6 | 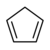
|
18 |
| Malononitrilo | C3H2N2 | 
|
11,2 |
| Cianuro de hidróxeno | HCN | 9,2 | |
| Acetilacetona | C5H8O2 | 8,95 | |
| Dimedona | C8H12O2 | 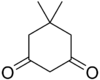
|
5,23 |
| Ácido de Meldrum | C6H8O4 | 
|
4,97 |
| Ácido acético | CH3COOH | 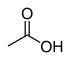
|
4,76 |
| Ácido barbitúrico | C4H2O3(NH)2 | 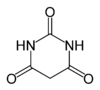
|
4,01 |
| Trinitrometano | HC(NO2)3 | 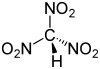
|
0,17 |
| Ácido fulmínico | HCNO | -1,07 | |
| Ácido carborano | HCHB11Cl11 | 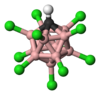
|
-9 |
| Táboa 1. Acidez de ácidos de carbono en pKa en DMSO [5]. Ácidos de referencia en negra. | |||
Nótese que os anións formados por ionización do ácido acético, etanol, e anilina non son carbanións.
Empezando polo metano na táboa 1, a acidez vaise incrementando nas seguintes condicións:
- cando o anión é aromático, porque o electrón engadido causa que o anión sexa aromático (como ocorre no indeno e no ciclopentadieno), ou porque a carga negativa sobre o carbono pode ser deslocalizada en varios aneis xa aromáticos (como no trifenilmetano ou ácido carborano).
- cando o carbanión está rodeado por grupos fortemente electronegativos, por medio da neutralización parcial da carga negativa (como no malononitrilo).
- cando o carbanión está inmediatamente adxacente a un grupo carbonilo. Os protóns α dos grupos carbonilo son ácidos porque a carga negativa do enolato pode ser parcialmente distribuída no átomo de oxíxeno. O ácido de Meldrum e o ácido barbitúrico, denominados historicamente ácidos, son en realidade unha lactona e unha lactama respectivamente, pero os seus protóns de cabono ácido fanos ácidos. A acidez dos compostos carbonilo é unha importante forza impulsora de moitas reaccións orgánicas como a reacción do aldol.
Carbanións quirais[editar | editar a fonte]
Como a xeometría molecular dun carbanión se describe como de pirámide trigonal, a cuestión é se os carbanións poden presentar ou non quiralidade, porque se a barreira de activación para a inversión desta xeometría é demasiado baixa calquera inento de introducir quiralidade acabará orixinando unha racemización, similar á inversión do nitróxeno. Porén, existen evidencias sólidas de que os carbanións poden realmente ser quirais por exemplo en investigacións levadas a cabo con certos compostos de organolitio.
A primeira evidencia da existencia de compostos de organolitio quirais obtívose en 1950. A reacción do 2-iodooctano quiral con sec-butilitio en éter de petróleo a −70 °C seguida da reacción con xeo seco rendía ácido 2-metilbutírico principalmente racémico, pero tamén unha cantidade de ácido 2-metiloctanoico opticamente activo, que só se puido ter formado a partir dun 2-metilheptilitio tamén opticamente activo, e o átomo de carbono unía o carbanión ao litio:[6]

Ao quentar a reacción a 0 °C a actividade óptica desaparecía. Obtivéronse máis evidencias na década de 1960. Unha reacción do isómero cis do 2-metilciclopropil bromuro co sec-butilitio seguida de carboxilación con xeo seco rendeu ácido cis-2-metilciclopropilcarboxílico. A formación do isómero trans tería indicado que o intermediario carbanión era inestable.[7]

Da mesma maneira a reacción do (+)-(S)-l-bromo-l-metil-2,2-difenilciclopropano con n-butilitio seguida de quench con metanol tivo como resultado un produto con retención da configuración:[8]

Máis recentemente obtivéronse compostos de metillitio quirais:[9]
![Oxi-[2H1]metillitios quirais; Bu significa butil, i-Pr significa isopropil.](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1d/PhosphatePhosphonateRearrangement.png/500px-PhosphatePhosphonateRearrangement.png)
Na imaxe os fosfatos (1) conteñen un grupo quiral cun hidróxeno e un substituínte deuterio. O grupo estannil substitúese por litio no intermediario (2), que sofre un rearranxo fosfato-fosforano a fosforano (3), o cal nunha reacción co ácido acético dá alcohol (4). Unha vez máis, no intervalo de −78 °C a 0 °C nesta secuencia de reaccións presérvase a quiralidade.[10]
Historia[editar | editar a fonte]
Unha estrutura de carbanión propuxérona correctamente Clarke e Lapworth en 1907 por primeira vez para explicar o mecanismo de reacción da condensación de benzoína.[11] En 1904 Schlenk preparou Ph3C−NMe4+ en busca de nitróxeno pentavalente (a partir de cloruro de tetrametilamonio e Ph3CNa) [12] e en 1914 demostrou como se podían reducir os radicais triarilmetilo a carbanións por metais alcalinos.[13] O termo "carbanión" foi introducido por Wallis e Adams en 1933 como termo homólogo cargado negativamente do ión carbonio.[14][15]
Notas[editar | editar a fonte]
- ↑ Organic Chemistry - Robert Thornton Morrison, Robert Neilson Boyd
- ↑ The isolation and x-ray structures of lithium crown ether salts of the free phenyl carbanions [CHPh2]- and [CPh3]- Marilyn M. Olmstead, Philip P. Power; J. Am. Chem. Soc.; 1985; 107(7); 2174-2175. doi 10.1021/ja00293a059
- ↑ "Schlenk's Early “Free” Carbanions". Chemistry - A European Journal (en inglés) 8 (14): 3229–3232. 15 de xullo de 2002. doi:10.1002/1521-3765(20020715)8:14<3229::AID-CHEM3229>3.0.CO;2-3.
- ↑ A Simple and Convenient Method for Generation and NMR Observation of Stable Carbanions. Hamid S. Kasmai Journal of Chemical Education • Vol. 76 No. 6 June 1999
- ↑ Equilibrium acidities in dimethyl sulfoxide solution Frederick G. Bordwell Acc. Chem. Res.; 1988; 21(12) pp 456 - 463; doi 10.1021/ar00156a004
- ↑ FORMATION OF OPTICALLY ACTIVE 1-METHYLHEPTYLLITHIUM Robert L. Letsinger J. Am. Chem. Soc.; 1950; 72(10) pp 4842 - 4842; doi 10.1021/ja01166a538
- ↑ The Configurational Stability of cis- and trans-2-Methylcyclopropyllithium and Some Observations on the Stereochemistry of their Reactions with Bromine and Carbon Dioxide Douglas E. Applequist and Alan H. Peterson J. Am. Chem. Soc.; 1961; 83(4) pp 862 - 865; doi 10.1021/ja01465a030
- ↑ Cyclopropanes. XV. The Optical Stability of 1-Methyl-2,2-diphenylcyclopropyllithium H. M. Walborsky, F. J. Impastato, and A. E. Young J. Am. Chem. Soc.; 1964; 86(16) pp 3283 - 3288; doi 10.1021/ja01070a017
- ↑ Preparation of Chiral -Oxy-[2H1]methyllithiums of 99% ee and Determination of Their Configurational Stability Dagmar Kapeller, Roland Barth, Kurt Mereiter, and Friedrich Hammerschmidt J. Am. Chem. Soc.; 2007; 129(4) pp 914 - 923; (Article) doi 10.1021/ja066183s
- ↑ Enantioselectividade determinada por espectroscopía RMN despois da derivación con ácido de Mosher.
- ↑ Clarke, R. W. L.; Lapworth, A. (1907). "LXV.?An extension of the benzoin synthesis". Journal of the Chemical Society, Transactions 91: 694. doi:10.1039/CT9079100694.
- ↑ Schlenk, W.; Weickel, T.; Herzenstein, A. (1910). "Ueber Triphenylmethyl und Analoga des Triphenylmethyls in der Biphenylreihe. [Zweite Mittheilung über „Triarylmethyle”.]". Justus Liebig's Annalen der Chemie 372: 1. doi:10.1002/jlac.19103720102.
- ↑ Schlenk, W.; Marcus, E. (1914). "Über Metalladditinen an freie organische Radikale. (Über Triarylmethyle. XII.)". Berichte der deutschen chemischen Gesellschaft 47 (2): 1664. doi:10.1002/cber.19140470256.
- ↑ Wallis, E. S.; Adams, F. H. (1933). "The Spatial Configuration of the Valences in Tricovalent Carbon Compounds1". Journal of the American Chemical Society 55 (9): 3838. doi:10.1021/ja01336a068.
- ↑ Tidwell, T. T. (1997). "The first century of physical organic chemistry: A prologue". Pure and Applied Chemistry 69 (2): 211–214. doi:10.1351/pac199769020211.
