Colina acetiltransferase
| Colina acetiltransferase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
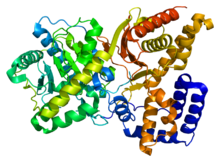
| |||||||||
| Identificadores | |||||||||
| Número EC | 2.3.1.6 | ||||||||
| Número CAS | 9012-78-6 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
| CHAT | |||
|---|---|---|---|
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB | ||
| Identificadores | |||
| Nomenclatura | Outros nomes
| ||
| Símbolos | CHAT (HGNC: 1912) CHOACTASE, CMS1A, CMS1A2, CMS6 | ||
| Identificadores externos | |||
| Locus | Cr. 10 q11.23 | ||
| Padrón de expresión de ARNm | |||
 | |||
| Máis información | |||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
A colina acetiltransferase (normalmente abreviada como ChAT e ás veces como CAT) é un encima transferase responsable da síntese do neurotransmisor acetilcolina. A ChAT cataliza a transferencia dun grupo acetilo desde o coencima acetil-CoA á colina, orixinando acetilcolina (ACh). A ChAT atópase en alta concentración nas neuronas colinérxicas, do sistema nervioso central (SNC) e do sistema nervioso periférico (SNP). Igual que ocorre coa maioría das proteínas dos terminais nerviosos, a ChAT prodúcese no corpo celular da neurona e desde alí transpórtase ao terminal axónico, onde a súa concentración é a máxima. A presenza de ChAT nunha célula nerviosa clasifica esta célula como neurona "colinérxica". En humanos o encima colina acetiltransferase está codificado no xene CHAT do cromosoma 10.[1]
Historia[editar | editar a fonte]
A colina acetiltransferase describírona por primeira vez David Nachmansohn e A. L. Machado en 1943.[2] O bioquímico alemán Nachmansohn estivera estudando o proceso da transmisión do impulso nervioso e a utilización de reaccións químicas que renden enerxía nas células, ampliando os traballos de gañadores do premio Nobel como Otto Warburg e Otto Meyerhof sobre a fermentación, glicólise e contracción muscular. Baseándose en investigcións previas que mostraban que as "accións da acetilcolina sobre proteínas estruturais" eran responsables dos impulsos nerviosos, Nachmansohn e Machado investigaron a orixe da acetilcolina.[3]
Extraeuse un encima do cerebro e tecido nervioso que forma acetilcolina. A formación ocorre só en presenza de adenosintrifosfato (ATP). O encima chámase colina acetilase. Nachmanson e Machado, 1943[2]
O modo de acción da "acetil transferase" era descoñecido na época do seu descubrimento; con todo, Nachmansohn hipotetizou a posibilidade de que o acetilfosfato ou a fosforilcolina intercambiasen o fosfato (procedente do ATP) coa colina ou un ión acetato.[2] Ata 1945 non se descubriu o coencima A (CoA) de forma simultánea e independente por tres laboratorios,[4][5][6] e o de Nachmansohn foi un deles. Seguidamente, en 1951, descubriuse o acetil-CoA, que daquela se chamaba “acetato activo”.[7] A estrutura 3D da ChAT, derivada da rata, non se resolveu ata 60 anos despois, en 2004.[8]
Estrutura[editar | editar a fonte]
Resolveuse a estrutura 3D da ChAT por cristalografía de raios X (PDB 2FY2). A colina únese no sitio activo da ChAT por medio de interaccións non covalentes entre a amina cargada positivamente da colina e o grupo hidroxilo da tirosina 552, ademais dun enlace de hidróxeno adicional entre o grupo hidroxilo da colina e un residuo de histidina, His324.
O substrato colina acomódase nun peto no interior da ChAT, mentres que o acetil-CoA encaixa nun peto situado na superficie da proteína. A estrutura cristalina tridimensional mostra que o grupo acetilo do acetil-CoA está lindante co peto de unión da colina, minimizando a distancia entre o doante do grupo acetilo e o receptor.
Homoloxía[editar | editar a fonte]
A ChAT está moi conservada nos xenomas animais. Entre as ChAT dos animais hai unha gran similitude de secuencia. As ChAT de humanos e gatos (Felis catus), por exemplo, teñen unha identidade de secuencia do 89 %. A identidade de secuencia con Drosophila é dun 30 %.[9]
Formas da ChAT[editar | editar a fonte]
Hai dúas formas da ChAT: soluble e unida a membranas.[10] A forma soluble supón o 80-90 % da actividade encimática total observada, mentres que a forma unida a membranas é responsable do resto.[11] Porén, houbo moito debate sobre como esta última forma da ChAT se une ás membranas.[12] A forma unida a membranas da ChAT está asociada con vesículas sinápticas.[13]
Isoformas común e periférica da ChAT[editar | editar a fonte]
Existen dúas isoformas da ChAT, ambas as dúas codificadas pola mesma secuencia. O tipo común da ChAT (cChAT) está presente tanto no sistema nervioso central coma no periférico. O tipo periférico da ChAT (pChAT) exprésase preferentemente no SNP en humanos, e orixínase polo salto de exón (exon skipping) que afecta aos exóns 6–9, durante a modificación postranscricional. Por tanto, a súa secuencia de aminoácidos é moi similar; porén, a pChAT perdeu partes da secuencia que están presentes na cChAT. A isoforma pChAT descubriuse en 2000 baseándose na observación de que os anticorpos contra a ChAT do cerebro non podían marcar as neuronas colinérxicas periféricas como si o facían coas neuronas que se encontraban no propio cerebro. Este mecanismo de empalme de xenes que orixina as diferenzas entre a cChAT e a pChAT observouse en varias especies, incluíndo tanto vertebrados mamíferos coma invertebrados moluscos, o que suxire que este mecanismo produce algunha vantaxe evolutiva aínda non identificada.
Función[editar | editar a fonte]

Os sistemas colinérxicos están implicados en numerosas funcións neurolóxicas. A alteración nalgunhas neuronas colinérxicas pode explicar as altercións observadas na enfermidade de Alzheimer. A proteína codificada por este xene sintetiza o neurotransmisor acetilcolina. A acetilcolina actúa sobre dúas clases de receptores no sistema nervioso central (muscarínicos e nicotínicos) que están cada un implicado en diferentes respostas fisiolóxicas. O papel da acetilcolina no receptor nicotínico aínda está investigándose. Probablemente está implicado nas vía de recompensa/reforzo, como indica a natureza adictiva da nicotina, que tamén se une ao receptor nicotínico. A acción muscarínica da acetilcolina no sistema nervioso central intervén na aprendizaxe e memoria. A perda de innervación colinérxica no neocórtex foi asociada coa perda de memoria, como se evidencia en casos de alzhéimer. No sistema nervioso periférico, as neuronas colinérxicas están implicadas no control de funcións viscerais como, entre outras, a contracción do músculo cardíaco e a función do tracto gastrointestinal.
Utilízase a miúdo como marcador inmunohistoquímico para as motoneuronas.
Mutacións[editar | editar a fonte]
Illáronse mutantes da ChAT en varias especies, como Caenorhabditis elegans, Drosophila e humanos. A maioría dos mutantes non letais que teñen un fenotipo de tipo non salvaxe mostran algunha actividade, pero menos significativamente que o tipo salvaxe.
En C. elegans varias mutacións na ChAT foron rastrexadas ao xene cha-1. Todas as mutacións teñen como resultado unha caída significativa na actividade da ChAT. A perda percentual de actividade pode chegar a ser do 98 % nalgúns casos. Os efectos fenotípicos inclúen o crecemento máis lento, a diminución do tamaño, o comportamento descoordinado e a falta de sensibilidade aos inhibidores da colinesterase.[15] Os mutantes sensibles á temperatura illados en Drosophila eran todos letais. Antes da súa morte, as moscas afectadas mostraban un cambio de comportamento, incluíndo movementos incontrolados e un cambio na actividade no electrorretinograma.[16]
O xene humano responsable de codificar a ChAT é o CHAT. As mutacións en CHAT foron ligadas á síndrome miasténica conxénita, unha doenza que causa unha deficiencia da función motora xeral e debilidade. Outro síntoma é unha apnea mortal. Dos dez mutantes illados, 1 mostraba unha falta completa de actividade, 8 presentaban unha diminución significativa da actividade, e 1 tiña unha función descoñecida.[17]
Importancia clínica[editar | editar a fonte]
Enfermidade de Alzheimer[editar | editar a fonte]
A enfermidade de Alzheimer causa dificultades na memoria e na cognición. As concentracións de acetilcolina e de ChAT están notablemente reducidas no córtex cerebral e no hipocampo.[18] Aínda que a perda celular e a disfunción das neuronas colinérxicas considérase que contribúe ao alzhéimer, xeralmente non se considera o factor primario no desenvolvemento desa doenza. Propúxose que a agregación e depólsito de proteína beta-amiloide, interfire co metabolismo das neuronas e causa danos nos axóns colinérxicos do córtex e nas neuronas colinérxicas no prosencéfalo basal.[19]
Esclerose lateral amiotrófica[editar | editar a fonte]
A esclerose lateral amiotrófica (ELA) é unha das enfermidades máis comúns das neuronas motoras. Na ELA obsérvase unha perda significativa da inmunorreactividade da ChAT.[20] Hipotetízase que a función colinérxica está implicada nun incremento incontrolado da concentración de calcio intracelular cuxa razón aínda segue sendo pouco clara.[21]
Fármacos[editar | editar a fonte]
O metilsulfato de neoestigmina, un axente anticolinesterase, foi utilizado para actuar sobre a ChAT. En concreto, o uso deste axente mostrou efectos positivos contra a síndrome miasténica conxénita.[22]
A exposición ao estradiol incrementa a actividade da ChAT en ratas femia.[23]
Notas[editar | editar a fonte]
- ↑ Strauss WL, Kemper RR, Jayakar P, Kong CF, Hersh LB, Hilt DC, Rabin M (febreiro de 1991). "Human choline acetyltransferase gene maps to region 10q11-q22.2 by in situ hybridization". Genomics 9 (2): 396–8. PMID 1840566. doi:10.1016/0888-7543(91)90273-H.
- ↑ 2,0 2,1 2,2 Nachmansohn D, Machado AL (1943). "The Formation of Acetylcholine. A New Enzyme: Choline Acetylase". J. Neurophysiol. 6 (5): 397–403. doi:10.1152/jn.1943.6.5.397.
- ↑ Berman R, Wilson IB, Nachmansohn D (setembro-outubro de 1953). "Choline acetylase specificity in relation to biological function". Biochimica et Biophysica Acta 12 (1–2): 315–24. PMID 13115440. doi:10.1016/0006-3002(53)90150-4.
- ↑ Lipmann F, Kaplan NO (1946). "A Common Factor in the Enzymatic Acetylation of Sulfanilamide and of Choline". J. Biol. Chem. 162 (3): 743–744. doi:10.1016/S0021-9258(17)41419-0.
- ↑ Lipton MA (1946). "Mechanism of the enzymatic synthesis of acetylcholine". Fed. Proc. 5 (1 Pt 2): 145. PMID 21066687.
- ↑ Nachmansohn D, Berman M (1946). "Studies on choline acetylase; on the preparation of the coenzyme and its effect on the enzyme". J. Biol. Chem. 165 (2): 551–63. PMID 20276121. doi:10.1016/S0021-9258(17)41168-9.
- ↑ Jones DH, Nelson WL (1968). "A method for isolation of coenzyme A products". Anal. Biochem. 26 (3): 350–7. PMID 5716187. doi:10.1016/0003-2697(68)90195-4.
- ↑ Govindasamy L, Pedersen B, Lian W, Kukar T, Gu Y, Jin S, Agbandje-McKenna M, Wu D, McKenna R (novembro de 2004). "Structural insights and functional implications of choline acetyltransferase". Journal of Structural Biology 148 (2): 226–35. PMID 15477102. doi:10.1016/j.jsb.2004.06.005.
- ↑ Oda Y (novembro de 1999). "Choline acetyltransferase: the structure, distribution and pathologic changes in the central nervous system.". Pathology International 49 (11): 921–37. PMID 10594838. doi:10.1046/j.1440-1827.1999.00977.x.
- ↑ Tandon A, Bachoo M, Weldon P, Polosa C, Collier B (1996). "Effects of colchicine application to preganglionic axons on choline acetyltransferase activity and acetylcholine content and release in the superior cervical ganglion". J. Neurochem. 66 (3): 1033–41. PMID 8769864. doi:10.1046/j.1471-4159.1996.66031033.x.
- ↑ Pahud G, Salem N, van de Goor J, Medilanski J, Pellegrinelli N, Eder-Colli L (25 de maio de 1998). "Study of subcellular localization of membrane-bound choline acetyltransferase in Drosophila central nervous system and its association with membranes". European Journal of Neuroscience 10 (5): 1644–53. PMID 9751137. doi:10.1046/j.1460-9568.1998.00177.x.
- ↑ Bruce G, Hersh LB (decembro de 1987). "Studies on detergent released choline acetyltransferase from membrane fractions of rat and human brain.". Neurochem Res 12 (12): 1059–66. PMID 2450285. doi:10.1007/bf00971705.
- ↑ Carroll PT (1994). "Membrane-bound choline-O-acetyltransferase in rat hippocampal tissue is associated with synaptic vesicles". Brain Res. 633 (1–2): 112–8. PMID 8137149. doi:10.1016/0006-8993(94)91529-6.
- ↑ Rand, James. "Acetylcholine". WormBook.
- ↑ Rand JB, Russell RL (febreiro de 1984). "Choline acetyltransferase-deficient mutants of the nematode Caenorhabditis elegans". Genetics 106 (2): 227–48. PMC 1202253. PMID 6698395. doi:10.1093/genetics/106.2.227.
- ↑ Greenspan RJ (1980). "Mutations of choline acetyltransferase and associated neural defects". Journal of Comparative Physiology 137 (1): 83–92. doi:10.1007/BF00656920.
- ↑ Ohno K, Tsujino A, Brengman JM, Harper CM, Bajzer Z, Udd B, Beyring R, Robb S, Kirkham FJ, Engel AG (13 de febreiro de 2001). "Choline acetyltransferase mutations cause myasthenic syndrome associated with episodic apnea in humans". Proceedings of the National Academy of Sciences 98 (4): 2017–2022. Bibcode:2001PNAS...98.2017O. PMC 29374. PMID 11172068. doi:10.1073/pnas.98.4.2017.
- ↑ Bartus RT, Dean RL, Beer B, Lippa AS (30 de xullo de 1982). "The cholinergic hypothesis of geriatric memory dysfunction". Science 217 (4558): 408–14. Bibcode:1982Sci...217..408B. PMID 7046051. doi:10.1126/science.7046051.
- ↑ Geula C, Mesulam MM, Saroff DM, Wu CK (xaneiro de 1998). "Relationship between plaques, tangles, and loss of cortical cholinergic fibers in Alzheimer disease". J Neuropathol Exp Neurol 57 (1): 63–75. PMID 9600198. doi:10.1097/00005072-199801000-00008.
- ↑ Oda Y, Imai S, Nakanishi I, Ichikawa T, Deguchi T (decembro de 1995). "Immunohistochemical study on choline acetyltransferase in the spinal cord of patients with amyotrophic lateral sclerosis". Pathol Int 45 (12): 933–9. PMID 8808298. doi:10.1111/j.1440-1827.1995.tb03418.x.
- ↑ Morrison BM, Morrison JH (xaneiro de 1999). "Amyotrophic lateral sclerosis associated with mutations in superoxide dismutase: a putative mechanism of degeneration". Brain Res Brain Res Rev 29 (1): 121–35. PMID 9974153. doi:10.1016/s0165-0173(98)00049-6.
- ↑ Greer M, Schotland M (xullo de 1960). "Myasthenia gravis in the newborn". Pediatrics 26: 101–8. PMID 13851666. doi:10.1542/peds.26.1.101.
- ↑ Luine VN (August 1985). "Estradiol increases choline acetyltransferase activity in specific basal forebrain nuclei and projection areas of female rats". Experimental Neurology 89 (2): 484–90. PMID 2990988. doi:10.1016/0014-4886(85)90108-6.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Oda Y (2000). "Choline acetyltransferase: the structure, distribution and pathologic changes in the central nervous system". Pathol. Int. 49 (11): 921–37. PMID 10594838. doi:10.1046/j.1440-1827.1999.00977.x.
- Wang J, Fu X, Zhang D, Yu L, Li N, Lu Z, Gao Y, Wang M, Liu X, Zhou C, Han W, Yan B, Wang J (2017). "ChAT-positive neurons participate in subventricular zone neurogenesis after middle cerebral artery occlusion in mice". Behav. Brain Res. 316: 145–151. PMC 5048585. PMID 27609645. doi:10.1016/j.bbr.2016.09.007.
- Oda Y, Nakanishi I, Deguchi T (1993). "A complementary DNA for human choline acetyltransferase induces two forms of enzyme with different molecular weights in cultured cells". Brain Res. Mol. Brain Res. 16 (3–4): 287–94. PMID 1337937. doi:10.1016/0169-328X(92)90237-6.
- Wang J, Lu Z, Fu X, Zhang D, Yu L, Li N, Gao Y, Liu X, Yin C, Ke J, Li L, Zhai M, Wu S, Fan J, Lv L, Liu J, Chen X, Yang Q, Wang J (2017). "Alpha-7 Nicotinic Receptor Signaling Pathway Participates in the Neurogenesis Induced by ChAT-Positive Neurons in the Subventricular Zone". Transl Stroke Res 8 (5): 484–493. PMC 5704989. PMID 28551702. doi:10.1007/s12975-017-0541-7.
- Toussaint JL, Geoffroy V, Schmitt M, Werner A, Garnier JM, Simoni P, Kempf J (1992). "Human choline acetyltransferase (CHAT): partial gene sequence and potential control regions". Genomics 12 (2): 412–6. PMID 1339386. doi:10.1016/0888-7543(92)90395-9.
- Lorenzi MV, Trinidad AC, Zhang R, Strauss WL (1992). "Two mRNAs are transcribed from the human gene for choline acetyltransferase". DNA Cell Biol. 11 (8): 593–603. PMID 1388731. doi:10.1089/dna.1992.11.593.
- Misawa H, Ishii K, Deguchi T (1992). "Gene expression of mouse choline acetyltransferase. Alternative splicing and identification of a highly active promoter region". J. Biol. Chem. 267 (28): 20392–9. PMID 1400357. doi:10.1016/S0021-9258(19)88714-8.
- Cervini R, Rocchi M, DiDonato S, Finocchiaro G (1992). "Isolation and sub-chromosomal localization of a DNA fragment of the human choline acetyltransferase gene". Neurosci. Lett. 132 (2): 191–4. PMID 1784419. doi:10.1016/0304-3940(91)90299-9.
- Strauss WL, Kemper RR, Jayakar P, Kong CF, Hersh LB, Hilt DC, Rabin M (1991). "Human choline acetyltransferase gene maps to region 10q11-q22.2 by in situ hybridization". Genomics 9 (2): 396–8. PMID 1840566. doi:10.1016/0888-7543(91)90273-H.
- Viegas-Péquignot E, Berrard S, Brice A, Apiou F, Mallet J (1991). "Localization of a 900-bp-long fragment of the human choline acetyltransferase gene to 10q11.2 by nonradioactive in situ hybridization". Genomics 9 (1): 210–2. PMID 2004764. doi:10.1016/0888-7543(91)90242-7.
- Itoh N, Slemmon JR, Hawke DH, Williamson R, Morita E, Itakura K, Roberts E, Shively JE, Crawford GD, Salvaterra PM (1986). "Cloning of Drosophila choline acetyltransferase cDNA". Proc. Natl. Acad. Sci. U.S.A. 83 (11): 4081–5. Bibcode:1986PNAS...83.4081I. PMC 323670. PMID 3086876. doi:10.1073/pnas.83.11.4081.
- Hersh LB, Takane K, Gylys K, Moomaw C, Slaughter C (1988). "Conservation of amino acid sequences between human and porcine choline acetyltransferase". J. Neurochem. 51 (6): 1843–5. PMID 3183663. doi:10.1111/j.1471-4159.1988.tb01166.x.
- Berrard S, Brice A, Lottspeich F, Braun A, Barde YA, Mallet J (1988). "cDNA cloning and complete sequence of porcine choline acetyltransferase: in vitro translation of the corresponding RNA yields an active protein". Proc. Natl. Acad. Sci. U.S.A. 84 (24): 9280–4. PMC 373252. PMID 3480542. doi:10.1073/pnas.84.24.9280.
- Chireux MA, Le Van Thai A, Weber MJ (1995). "Human choline acetyltransferase gene: localization of alternative first exons". J. Neurosci. Res. 40 (4): 427–38. PMID 7616604. doi:10.1002/jnr.490400402.
- Bausero P, Schmitt M, Toussaint JL, Simoni P, Geoffroy V, Queuche D, Duclaud S, Kempf J, Quirin-Stricker C (1993). "Identification and analysis of the human choline acetyltransferase gene promoter". NeuroReport 4 (3): 287–90. PMID 7682855. doi:10.1097/00001756-199303000-00015.
- Quirin-Stricker C, Nappey V, Simoni P, Toussaint JL, Schmitt M (1994). "Trans-activation by thyroid hormone receptors of the 5' flanking region of the human ChAT gene". Brain Res. Mol. Brain Res. 23 (3): 253–65. PMID 8057782. doi:10.1016/0169-328X(94)90232-1.
- Erickson JD, Varoqui H, Schäfer MK, Modi W, Diebler MF, Weihe E, Rand J, Eiden LE, Bonner TI, Usdin TB (1994). "Functional identification of a vesicular acetylcholine transporter and its expression from a "cholinergic" gene locus". J. Biol. Chem. 269 (35): 21929–32. PMID 8071310. doi:10.1016/S0021-9258(17)31734-9.
- Kengaku M, Misawa H, Deguchi T (1993). "Multiple mRNA species of choline acetyltransferase from rat spinal cord". Brain Res. Mol. Brain Res. 18 (1–2): 71–6. PMID 8479291. doi:10.1016/0169-328X(93)90174-N.
- Misawa H, Matsuura J, Oda Y, Takahashi R, Deguchi T (1997). "Human choline acetyltransferase mRNAs with different 5'-region produce a 69-kDa major translation product". Brain Res. Mol. Brain Res. 44 (2): 323–33. PMID 9073174. doi:10.1016/S0169-328X(96)00231-8.
- Lönnerberg P, Ibáñez CF (1999). "Novel, testis-specific mRNA transcripts encoding N-terminally truncated choline acetyltransferase". Mol. Reprod. Dev. 53 (3): 274–81. PMID 10369388. doi:10.1002/(SICI)1098-2795(199907)53:3<274::AID-MRD3>3.0.CO;2-8.
- Sakakibara A, Hattori S (2000). "Chat, a Cas/HEF1-associated adaptor protein that integrates multiple signaling pathways". J. Biol. Chem. 275 (9): 6404–10. PMID 10692442. doi:10.1074/jbc.275.9.6404.
Ligazóns externas[editar | editar a fonte]
- Choline Acetyltransferase Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.