Estrutura cristalina


A estrutura cristalina dun sólido é a designación dada ao conxunto de propiedades que resultan da forma en que se ordenan espacialmente os átomos ou moléculas que o constitúen. Téñase en conta que só os sólidos cristalinos presentan esta característica, xa que é o resultado macroscópico da existencia subxacente dunha estrutura ordenada a nivel atómico, replicada no espazo a distancias significativas da dimensión atómica ou molecular, o que é exclusivo dos cristais.
Prevalencia da estrutura cristalina[editar | editar a fonte]
Dado que, de maneira xeral, a materia sólida se presenta baixo dous estados fundamentais de ordenación: o amorfo e o cristalino, só presentan unha estrutura cristalina os sólidos que teñen unha estrutura interna ordenada.
Con todo, esta definición pode ser enganosa, xa que son comúns as substancias parcialmente cristalinas, é dicir, compostas por porcións cristalinas incrustadas en material amorfo (é o caso da maioría das rochas). Tamén materiais aparentemente amorfos poden ser cristalinos, como a area de cuarzo (que está formada por unha miríade de pequenos cristais) ou das arxilas (que aparentan ser amorfas pero son formadas por cristais microscópicos).
Sistemas cristalinos[editar | editar a fonte]



A existencia da estrutura cristalina resulta de que os sólidos cristalinos se constrúen a partir da repetición no espazo dunha estrutura elemental paralelepípeda chamada célula unitaria (ver figura á dereita).
A forma e o tamaño da célula unitaria de cada cristal depende das dimensións, da valencia química e do estado de ionización dos átomos ou moléculas que o compoñen e das condicións nas que se formou o cristal. A mesma substancia, baixo condicións de presión e temperatura distintas, pode formar cristais con células unitarias totalmente diferentes. Un exemplo clásico é o carbono, que pode, dependendo das condicións, cristalizar en centos de formas, que van desde o diamante ao grafito, pasando polos fulerenos e innúmeras variantes de fibra de carbono, grafeno, etc. Tamén as substancias orgánicas, desde azucres a proteínas e ADN, cristalizan en formas extremadamente complexas como resultado do seu alto peso molecular e complexidade estrutural.
A pesar da súa enorme diversidade, os cristais, dependendo da súa composición e condicións de formación, adoptan formas regulares e agora son facilmente deducibles dependendo das características atómicas e moleculares dos seus compoñentes. Isto permite clasificalos facilmente segundo un número reducido de parámetros, coñecidos como parámetros de rede .
A partir destes parámetros é posíbel determinar o paralelepípedo que constitúe a subdivisión máis pequena dunha rede cristalina que conserve as características xerais de toda a retícula, de xeito que, simplemente multiplicándoa, se poida reconstruír o sólido cristalino completo. Estes paralelepípedos son xeralmente chamados células unitaria.
A partir das celas unitarias, e tendo en conta os eixos de simetría e a posición do centro xeométrico de cada elemento cristalino, é posíbel describir calquera cristal con base a diagramas designados polas redes de Bravais, nome que rende homenaxe a Auguste Bravais (1811-1863), un dos pioneiros do seu estudo.
A figura da dereita presenta o diagrama explicativo da forma como cada célula unitaria determina a estrutura do cristal. Na realidade, cada cristal está constituído pola repetición de millóns ou billóns de células unitarias similares, agrupadas de xeito regular que, funcionando como auténticos bloques de construción do cristal, acaban por determinar a súa macroestrutura.
Nos cristais naturais, múltiplas células unitarias son substituídas por impurezas, dando a cada cristal distintas características de forma e cor. Estas impurezas son de fundamental importancia para determinar as características dos cristais naturais, en particular os minerais, para determinar as propiedades eléctricas e ópticas, a temperatura de fusión e a reactividade química.
Sistemas de cristalización[editar | editar a fonte]
Dependendo dos parámetros da rede, isto é, da lonxitude dos lados e dos eixos do paralelepípedo elemental da cela unitaria e dos ángulos que forman as súas caras entre si, poden identificarse sistemas de cristalización ou sistemas cristalinos básicos. Neste contexto, un sistema de cristalización é o grupo puntual da rede cristalina, é dicir, o conxunto de simetrías de rotación e reflexión permitidas ao manter un fixo un punto da malla (ignorando os átomos ou moléculas contidos en cada célula unitaria).
A análise xeométrica dos sistemas de cristalización permíte concluír que existen sete sistemas distintos (ver táboa a continuación), aínda que dentro dalgúns deles é posíbel distinguir subcategorías en función dos centros de simetría. A designación dos eixos e dos ángulos entre os eixos é a que resulta do diagrama que acompaña á táboa.
Os seguintes sete sistemas básicos de cristalización resultan da combinación de eixos e ángulos:
- Cúbico ou isométrico: proporciona catro eixos de rotación ternarios, o que permite un gran número de grupos espaciais (36). Produce estruturas sinxelas e lineais e, ademais de todos os cristais que teñen catro eixes de simetría ternaria, os eixos cristalográficos teñen lonxitudes iguais e son perpendiculares entre si.
- Tetragonal: permite un eixo de rotación cuaternario e 68 grupos espaciais (o maior número posíbel en calquera sistema). Todos os cristais deste sistema teñen a característica de ter, ademais dun eixo de simetría cuaternaria, tres eixos cristalográficos perpendiculares entre si, sendo os dous horizontais de igual lonxitude e o vertical de diferente lonxitude.
- Ortorrómbico - require tres eixos binarios de rotación ou un eixo binario de rotación e dous planos de imaxe reflexa. Permite 59 grupos espaciais. Produce estruturas moi complexas que teñen como característica común a todos os cristais deste sistema que presentan polo menos un eixo de simetría binario. Teñen tres eixos cristalográficos perpendiculares entre si, todos con lonxitudes diferentes.
- Hexagonal: permite un eixo de rotación senar (eixo de orde seis) e 27 grupos espaciais, pero ás veces considérase como unha mera variante do sistema trigonal (por duplicación). Neste sistema todos os cristais teñen un eixo de simetría ternario ou un eixe de simetría senar. Teñen catro eixos cristalográficos, dos cales tres son horizontais, con lonxitudes iguais e se cruzan en ángulos de 120 °, e o cuarto é vertical, cunha lonxitude diferente aos demais.
- Romboédrico ou trigonal - require un eixo de rotación ternario, permitindo 25 grupos espaciais.
- Monoclínico : require un eixo de xiro binario e un plano reflexo. Permite 13 grupos espaciais. Os cristais deste sistema normalmente teñen só un eixo binario de simetría, ou un único plano de simetría, ou unha combinación de ambos. Teñen tres eixos cristalográficos, todos con lonxitudes diferentes. Dous eixos forman un ángulo oblicuo entre si, sendo o terceiro perpendicular ao plano formado polos outros dous.
- Triclinico: agrupa todos os casos que non se poden acomodar en ningún dos outros sistemas, mostrando só simetría ou inversión de tradución. Permite só 2 grupos de espazo. Os cristais con este sistema caracterízanse pola ausencia de eixes ou planos de simetría, presentando tres eixos cristalográficos con lonxitudes desiguais e oblicuos entre si.
Unha análise do grao de simetría de cada un dos sistemas mencionados anteriormente permite concluír que o máis sinxelo e o máis simétrico é o cúbico, xa que presenta a simetría do cubo, beneficiándose da isometría das súas caras. Os seis sistemas restantes están ordenados segundo a seguinte secuencia de simetría decrecente: hexagonal, tetragonal, romboédrica, ortorrómbica, monoclínica e triclínica .
Frecuentemente considérase que o sistema hexagonal é unha variante do sistema trigonal, xa que se pode, sen alterar as simetrías, partir dun para producir o outro.
Redes de Bravais[editar | editar a fonte]
| Familia/ Rede cristalina | Simetría | Redes de Bravais | |||
|---|---|---|---|---|---|
| Primitiva | Centrada na base | Centrada no corpo | Centrada nun lado | ||
| Triclínico | Ci |  |
|||
| Monoclínico | C2h |  |
 |
||
| Ortorrómbico | D2h |  |
 |
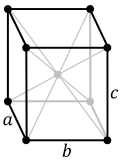 |
 |
| Tetragonal | D4h |  |
 |
||
| Hexagonal | D6h |  |
|||
| Cúbico | Oh | 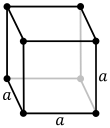 |
 |
 | |
Á súa vez, en función das posíbeis localizacións das partículas (átomos, íons ou moléculas) na célula unitária, estabelécense 14 estruturas cristalinas básicas, as denominadas redes de Bravais (ver táboa á dereita).
Unha rede de Bravais é un conxunto de puntos construídos mediante a traslación dun único punto en intervalos discretos determinados por un conxunto de vectores chamados vectores base.[1] Todos os materiais cristalinos identificados até o momento pertencen a unha das 14 matrices tridimensionais correspondentes ás estruturas cristalinas básicas de Bravais. As excepcións coñecidas son os cuasi-cristais de Shechtman, que non obstante non son verdadeiros cristais por non teren unha malla cunha repetición espacial uniforme.
A estrutura de cada cristal pódese representar por unha das estruturas constantes listadas na táboa, e logo agruparse nun dos sete sistemas de cristalización. Cada unha das estruturas agrega unha célula unitaria, que contén átomos en coordenadas específicas de cada punto da rede cristalina. Por incluír a célula unitaria, a simetría do cristal pode ser máis complexa que a simetría da malla cristalina respectiva.
Grupos puntuais e espaciais[editar | editar a fonte]
O grupo cristalográfico de puntos, ou clase de cristal, é o conxunto de simetrías non translacionais que se poden realizar deixando un punto de cristal fixo. A partir dos sete sistemas de cristalización poden obterse 32 clases distintas de cristal.
O grupo espacial dunha estrutura cristalina está composto polo conxunto das simetrías de translación e do grupo de puntual. De aí resultan 230 grupos espaciais distintos, distribuídos (ver arriba) polos diversos sistemas de cristalización.
Relacións de simetría nos cristais[editar | editar a fonte]
Os cristais pódense agrupar en 32 clases, ou grupos puntuais, segundo o número de eixos de rotación e planos de reflexión que permiten baixo a condición de manter invariante a malla cristalina. Estas clases, por indicaren a asimetría estrutural do cristal, e a consecuente asimetría na distribución de cargas eléctricas, corresponden a importantes variacións no comportamento piezoeléctrico e piroeléctrico dos materiais.
Piezoelectricidade e polarización[editar | editar a fonte]
Das 32 clases de simetría, 20 presentan actividade piezoeléctrica, coincidindo con aquelas clases que non teñen centro de simetría.
Aínda que calquera material non condutor desenvolve polarización dieléctrica cando é sometido a un campo eléctrico, hai materiais que desenvolven polarización mesmo en ausencia de campos. Eses materiais chámanse polares, sendo esta propiedade determinada exclusivamente pola estrutura cristalina. Só 10 das 32 clases de cristais exhiben comportamento polar. Todos os materiais polares son simultaneamente piezoeléctricos.
Materiais ferroeléctricos[editar | editar a fonte]

Algunhas estruturas cristalinas, especialmente perovskita e materiais similares, presentan un comportamento ferroeléctrico. Esta propiedade é análoga ao ferromagnetismo, xa que na ausencia dun campo eléctrico cando se produce o cristal, non presenta polarización, gañándoa permanentemente só cando se expón a un campo eléctrico de magnitude significativa. Este comportamento é similar á magnetización do ferro.
Esta polarización inducida pode ser revertida pola aplicación dun campo de polarización inversa de magnitude adecuada.
A pesar de seren designados ferroeléctricos, os cristais que posúen esta propiedade non teñen necesariamente ferro na súa composición, xa que esta propiedade se debe exclusivamente á asimetría na estrutura cristalina, que é independente da composición química.
Coordinación atómica[editar | editar a fonte]
Considerando a disposición dos átomos entre si, os seus números de coordinación (ou número de veciños máis próximos), distancias interatómicas, tipos de enlace, etc., é posible formar unha visión xeral das estruturas e formas alternativas de visualizalas.[2]
Empacotamento compacto[editar | editar a fonte]


Os principios implicados pódense entender considerando a forma máis eficiente de empaquetar esferas de igual tamaño e apilar planos atómicos en tres dimensións. Por exemplo, se o plano A está debaixo do plano B, hai dúas formas posibles de colocar un átomo adicional encima da capa B. Se se colocase unha capa adicional directamente sobre o plano A, daría lugar á seguinte serie:
- ... 'ABABABAB' ...
Esta disposición de átomos nunha estrutura cristalina coñécese como 'hexagonal close packing (hcp)' (empacotamento cuase-hexagonal).
Non obstante, se os tres planos están escalonados entre si e non é até que a cuarta capa se coloca directamente sobre o plano A que se repite a secuencia, entón xorde a seguinte secuencia:
- ... 'ABCABCABC' ...
Este tipo de disposición estrutural coñécese como 'cubic close packing (ccp)' (empacotamento cuase-cúbico).
A célula unitaria dunha disposición de átomos ccp é a célula unidade cúbica centrada na cara (fcc). Isto non é inmediatamente evidente xa que as capas moi empaquetadas son paralelas aos planos {111} da cela da unidade fcc. Hai catro orientacións diferentes das capas empaquetadas.
A 'eficiencia de empaquetado' pódese calcular calculando o volume total das esferas e dividindo polo volume da cela do seguinte xeito:
A eficiencia do envasado do 74% é a densidade máxima posible nas celas unitarias construídas con esferas dun só tamaño. A maioría das formas cristalinas de elementos metálicos son hcp, fcc ou bcc (cúbicos centrados no corpo). O número de coordinación de átomos nas estruturas hcp e fcc é 12 e o seu factor de empaquetado atómico (APF) é o número mencionado anteriormente, 0,74. Isto pódese comparar co APF dunha estrutura bcc, que é 0,68.
Notas[editar | editar a fonte]
- ↑ CHAVES, Alaor S. (2001). Física 4. Rio de Janeiro. p. 105. ISBN 85-87148-53-2.
- ↑ Parker, C.B. (1994). McGraw Hill Encyclopaedia of Physics (2ª ed.). ISBN 978-0070514003.
Véxase tamén[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Estrutura cristalina |
Outros artigos[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Capítulo 3 Estrutura cristalina (en portugués)
- Concepto de "célula unitaria"Arquivado 28 de decembro de 2004 en Wayback Machine. (en portugués)
- Sistemas de cristalización mineral (en alemán)
- Diagramas de sistemas de cristalizaciónArquivado 15 de decembro de 2005 en Wayback Machine. (en alemán)
- Instrucións sobre a simulación de cristais (en XAFS)Arquivado 19 de xullo de 2011 en Wayback Machine. (en inglés)
- (en inglés) Clasificación de cristais (en inglés)
- (en inglés) Introdución á cristalografía (en inglés)
- (en inglés) Índices de Miller (en inglés)
- (en inglés) Modelos 3D interactivos de cristais (en inglés)
- Artigo sobre as incoherencias na clasificación francófona Arquivado 23 de maio de 2013 en Wayback Machine. (en francés)
- Elementos de cristalografía (en francés)

