Ácido tartárico
| Ácido tartárico[1] | |
|---|---|
 | |
 | |
Ácido 2,3-dihidroxibutanodioico | |
Outros nomes Ácido 2,3-dihidroxisuccínico | |
| Identificadores | |
| Número CAS | 526-83-0 |
| PubChem | 875 |
| ChemSpider | 852 |
| DrugBank | DB01694 |
| KEGG | C00898 |
| MeSH | tartaric+acid |
| ChEBI | CHEBI:15674 |
| ChEMBL | CHEMBL333714, CHEMBL1200861 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
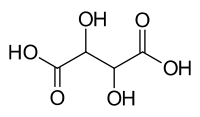
| Fórmula molecular | C4H6O6 (fórmula básica) HO2CCH(OH)CH(OH)CO2H (fórmula estrutural) |
| Masa molecular | 150,087 g/mol |
| Aspecto | po branco |
| Densidade | 1,79 g/mL (H2O) |
| Punto de fusión | 171–174 °C (L ou D-tartárico; puro) 206 °C (DL, racémico) 165–166 °C ("meso-anhidro") 146–148 °C (meso-hidro)[2] |
| Solubilidade en auga | 133 g/100ml (20 °C) |
| Acidez (pKa) | L(+) 25 °C : pKa1= 2,89 pKa2= 4,40 meso 25 °C: pKa1= 3,22 pKa2= 4,85 |
| Perigosidade | |
| Clasificación da UE | Irritante(Xi) |
| Frases R | R36 |
| Compostos relacionados | |
| Outros catións | Tartarato monosódico Tartarato disódico Tartarato monopotásico Tartarato dipotásico |
| Ácido carboxílico relacionados | Ácido butírico ácido succínico ácido dimercaptosuccínico ácido málico ácido maleico ácido fumárico |
| Compostos relacionados | 2,3-butanodiol ácido cicórico |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O ácido tartárico é un ácido carboxílico. A súa fórmula é: HOOC-CHOH-CHOH-COOH, con fórmula molecular . O seu peso molecular é 150 . C4H6O6. Contén, por tanto, dous grupos carboxílicos e dous grupos alcohol nunha cadea de hidrocarburo lineal de lonxitude catro. Pode considerarse un azucre ácido do grupo dos ácidos aldáricos.
Orixe e síntese[editar | editar a fonte]

Este ácido, que se atopa en moitas plantas, era xa coñecido polos gregos e os romanos e atópase na natureza en forma de tartarato ácido de potasio no zume da uva.
Foi illado por primeira vez o ano 1769 polo químico sueco Carl Wilhelm Scheele. Posúe un [[pKa]] de 3,036, e considerase un ácido débil.
Aplicacións[editar | editar a fonte]
Emprégase a escala industrial, na preparación de bebidas efervescentes como gaseosas.
Tamén se amprega en fotografía e vernices e unha variante coñecida como sal de Rochelle constitúe un suave laxante.
Nalgunhas das súas formas, o ácido tartárico emprégase como condimento para a comida, onde se coñece como cremor tártaro. Emprégase en diversas receitas, especialmente en repostaría e confeitaría para aumentar o volume de masas e preparacións facéndoo reaccionar con bicarbonato para obter un sucedáneo de fermentación; emprégase tamén para estabilizar claras de ovo.
Notas[editar | editar a fonte]
- ↑ Tartaric Acid – Compound Summary, PubChem.
- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Dawson, R.M.C. et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
