Piruvato quinase

Piruvato quinase R/L
| |
| Identificadores | |
| Símbolo | PKRL |
| Símbolos alt. | PK1, PKL |
| OMIM | |
| RefSeq | NM_000298 |
| UniProt | P30613 |
| Outros datos | |
| Número EC | 2.7.1.40 |
| Locus | Cr. 1 q22 |
Piruvato quinase M1/M2
| |
| Identificadores | |
| Símbolo | PKM2 |
| Símbolos alt. | PK2, PK3, PKM |
| OMIM | |
| RefSeq | NM_001206796 |
| UniProt | P14618 |
| Outros datos | |
| Número EC | 2.7.1.40 |
| Locus | Cr. 15 q22-qter |
A piruvato quinase (número EC 2.7.1.40) é un encima que intervén no último paso da glicólise. Cataliza a transferencia dun grupo fosfato desde o fosfoenolpiruvato (PEP) ao ADP, rendendo unha molécula de piruvato e unha molécula de ATP. É unha das reaccións nas que se obtén enerxía na glicólise por medio dunha fosforilación a nivel de substrato.
Reacción
[editar | editar a fonte]A reacción da piruvato quinase é a seguinte:
| fosfoenolpiruvato (PEP) | piruvato quinase (PK) unha transferase |
piruvato (Pyr) | |
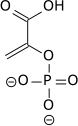
|

| ||
| ADP + H+ | ATP | ||

| |||
A reacción tamén require a presenza de ións magnesio. O encima pertence ao tipo das transferases e ao subtipo das quinases.
A reacción é o último paso da vía glicolítica, que orixina o produto final da glicólise, o piruvato.
Características e isoencimas
[editar | editar a fonte]O encima ten un peso molecular de 60 kDa, e está constituído por tres monómeros. En humanos, esta proteína está codificada en dous xenes de distintos cromosomas, chamados PKLR e PKM2. Isto dá lugar a varios tipos de piruvato quinases: o tipo M (muscular, SwissProt P14618) e o tipo L,R (do fígado e eritrocito, en inglés liver e red blood cell, SwissProt P30613). Os isoencimas difiren na súa estrutura primaria e regulación. O xene PKLR posúe a secuencia do isoencima eritrocitario (PKR) e hepático (PKL), mentres que PKM2 se expresa no músculo dando lugar a dous isoencimas chamados PKM1 e PKM2, que son diferentes debido a un proceso de splicing alternativo.[1]
Regulación
[editar | editar a fonte]Esta reacción presenta un gran cambio negativo de enerxía libre, que é un dos tres que hai na glicólise. Todas estas tres reaccións regulan a actividade global desta vía metabólica, e nas condicións celulares normais son irreversibles.
A actividade da piruvato quinase está regulada por:
- O seu propio substrato o fosfoenolpiruvato (PEP), e tamén o intermediato da glicólise frutosa 1,6-bisfosfato, os cales fan aumentar ambos os dous a actividade do encima. Deste xeito, a glicólise vai máis rápida cando hai máis substrato.
- A ATP, que é un inhibidor alostérico negativo. Isto explica a regulación paralela coa fosfofrutoquinase 1 (PFK 1).
- Crese que o acetil-CoA actúa como inhibidor alostérico negativo, e non se sabe seguro se o citrato tamén o fai.
- A alanina é outro modulador alostérico negativo.
Esta proteína podería utilizar o modelo de morfeeína da regulación alostérica.[2]
A piruvato quinase do fígado está tamén regulada indirectamente pola adrenalina (epinefrina) e o glicagón, por medio da proteína quinase A, a cal fosforila a piruvato quinase hepática, que como resultado se desactiva. A piruvato quinase do fígado non é inhibida pola activación por parte da adrenalina da proteína quinase A. Pola súa parte, a hormona glicagón é un sinal de xaxún (non hai glicosa dispoñible). Así, nos períodos de xaxún, a glicólise é inhibida no fígado pero non é afectada no músculo. Un incremento no azucre sanguíneo orixina a secreción de insulina, a cal activa a fosfoproteína fosfatase I, o que dá lugar á desfosforilación e activación da piruvato quinase. Estes controis impiden, en xeral, que a piruvato quinase se active ao mesmo tempo que os encimas que catalizan a reacción inversa (a piruvato carboxilase e a fosfoenolpiruvato carboxiquinase), o que impide que se xere un ciclo fútil.
En realidade, dicir que a reacción cara a adiante e a inversa non funcionan á vez non é de todo exacto, xa que os ciclos fútiles (ou ciclos de substrato) serven para axustar finamente o fluxo entre vías metabólicas.
Deficiencia
[editar | editar a fonte]
Os defectos xenéticos deste encima causan a enfermidade chamada deficiencia de piruvato quinase. Nesta condición, a falta de piruvato quinase fai máis lenta a glicólise. Este efecto é especialmente devastados nas células que carecen de mitocondrias, como os eritrocitos, porque estas células deben utilizar a fermentación como a súa única fonte de enerxía ao non teren ciclo do ácido cítrico. No caso dos eritrocitos, cando teñen deficiencia de piruvato quinase esgotan rapidamente o seu ATP e pode producirse hemólise. Por iso, a deficiencia de piruvato quinase pode producir anemia hemolítica.
Regulación da gliconeoxénese
[editar | editar a fonte]Aínda que non é un enicma gliconeoxénico, a piruvato quinase tamén serve como encima regulatorio para a gliconeoxénese, a ruta metabólica que xera glicosa no fígado a partir de piruvato e outros substratos. Cando a piruvato quinase está inhibida pola fosforilación (como ocorre no xaxún, por intermediación do glicagón), impídese que o fosfoenolpiruvato sexa convertido en piruvato. En lugar diso, o piruvato convértese en glicosa por medio da serie de reaccións da gliconeoxénese, que son esencialmente (pero non totalmente) as reaccións inversas das da glicólise.
A glicosa así producida pasa do fígado ao sangue, e fornece de enerxía a tecidos vitais en estado de xaxún.
Encimas alternativos
[editar | editar a fonte]Un encima reversible con función similar que se encontra nalgunhas bacterias é a piruvato fosfato diquinase (PPDK). Este encima foi transferido no decurso da evolución a varios grupos de eucariotas anaerobios (como Streblomastix, Giardia, Entamoeba, e Trichomonas), parece ser que por medio dunha transferencia horizontal de xenes que tivo lugar en dúas ou máis ocasións. Nalgúns casos, o mesmo organismo ten á vez piruvato quinase e PPDK.[3]
Notas
[editar | editar a fonte]- ↑ Lehninger, Albert (1993). Principles of Biochemistry, 2nd Ed. Worth Publishers. ISBN 0-87901-711-2.
- ↑ T. Selwood and E. K. Jaffe. (2011). "Dynamic dissociating homo-oligomers and the control of protein function.". Arch. Biochem. Biophys. 519 (2): 131–43. PMC 3298769. PMID 22182754. doi:10.1016/j.abb.2011.11.020.
- ↑ Liapounova, Na; Hampl, V; Gordon, Pm; Sensen, Cw; Gedamu, L; Dacks, Jb (2006). "Reconstructing the mosaic glycolytic pathway of the anaerobic eukaryote Monocercomonoides". Eukaryotic Cell 5 (12): 2138–46. ISSN 1535-9778. PMC 1694820. PMID 17071828. doi:10.1128/EC.00258-06.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- MeshName Pyruvate+kinase
