Pirrol
| Pirrol | |
|---|---|

|

|

|
|
1H-Pirrol | |
Outros nomes Azol | |
| Identificadores | |
| Número CAS | 109-97-7 |
| PubChem | 8027 |
| ChemSpider | 7736 |
| UNII | 86S1ZD6L2C |
| Número CE | 203-724-7 |
| Número UN | 1992, 1993 |
| ChEBI | CHEBI:19203 |
| ChEMBL | CHEMBL16225 |
| Número RTECS | UX9275000 |
| Referencia Beilstein | 1159 |
| Referencia Gmelin | 1705 |
| Imaxes 3D Jmol | Image 1 Image 2 |
| |
| |
| Propiedades | |
| Fórmula molecular | C4H5N |
| Masa molar | 67,09 g mol−1 |
| Densidade | 0,967 g cm–3 |
| Punto de fusión | −23 °C; −9 °F; 250 K |
| Punto de ebulición | 129–131 °C; 264–268 °F; 402–404 K |
| Presión de vapor | 7 mmHg a 23 °C |
| Viscosidade | 0,001225 Pa s |
| Termoquímica | |
| Entalpía estándar de formación ΔfH |
108,2 kJ mol–1 (gas) |
| Entalpía estándar de combustión ΔcH |
2242 kJ mol–1 |
| Capacidade calorífica, C | 1,903 J k–1 mol k–1 |
| Perigosidade | |
| NFPA 704 | |
| Punto de inflamabilidade | 3 333 °C; 6 031 °F; 3 606 K |
| Temperatura de autoignición | 550 °C; 1 022 °F; 823 K |
| Límites de explosividade | 3,1–14,8% |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O pirrol é un composto químico orgánico aromático e heterocíclico, formado por un anel de cinco membros coa fórmula C4H5N. Os seus derivados substituídos tamén se chaman pirrois (por exemplo, o N-metilpirrol).
Os pirrois únense formando aneis compostos máis grandes, como as porfirinas do grupo hemo, as clorinas e bacterioclorinas, clorofilas e o anel de corrina. Por exemplo, o grupo hemo fórmase a partir do porfobilinóxeno, un pirrol trisubstituído.
Propiedades
[editar | editar a fonte]O pirrol ten unha basicidade moi baixa comparada coa das aminas máis comíns e coa doutros compostos aromáticos como a piridina. Esta diminución da basicidade atribúese á deslocalización do par de electróns non compartidos do nitróxeno do anel. A protonación do pirrol orixina a perda da súa aromaticidade e, por tanto, é termodinamicamente desfavorable.
Como moitas outras aminas, o pirrol escurécese ao expoñerse ao aire e á luz, debido á formación de polipirrois e óxidos aminados, polo que debe ser destilado inmediatamente antes de usalo.[1]
Síntese
[editar | editar a fonte]O pirrol prepárase industrialmente tratando o furano con amoníaco en presenza dun catalizador sólido ácido.[2]
Outra vía sintética do pirrol consiste na descarboxilación do mucato de amonio, un sal de amonio do ácido múcico. Normalmente, este sal quéntase nun aparato de destilación con glicerol como solvente.[3]
Pirrois substituídos
[editar | editar a fonte]Existen moitos métodos para a síntese orgánica de derivados do pirrol. As reaccións máis comúns son a síntese de pirrois de Hantzsch, a síntese de Knorr e a síntese de Paal-Knorr. Outros métodos máis especializados son os que abreviaremos aquí.
Os reactivos iniciais para a síntese de Piloty-Robinson son dous equivalentes dun aldehido e de hidracina.[4][5] O produto é un pirrol con substituíntes específicos nas posicións 3 e 4. O aldehido reacciona coa diamina dando un intermediario di-imina (R–C=N−N=C–R), no cal ao agregar ácido clorhídrico prodúcese o peche do anel e a perda de amoníaco dando o pirrol.
Unha alternativa a esta reacción é tratar primeiro o propionaldehido con hidracina e logo con cloruro de benzoílo a altas temperaturas á vez que se irradia con microondas:[6]
No segundo paso, ten lugar unha reacción sigmatrópica [3,3] entre os dous intermediarios da reacción. Finalmente, o pirrol pode ser polimerizado para producir polipirrol.
Reactividade
[editar | editar a fonte]O protón NH nos pirrois é moderadamente ácido cun pKa de 16,5. O pirrol pode ser desprotonado con bases fortes como o butil-litio ou o hidruro de sodio. O pirroluro resultante é nucleófilico. Despois, ao tratarmos esta base conxugada cun electrófilo como o ioduro de metilo dános N-metilpirrol.
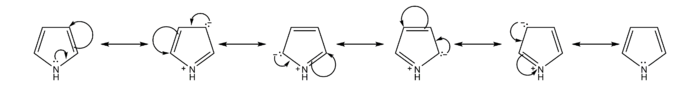
Examinar as estruturas que contribúen á resonancia do pirrol dános unha visión máis clara da reactividade deste composto. Igual ca o furano e o tiofeno, o pirrol é máis reactivo ca o benceno ante a substitución electrofilica aromática debido a que pode estabilizar a carga positiva no carbocatión intermedio.
O pirrol experimenta unha substitución electrofílica aromática predominantemente nas posicións 2 e 5. Dúas reaccións especialmente notables destinadas á produción de pirrois funcionalizados (con distintos grupos funcionais) son a reacción de Mannich e a reacción de Vilsmeier-Haack (abaixo),[7][8] as cales son compatibles cunha gran variedade de substratos pirrólicos.

Formilación dun derivado do pirrol (Garabatos-Perera 2007[7]).
O pirrol tamén pode reaccionar con aldehidos para dar porfirinas. Por exemplo, o benzaldehido condensa co pirrol para dar tetrafenilporfirina. Ademais, os compostos do pirrol poden tamén participar en cicloadicións como na reacción de Diels-Alder baixo certas condicións, por exemplo, en presenza de catálise ácida (de Lewis), quentamento ou alta presión.
O pirrol tamén polimeriza en presenza de luz. Pode utilizarse un axente oxidante como o persulfato de amonio a 0 °C na escuridade, para controlar dita polimerización.
Uso comercial
[editar | editar a fonte]O pirrol non ten unha aplicación comercial significativa, mais o N-metilpirrol é un precursor do ácido N-metilpirrolcarboxílico, o cal se usa como precursor na industria farmaceútica.[2]
Análogos e derivados
[editar | editar a fonte]
Análogos estruturais do pirrol son:
- Pirrolina, un análogo parcialmente saturado cun dobre enlace
- Pirrolidina, análogo hidroxenado saturado
- Criptopirrol, un derivado do pirrol que antes se pensaba estaba asociado á esquizofrenia
Análogos estruturais heteroatómicos dos pirrois son:
- Arsol, un análogo con arsénico moderadamente aromático
- Bismol, un análogo con bismuto
- Borol, un análogo con boro
- Furano, un análogo con osíxeno aromático
- Galol, un análogo con galio
- Xermol, un análogo con xermanio
- Fosfol,un análogo con fósforo non aromático
- Pirazol e imidazol, análogos con dous átomos de nitróxeno
- Silol, un análogo con silicio
- Estanol, un análogo con estaño
- Estibol, un análogo con antimonio
- Tiofeno, un análogo con xofre
Entre os derivados do pirrol está o indol, un derivado cun anel bencénico fusionado.
Notas
[editar | editar a fonte]- ↑ Armarego, Wilfred, L.F.; Chai, Christina, L.L. (2003). Purification of Laboratory Chemicals (5th ed.). Elsevier. p. 346.
- ↑ 2,0 2,1 Albrecht Ludwig Harreus "Pyrrole" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a22_453
- ↑ Practical Organic Chemistry, Vogel, 1956, Page 837, Link (12 MB)
- ↑ Piloty, O. (1910). "Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen". Chem. Ber. 43: 489. doi:10.1002/cber.19100430182.
- ↑ Robinson, Gertrude Maud; Robinson, Robert (1918). "LIV.—A new synthesis of tetraphenylpyrrole". J. Chem. Soc. 113: 639. doi:10.1039/CT9181300639.
- ↑ Benjamin C. Milgram, Katrine Eskildsen, Steven M. Richter, W. Robert Scheidt, and Karl A. Scheidt (2007). "Microwave-Assisted Piloty-Robinson Synthesis of 3,4-Disubstituted Pyrroles" (Note). J. Org. Chem. 72 (10): 3941–3944. PMC 1939979. PMID 17432915. doi:10.1021/jo070389.
- ↑ 7,0 7,1 Jose R. Garabatos-Perera, Benjamin H. Rotstein, and Alison Thompson (2007). "Comparison of Benzene, Nitrobenzene, and Dinitrobenzene 2-Arylsulfenylpyrroles". J. Org. Chem. 72 (19): 7382–7385. PMID 17705533. doi:10.1021/jo070493r.
- ↑ Os grupos 2-sulfenil no substrato pirrol serven como un grupo activador e como grupo protector, que pode ser eliminado co catalizador níquel Raney