Célula de Schwann
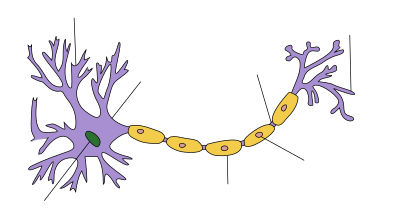
| Estrutura dunha neurona típica |
|---|
As células de Schwann ou neurolemocitos[1] (TA: gliocytus periphericus, gliocito periférico) son as principais células da glía do sistema nervioso periférico (SNP). Reciben o seu nome polo fisiólogo alemán Theodor Schwann, que as estudou. As células gliais, das cales hai varios tipos, teñen como misión apoiar as neuronas. As células de Schwann mielinizantes sitúanse arredor dos axóns das neuronas motoras e sensitivas, envolvéndoos e formando a vaíña de mielina, que os illa electricamente. Algunhas células de Schwann non son mielinizantes.
As células de Schwann están implicadas en diversos aspectos importantes da bioloxía dos nervios periféricos, como a condución de impulsos nerviosos ao longo dos axóns, o desenvolvemento dos nervios e a súa rexeneración, a alimentación da neurona, a produción da matriz nerviosa extracelular, a modulación da actividade sináptica neuromuscular, e a presentación de antíxenos aos linfocitos T. As células de Schwann están implicadas en neuropatías do SNP como a enfermidade de Charcot-Marie-Tooth, a síndrome de Guillain-Barré, a schwannomatose e a polirradiculoneuropatía desmielinizante inflamatoria crónica.
Descrición
[editar | editar a fonte]
As células de Schwann son un tipo de células gliais que manteñen vivas as fibras nerviosas periféricas (tanto mielínicas coma amielínicas). Nos axóns mielinizados, as células de Schwann forman a vaíña de mielina. Esta vaíña non é continua. Unha célula de Schwann mielinizante pode cubrir uns 100 micrómetros dun axón, os cales poden ter un metro ou máis de lonxitude. Isto supón unhas 10.000 células de Schwann por cada metro de axón, dispostas como unha ringleira de salchichas. O espazo que hai entre unha célula de Schwann e a seguinte denomínase nodo de Ranvier. O funcionamento do sistema nervioso dos vertebrados depende da vaíña de mielina para asegurar o illamento eléctrico e diminuír a capacitancia da membrana do axón. O potencial de acción salta dun nodo de Ranvier a outro, nun modo de propagación chamado condución saltatoria, o cal pode incrementar a velocidade de condución ata dez veces, sen que se teña que aumentar o diámetro do axón. Neste senso, as células de Schwann fan no sistema nervioso periférico unha función análoga á que fan os oligodendrocitos no sistema nervioso central. Porén, a diferenza dos oligodendrocitos, cada célula de Schwann mielinizante illa electricamente un só axón. Esta disposición das células permite a condución saltatoria dos potenciais de acción polos nodos de Ranvier. Deste modo, a mielinización incementa enormemente a velocidade de condución e aforra enerxía.[2]
Existen tamén células de Schwann non mielinizantes, que están implicaas no mantemento dos axóns e son básicas para a supervivencia neuronal. Algunhas agrúpanse arredor de pequenos axóns (Ver imaxe externa) e forman feixes de Remak.[3]

As células de Schwann mielinizantes dos mamíferos empezan a formar a vaíña de mielina durante o desenvolvemento fetal e actúan enrolándose en espiral arredor do axón, ás veces dando 100 voltas. Unha célula de Schwann ben desenvolvida ten a forma dunha folla de papel enrolada, con capas de mielina entre cada volta. As capas internas desta envoltura, que son predominantemente material da membrana celular, forman a vaíña de mielina, entanto que as capas máis externas do citoplasma nucleado forman o neurilema. Só un pequeno volume de citoplasma residual comunica as capas internas e externas, que nalgunhas zonas forma incisuras na mielina chamadas incisuras de Schmidt-Lanterman (ver debuxo da dereita).
Desde 2001 varios estudos experimentais implantaron células de Schwann intentando inducir a remielinización en casos de esclerose múltiple.[4] Nas últimas dúas décadas, moitos estudos demostraron resultados positivos e a posibilidade de utilizar o trasplante de células de Schwann como terapia para reparar danos na medula espiñal, axudando ao recrecemento e mielinación dos axóns danados no sistema nervioso central.[5] De feito, unha función ben coñecida das células de Schwann é a de axudar á rexeneración dos nervios.[6] Os nervios do sistema nervioso periférico conteñen xeralmente moitos axóns mielinizados polas células de Schwann. Se o nervio sofre danos, as células de Schwann axudan á dixestión de ditos axóns (fagocitose). Despois disto, as células de Schwann poden dirixir a rexeneración do nervio formando unha especie de túnel que guía o crecemento do nervio cara ás neuronas diana coas que se debe establecer a sinapse. O extremo roto do axón danado pode formar novas ramas, que medran seguindo o "túnel" formado polas células de Schwann a unha velocidade de aproximadamente 1mm/día en condicións axeitadas. O ritmo de rexeneración diminúe co tempo. Os axóns que realizan este proceso con éxito poden reconectar cos músculos ou órganos aos que eles se encargaban de controlar previamente grazas á axuda das células de Schwann; porén, a especificidade non sempre se mantén e son frecuentes os erros na reconexión, especialmente cando os órganos diana están a gran distancia.[7] Se ás células de Schwann se lles impide asociarse cos axóns, o axón morre. Os axóns rexenerados non poderán alcanzar ningunha diana se as células de Schwann non está alí para axudalos nesa tarefa, servindo como guías. Demostrouse que van por diante do cono de crecemento do axón. As células de Schwann son esenciais para manter os axóns sans. Producen diversos factores, como as neurotrofinas, e tamén transfiren a través dos axóns moléculas esenciais.
A liñaxe das células de Schwann
[editar | editar a fonte]As células de Schwann orixínanse na crista neural embrionaria. Durante o desenvolvemento embrionario do rato, células da crista neural diferéncianse primeiro en células precursoras das de Schwann e aproximadamente nos embrións de 12-13 días. Estas células precursoras diferéncianse posteriormente en células de Schwann inmaturas aproximadamente nos días 15-16 do desenvolvemento embrionario, e mantéñense así ata o necemento.
A evolución postnatal das células de Schwann inmaturas depende da súa asociación aleatoria cos axóns. Nun proceso denominado clasificación radial (radial sorting), por medio do cal as células de Schwann separan os axóns, as células de Schwann que casualmente se asocian cun axón de gran diámetro (>1 μm) diferéncianse en células de Schwann mielinizantes. Os axóns de pequeno diámetro quedan enterrados nas invaxinacións das células de Schwann non mielinizantes, tamén chamados feixes de Remak. Un regulador básico deste proceso é o sinal derivado dos axóns neurregulina-1, que se une aos receptores da superficie celular da célula de Schwann e promove a mielinización dos axóns de gran diámetro e clasifica os axóns de pequeno diámetro nos feixes de Remak, dependente da actividade do encima β-secretase BACE1 ([8][9][10][11][12]). Nas unións neuromusculares existe outra clase de células de Schwann non mielinizantes, chamadas células de Schwann terminais (ou perisinápticas), situadas en estreita proximidade da zona de sinapse neurona-músculo.
A transición de células de Schwann inmaturas a células de Schwann mielinizantes ou non mielinizantes é reversible. Cando o nervio está danado, as células de Schwann poden diferenciarse formando un tipo celular que lembra as células de Schwann inmaturas, a miúdo denominadas células de Schwann desnervadas ou desdiferenciadas. Isto permítelles volver a entrar no ciclo celular para proliferar e axudar á rexeneración dos nervios.[13]
Inmunorreactividade
[editar | editar a fonte]As diferentes clases de células de Schwann expresan marcadores antixénicos característicos que poden ser a diana de anticorpos. As células de Schwann mielinizantes poden observarse con técnicas inmunoquímicas usando anticorpos contra as proteínas S-100, proteína da mielina cero (P-0) e proteína básica da mielina (MBP). As células de Schwann non mielinizantes como as que forman os feixes de Remak e as células de Schwann terminais dan unha reacción positiva para a proteína S-100 e a proteína acídica fibrilar glial (GFAP).
Notas
[editar | editar a fonte]- ↑ María de Lourdes Eriksen Persson et al. Anatomia Humana Unidad I. Fasciculo 1. Generalidades de Anatomia. Google books. [1] NOTA: Actualmente os nomes epónimos, derivados de nomes de persoas, como "célula de Schwann" son desaconsellados en terminoloxía anatómica, aínda que seguen utilizándose con gran frecuencia.
- ↑ Kalat, James W. Biological Psychology, 9th ed. USA: Thompson Learning, 2007.
- ↑ "Medical Student Named Rhodes Scholar" Arquivado 24 de xullo de 2008 en Wayback Machine. - FOCUS - News from Harvard Medical, Dental and Public Health Schools - Copyright © 2010 President and Fellows of Harvard College.
- ↑ "First surgical transplant attempted to repair myelin - News - Brief Article". Inside MS. 2001. Arquivado dende o orixinal o 21 de setembro de 2008. Consultado o 11 de setembro de 2011.
- ↑ Oudega, Martin; Xu, Xiao-Ming (2006). "Schwann Cell Transplantation for Repair of the Adult Spinal Cord". Journal of Neurotrauma 23 (3–4). PMID 16629629. doi:10.1089/neu.2006.23.453.
- ↑ Bhatheja, Kanav; Field, Jeffrey (2006). "Schwann cells: Origins and role in axonal maintenance and regeneration". The International Journal of Biochemistry & Cell Biology 38 (12): 1995–9. doi:10.1016/j.biocel.2006.05.007.
- ↑ Carlson, Neil R. Physiology of Behavior, 9th ed. USA: Pearson Education, Inc., 2007.
- ↑ Garratt, A. N.; Voiculescu, O; Topilko, P; Charnay, P; Birchmeier, C (2000). "A Dual Role of erbB2 in Myelination and in Expansion of the Schwann Cell Precursor Pool". The Journal of Cell Biology 148 (5): 1035–46. PMC 2174554. PMID 10704452. doi:10.1083/jcb.148.5.1035.
- ↑ Michailov, G. V.; Sereda, MW; Brinkmann, BG; Fischer, TM; Haug, B; Birchmeier, C; Role, L; Lai, C; Schwab, MH (2004). "Axonal Neuregulin-1 Regulates Myelin Sheath Thickness". Science 304 (5671): 700–3. PMID 15044753. doi:10.1126/science.1095862.
- ↑ Taveggia, Carla; Zanazzi, George; Petrylak, Ashley; Yano, Hiroko; Rosenbluth, Jack; Einheber, Steven; Xu, Xiaorong; Esper, Raymond M.; Loeb, Jeffrey A. (2005). "Neuregulin-1 Type III Determines the Ensheathment Fate of Axons". Neuron 47 (5): 681–94. PMC 2387056. PMID 16129398. doi:10.1016/j.neuron.2005.08.017.
- ↑ Willem, M.; Garratt, A. N.; Novak, B.; Citron, M.; Kaufmann, S.; Rittger, A.; Destrooper, B.; Saftig, P.; Birchmeier, C. (2006). "Control of Peripheral Nerve Myelination by the -Secretase BACE1". Science 314 (5799): 664–6. PMID 16990514. doi:10.1126/science.1132341.
- ↑ Hu, Xiangyou; Hicks, Caitlin W; He, Wanxia; Wong, Philip; MacKlin, Wendy B; Trapp, Bruce D; Yan, Riqiang (2006). "Bace1 modulates myelination in the central and peripheral nervous system". Nature Neuroscience 9 (12): 1520–5. PMID 17099708. doi:10.1038/nn1797.
- ↑ Jessen, Kristjan R.; Mirsky, Rhona (2005). "The origin and development of glial cells in peripheral nerves". Nature Reviews Neuroscience 6 (9): 671–682. PMID 16136171. doi:10.1038/nrn1746.