Nodo de Ranvier
| Nodo de Ranvier | |
|---|---|
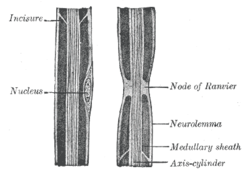 | |
| Debuxo dun axón dun nervio periférico ("axis cylinder"), no que se ve un nodo de Ranvier entre outras características | |
 | |
| Nodos de Ranvier | |
| Latín | incisura myelini |
Os nodos de Ranvier ou nódulos de Ranvier son as interrupcións (de aproximadamente 1 micrómetro de lonxitude) que aparecen a intervalos regulares na vaíña de mielina dos axóns das neuronas. A vaíña de mielina é un recubrimento de moitas capas, composto principalmente por unha substancia graxa chamada mielina, que envolve os axóns, illándoos eficazmente. Nos nodos de Ranvier, a membrana do axón non ten este illamento e deste modo pode xerar actividade eléctrica, polo que os nodos de Ranvier son moi importantes na transmisión do impulso nervioso de tipo saltatorio. Descubriunos o patólogo e anatomista francés Louis-Antoine Ranvier (1835-1922).
Introdución[editar | editar a fonte]
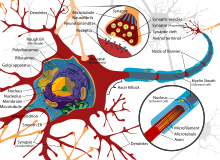
| Estrutura dunha neurona típica |
|---|
Moitos axóns de vertebrados están cubertos por unha vaíña de mielina que permite unha rápida e eficiente condución saltatoria dos potenciais de acción durante a transmisión do impulso nervioso. Os contactos entre as neuronas e as células gliais presentan un alto nivel de organización espacial e temporal nas fibras mielinizadas. As células da glía mielinizadas, que son os oligodendrocitos no sistema nervioso central e as células de Schwann no sistema nervioso periférico, enrólanse arredor dos axóns, envolvéndoos, pero deixando o axolema (membrana do axón) relativamente descuberto a intervalos regulares, orixinando alí os nodos de Ranvier.
Cómpre distinguir entre rexións internodais (entre os nodos de Ranvier) e os bucles paranodais (arredor dos nodos). As membranas gliais internodais están fusionadas formando mielina compacta, mentres que os bucles paranodais cheos de citoplasma das células mielinizantes están enroladas en espiral arredor do axón a ambos os lados dos nodos. Esta organización demanda un estreito control no seu desenvolvemento e a formación de diversas zonas especializadas de contacto entre as distintas áreas da membrana plasmática mielinizante. Cada nodo de Ranvier está flanqueado por rexións paranodais nas que bucles gliais enrolados helicoidalmente están unidos á membrana do axón por unha unión celular de tipo septado. O segmento situado entre os nodos de Ranvier denomínase internodo, e a súa parte máis externa, que está en contacto cos paranodos, denomínase rexión xustaparanodal. Os nodos están encapsulados por microvilli que saen da parte externa da membrana das células de Schwann no sistema nervioso periférico, ou por extensións perinodais dos astrocitos no sistema nervioso central.
Composición molecular e estrutural[editar | editar a fonte]

Estrutura[editar | editar a fonte]
Os nodos son os espazos non recubertos situados entre os segmentos con mielina chamados internodos. O tamaño e o espazado dos internodos varía co diámetro da fibra nunha relación optimizada para que se produza unha velocidade de condución máxima.[1] O tamaño dos nodos é duns 1–2 µm e o dos internodos adoita ter un par de micrómetros máis, dependendo do diámetro do axón e o tipo de fibra. A estrutura do nodo e das rexións paranodais que o flanquean son diferentes dos internodos cubertos de vaíña de mielina compacta, pero son moi similares nos sistemas nerviosos central e periférico. O axón está exposto ao ambiente extracelular no nodo e o seu diámetro está reducido. O tamaño diminuído do axón reflicte unha maior densidade de empaquetamento dos neurofilamentos nesta rexión, os cales están menos fosforilados e son transportados máis lentamente.[1] Nos nodos hai maior cantidade de vesículas e outros orgánulos, o cal suxire que hai un pescozo de botella no transporte no axón en ambas as direccións e sinalización local axonal-glial. Cando se fai un corte lonxitudinal a través dunha célula de Schwann mielinizante nun nodo, obsérvanse tres segmentos distintivos: o internodo, a rexión paranodal, e o nodo propiamente dito. Na rexión internodal, a célula de Schwann ten un anel externo de citoplasma, unha vaíña de mielina compacta, e un anel interno de citoplasma, e o axolema. Nas rexións paranodais, os bucles de citoplasma paranodal contactan con engrosamentos do axolema para formar alí unións de tipo septado. No nodo, o axolema está en contacto con varios microvilli das células de Schwann e contén unha capa citoesquelética densa.
Diferenzas estruturais entre nodos nos sistemas nerviosos central e periférico[editar | editar a fonte]
Aínda que os estudos de criofractura revelaron que o axolema nodal tanto no sistema nervioso central coma no periférico está enriquecido en partículas intramembranosas comparado co dos internodos, hai algunhas diferenzas estruturais que reflicten os seus constituíntes celulares.[1] No sistema nervioso periférico, proxéctanse microvilli especializados desde o anel citoplasmático externo das células de Schwann e aproxímanse moito ao axolema nodal das fibras grandes. As proxeccións das células de Schwann son perpendiculares aos nodos e irradian desde os axóns centrais. Porén, no sistema nervioso central, os que se aproximan aos nodos son un ou varios dos procesos dos astrocitos. Os investigadores atoparon que estes procesos nacen de astrocitos multifuncionais, que son diferentes da poboación de astrocitos dedicados a contactar co nodo. Por outra parte, no sistema nervioso periférico, a lámina basal que rodea as células de Schwann é continua arredor do nodo.
Composición[editar | editar a fonte]
Os nodos de Ranvier conteñen ATPases de Na+/K+, intercambiadores de Na+/Ca2+ e unha gran densidade de canles de Na+ reguladas por voltaxe, que xeran potenciais de acción. Unha canle de sodio consiste nunha subunidade α formadora do poro e dúas subunidades β accesorias, as cales ancoran a canle a compoñentes extracelulare e intracelulares. Os nodos de Ranvier de todo o sistema nervioso conteñen principalmente as subunidades αNaV1.6 e β1.[2] A rexión extracelular das subunidades β pode asociarse consigo mesma e con outras proteínas, como a tenascina-R e as moléculas de adhesión celular neurofascina e contactina. A contactina está tamén presente nos nodos no sistema nervioso central e a interacción con esta molécula potencia a expresión na superficie das canles de Na+. A anquirina únese á espectrina βIV, unha isoforma de espectrina abundante nos nodos de Ranvier e nos segmentos iniciais dos axóns. O sistema nervioso periférico está rodeado polos microvilli das células de Schwann, que conteñen as moléculas ERMs e EBP50, que poden proporcionar unha conexión con microfilamentos de actina. Nos nodos de Ranvier abundan varias proteínas da matriz extracelular, como a tenascina-R, Bral-1, e o proteoglicano NG2, e tamén fosfacán e versicán V2. Nos nodos do sistema nervioso central, entre as proteínas do axón está tamén a contactina; porén, os microvilli das células de Schwann son aquí substituídos polas extensións dos astrocitos perinodais.
Organización molecular[editar | editar a fonte]
A organización molecular dos nodos está especializada na súa función de propagar o impulso nervioso. O nivel das canles de sodio no nodo comparado co dos internodos suxire que o número de partículas intramembrana observadas corresponde a canles de sodio. As canles de potasio están ausentes do axolema nodal, pero están moi concentrados no axolema paranodal e nas membranas das células de Schwann situadas no nodo.[1] A función exacta das canles de potasio non se coñece aínda ben, pero sábese que poden contribuír á rápida repolarización dos potenciais de acción ou xogar un papel vital en tamponar os ións potasio nos nodos. Esta distribución moi asimétrica das canles de sodio e potasio regulados por voltaxe contrasta coa súa difusa distribución nas fibras non mielinizadas.[1][3]
A rede de filamentos que están debaixo da membrana nodal contén proteínas citoesqueléticas chamadas espectrina e anquirina. A alta densidade de anquirina nos nodos pode ser funcionalmente significativa porque varias das proteínas que se encontran nos nodos comparten a capacidade de poder unirse á anquirina cunha afinidade extremadamente alta. O segmento inicial do axón está enriquecido en todas estas proteínas, incluída a anquirina, o que suxire unha relación funcional. Porén, descoñécese a relación destes compoñentes moleculares coa agrupación de canles de sodio nos nodos. Aínda que hai datos contraditorios dalgunhas moléculas de adhesión celular, doutras tense a certeza de que son moi comúns nas membranas gliais das rexións paranodais, onde contribúen á súa organización e integridade estrutural.
Desenvolvemento dos nodos de Ranvier[editar | editar a fonte]
Mielinización das fibras nerviosas[editar | editar a fonte]
Os complexos cambios que sofre unha célula de Schwann durante o proceso de mielinización de fibras dos nervios periféricos foron moi estudados. A envoltura inicial do axón orixínase sen interrupción en toda a extensión da célula de Schwann. Este proceso está secuenciado polo pregamento da superficie da célula de Schwann para que se forme unha dobre membrana das caras opostas da superficie pregada da célula de Schwann. Esta membrana esténdense e envólvese en espiral sobre si mesma moitas veces mentres continúa o pregamento da superficie da célula de Schwann. Como resultado, pode determinarse facilmente o incremento en grosor da extensión da vaíña de mielina en sección transversal. É tamén evidente que cada unha das voltas da espiral aumenta en tamaño no axón a medida que o número de voltas se incrementa. Porén, non está claro se o incremento da lonxitude da vaíña de mielina pode depender só do incremento en lonxitude do axón cuberto por cada volta sucesiva da espiral, como se explicou previamente. Na unión de dúas células de Schwann ao longo dun axón, as direccións da parte lamelar sobresaínte das terminacións de mielina teñen sentido oposto.[4] Esta unión, adxacente ás células de Schwann, constitúe a rexión designada como nodo de Ranvier.
Primeiras fases do desenvolvemento[editar | editar a fonte]
Comprobouse que no desenvolvemento do sistema nervioso periférico exprésase inicialmente a molécula Nav1.2 en todos os nodos de Ranvier en formación.[5] Coa maduración, a expresión de Nav1.3 nos nodos diminúe e é substituída por Nav1.6. Tamén se expresa Naz1.2 durante a formación de nodos no sistema nervioso periférico, o cal suxire que o cambio de subtipos de canles Nav é un fenómeno xeral nos sistemas nerviosos central e periférico. Comprobouse tamén que Nav1.6 e Nav1.2 aparecen xuntas en moitos nodos de Ranvier durante a mielinización temperá. Isto tamén suxire que os agrupamentos temperás de canles Nav1.2 e Nav1.6 están destinados a converterse en nodos de Ranvier. A neurofascina é unha das primeiras proteínas que se acumulan nos nodos de Ranvier de nova formación, e encontrouse que proporciona o sitio de nucleación para a unión da anquirina G, as canles Nav, e outras proteínas.[6] A identificación recente da proteína gliomedina dos microvilli das células de Schwann como unha probable molécula de unión para a neurofascina do axón é unha proba da importancia desta proteína no recrutamento das canles Nav nos nodos de Ranvier. Ademais, Lambert et al. e Eshed et al. tamén indican que a neurofascina acumula antes as canles Nav e seguramente ten papeis fundamentais nos eventos máis iniciais asociados coa formación dos nodos de Ranvier. Así, poden existir múltiples mecanismos que traballen sinerxicamente para faciliatar o agrupamento das canles Nav nos nodos de Ranvier.
Formación dos nodos[editar | editar a fonte]
O primeiro que ocorre parece ser a acumulación de moléculas de adhesión celular como NF186 ou NrCAM. As rexións intracelulares destas moléculas de adhesión celular interaccionan coa anquirina G, a cal serve como áncora para as canles de sodio. Ao mesmo tempo, a extensión periaxonal da célula glial envólvese arredor do axón, dando lugar ás rexións paranodais. Este movemento ao longo do axón contribúe significativamente á formación dos nodos de Ranvier ao permitir a formación de heminodos nas beiras das células gliais veciñas para que se fusionen formando nodos completos. As unións de tipo septado fórmanse nos paranodos co enriquecemento en NF155 nos bucles paranodais gliais. Inmediatamente despois da diferenciación temperá das rexións nodal e paranodal, acumúlanse canles de potasio, Caspr2 e TAG1 nas rexións xustaparanodais. Esta acumulación coincide directamente coa formación de mielina compacta. Nas rexións nodais maduras, as interaccións coas proteínas intracelulares parecen ser vitais para a estabilidade de todas as rexións nodais. No sistema nervioso central, os oligodendrocitos non posúen microvilli, pero parecen poder iniciar o agrupamento dalgunhas proteínas do axón por medio de factores segregados. Os efectos combinados de ditos factores cos posteriores movementos xerados polo envolvemento das extensións periaxonais dos oligodendrocitos poderían explicar a organización dos nodos de Ranvier do sistema nervioso central.
Regulación da formación[editar | editar a fonte]
Regulación do paranodo por medio da acumulación de mitocondrias[editar | editar a fonte]
As mitocondrias e outros orgánulos membranosos son normalmente máis abondosos na rexión PNP (paranodo-nodo-paranodo) dos axóns mielínicos periféricos, especialmente nos axóns de gran calibre.[7] O papel fisiolóxico real desta acumulación e dos factores que o regulan non se comprende de todo; porén, sábese que as mitocondrias están normalmente presentes en áreas da célula onde hai unha gran demanda de enerxía. Nestas mesmas rexións hai tamén conos de crecemento, terminais sinápticas, e sitios de iniciación e rexeneración do potencial de acción, como os nodos de Ranvier. Nos terminais sinápticos, as mitocondrias producen o ATP que se precisa para mobilizar as vesículas para a neurotransmisión. Nos nodos de Ranvier, as mitocondrias desempeñan un importante papel na condución do impulso nervioso ao produciren o ATP que cómpre para manter a actividade de elevado gasto enerxético das bombas de ións. Apoia esta idea o feito de que hai cinco veces máis mitocondrias no axoplasma do PNP dos axóns periféricos grandes ca na rexións internodais correspondentes desas mesmas fibras.[7]
Regulación nodal por medio da espectrina αII[editar | editar a fonte]
A condución saltatoria nos axóns mielinizados require a organización dos nodos de Ranvier, e as canles de sodio regulados por voltaxe deben ser moi numerosos. Diversos estudos mostran que a espectrina αII, que é un compoñente do citoesqueleto, é máis abundante nos nodos e paranodos nos primeiros estadios, pero a medida que os nodos maduran a expresión desta molécula desaparece.[8] Comprobouse tamén que a espectrina αII do citoesqueleto axonal é absolutamente vital para que se establezan as agrupacións de canles de sodio e organizar o nodo de Ranvier maduro.
Regulación nodal por medio do recoñecemento da molécula OMgp[editar | editar a fonte]
Identificouse in-vivo e in-vitro que a OMgp nodal deriva dos oligodendrocitos e/ou células similares. Ademais, tamén se comprobou as OMgp se agrupan nos nodos de Ranvier. O agrupamento de OMgp durante o desenvolvemento posnatal está asociado e depende da mielinización. A OMgp parece regular a expresión de canles de sodio e as funcións electrofisiolóxicas do axón. Tamén regula a mielinización e a formación nodal nos estadios posnatais. Hai evidencias de que a OMgp se acumula nos nodos de Ranvier dos axóns mielínicos no sistema nervioso central, o cal apoia a idea de que a OMgp é unha molécula nodal. Durante os estadios iniciais da interacción axónica-glial, a expresión de OMgp e o seu agrupamento están relacionados co proceso de mielinización. Por outra parte, en modelos animais desmielinizados, a distribución de OMgp é ectópica e dispersa en lugar de agrupada nos nodos de Ranvier. Esta observación suxire que a acumulación de OMgp nos nodos podería depender da integridade da mielina e a polarización axonal subcelular. A OMgp non se detecta en todos os nodos e é indetectable nun subgrupo de axóns máis pequenos. Porén, parece haber unha relación proporcional entre a acumulación de OMgp e o diámetro do axón. Isto indica que un cambio na concentración de OMgp pode ter un grande impacto nunha subpoboación de axóns.
Funcións dos nodos de Ranvier[editar | editar a fonte]
Potencial de acción[editar | editar a fonte]
Un potencial de acción é un pico de descarga iónica positiva ou negativa que viaxa ao longo da membrana da célula.[9] A creación e condución de potenciais de acción é un modo fundamental de comunicación no sistema nervioso. Os potenciais de acción supoñen rápidas inversións de voltaxe a través da membrana plasmática dos axóns. Estas rápidas inversións son mediadas por canles iónicas regulados por voltaxe que se encontran na membrana. O potencial de acción viaxa dun lugar da célula a outro, pero o fluxo iónico a través da membrana ocorre só nos nodos de Ranvier. Como resultado, o sinal do potencial de acción salta ao longo do axón, dun nodo a outro, en vez de propagarse progresivamente, como ocorre nos axóns que non teñen vaíña de mielina. A agrupación de canles iónicas de sodio e potasio regulados por voltaxe nos nodos é o que permite este tipo de propagación.
Condución saltatoria[editar | editar a fonte]
Como un axón pode ser de tipo mielínico ou amielínico, o potencial de acción ten dous métodos de viaxar ao longo do axón. Estes métodos denomínanse condución do potencial de acción por axóns amielínicos, e condución saltatoria por axóns mielínicos. A condución saltatoria defínese como o un potencial de acción que se move en saltos discretos ao longo do axón mielinizado.
Este proceso consiste en que a carga se estende pasivamente ao seguinte nodo de Ranvier para despolarizalo ata o limiar que desencadeará despois un potencial de acción nesta rexión, o cal despois se estenderá pasivamente ao seguinte nodo, e así sucesivamente.
A condución saltatoria proporciona unha vantaxe sobre a condución continua ao longo do axón amielínico, que consiste no incremento na rapidez de condución, que asegura unha interacción máis rápida entre as neuronas. Por outra parte, dependendo da taxa de disparo media de impulsos dunha neurona, os cálculos mostran que o custo enerxético de manter o potencial de repouso dos oligodendrocitos pode ser superior ao aforro de enerxía nos potenciais de acción.[10] Isto indicaría que a mielinización dos axóns non necesariamente aforra enerxía.
Historia[editar | editar a fonte]

A vaíña de mielina dos nervios longos descubriuna e bautizouna o patólogo e anatomista alemán Rudolf Virchow[11] en 1854.[12] O patólogo e anatomista francés Louis-Antoine Ranvier descubriu despois os nodos na vaíña de mielina que levan o seu nome. Ranvier foi un dos histólogos máis importantes do final do século XIX e as súas observacións sobre os nodos das fibras nerviosas e a dexeneración e rexeneración de fibras seccionadas tiveron grande influencia na neuroloxía francesa do seu tempo. Ranvier abandonou os estudos patolóxicos en 1867 e fíxose axudante de Claude Bernard. Pouco despois descubriu os nodos das fibras nerviosas. Fixo tamén estudos detallados das vaíñas de mielina e das células de Schwann.[13]
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 1,2 1,3 1,4 Salzer J. L. (1997). "Clustering sodium channels at the node of Ranvier: close encounters of the axon-glia kind". Neuron 18 (6): 843–846. PMID 9208851. doi:10.1016/S0896-6273(00)80323-2. Arquivado dende o orixinal o 18 de decembro de 2007. Consultado o 06 de outubro de 2012.
- ↑ Kaplan, Miriam R.; Cho, Min-Hee; Ullian, Erik M.; Isom, Lori L.; Levinson, S. Rock; Barres, Ben A. (2001-04-01). "Differential Control of Clustering of the Sodium Channels Nav1.2 and Nav1.6 at Developing CNS Nodes of Ranvier". Neuron (en English) 30 (1): 105–119. ISSN 0896-6273. PMID 11343648. doi:10.1016/S0896-6273(01)00266-5.
- ↑ Black, J.A., Sontheimer, H., Oh, Y., and Waxman, S.G. (1995). In The Axon, S. Waxman, J. Kocsis, and P. Stys, eds. Oxford University Press, New York, pp. 116–143.
- ↑ Uzmman B. G., Nogueira-Graf G. (1957). "Electron microscope studies of the formation of nodes of Ranvier in mouse sciatic nerves". Journal of Biophysical and Biochemical Cytology 3 (4): 589–597. PMC 2224104. PMID 13449102. doi:10.1083/jcb.3.4.589.
- ↑ Boiko, Tatiana; Rasband, Matthew N.; Levinson, S.Rock; Caldwell, John H.; Mandel, Gail; Trimmer, James S.; Matthews, Gary (2001-04). "Compact Myelin Dictates the Differential Targeting of Two Sodium Channel Isoforms in the Same Axon". Neuron (en inglés) 30 (1): 91–104. doi:10.1016/S0896-6273(01)00265-3.
- ↑ Lambert S, Davis JQ, Bennett V (1997). "Morphogenesis of the node of Ranvier: co-clusters of ankyrin and ankyrin-binding integral proteins define early developmental intermediates". Journal of Neuroscience 17 (18): 7025–7036. PMID 9278538.
- ↑ 7,0 7,1 Einheber S, Bhat MA, Salzer JL (2006). "Disrupted Axo-Glial Junctions Result in Accumulation of Abnormal Mitochondria at Nodes of Ranvier". Neuron Glia Biology 2 (3): 165–174. PMC 1855224. PMID 17460780. doi:10.1017/S1740925X06000275.
- ↑ Voas MG, Lyons DA, Naylor SG, Arana N, Rasband MN, Talbot WS (2007). "alphaII-spectrin is essential for assembly of the nodes of Ranvier in myelinated axons". Current Biology 17 (6): 562–8. PMID 17331725. doi:10.1016/j.cub.2007.01.071.
- ↑ Fry, C (2007). "Cell physiology I". Surgery (Oxford) 25: 425–429. doi:10.1016/j.mpsur.2007.07.007.
- ↑ Harris; Atwood (2012). "The Energetics of CNS White Matter". Journal of Neuroscience. doi:10.1523/JNEUROSCI.3430-11.2012.
- ↑ WhoNamedIt|synd|3816
- ↑ Virchow R (1854). "Über das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben". Virchows Arch. Pathol. Anat. 6: 562–572.
- ↑ Barbara J.G. (2005). "Les étranglements annulaires de Louis Ranvier (1871)" (PDF). Lettre des Neurosciences 28: 3–5.

