Fosfonato
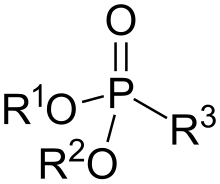
Os fosfonatos ou ácidos fosfónicos son compostos organofosforados que conteñen os grupos C-PO(OH)2 ou C-PO(OR)2 (onde R=alquilo, arilo). Os ácidos fosfónicos e sales fosfonatos son tipicamente sólidos brancos, non volátiles que son pouco solubles en solventes orgánicos, pero solubles en auga e alcohois comúns. Moitos compostos importantes comercialmente son fosfonatos, e entre eles está o herbicida glifosato, e o Ethephon, que é un regulador do crecemento das plantas moi usado. Os bisfosfonatos son fármacos comúns para o tratamento da osteoporose.[1] O ácido 2-aminoetilfosfónico é o único fosfonato atopado de orixe natural.
Propiedades básicas
[editar | editar a fonte]Os fosfonatos presentan centros de fósforo tetraédricos. Están moi relacionados estruturalmente co ácido fosforoso e xeralmente prepáranse a partir del.[2]

Os sales fosfonatos son o resultado da desprotonación de ácidos fosfónicos, que son ácidos dipróticos:
- RPO(OH)2 + NaOH → H2O + RPO(OH)(ONa) (fosfonato monosódico)
- RPO(OH)(ONa) + NaOH → H2O + RPO(ONa)2 (fosfonato monosódico)
Os ésteres fosfonato son o resultado da condensación de ácidos fosfónicos con alcohois.
Produción
[editar | editar a fonte]Hai varios métodos de produción para a preparación de ácidos fosfónicos e os seus sales. A maioría dos procesos empezan polo ácido fosforoso (H3PO3), aproveitando o seu enlace P-H moi reactivo.[1][2]
O ácido fosfónico pode alquilarse nas condicións da reacción de Mannich para dar lugar a fosfonatos aminometilados, que son útiles como acomplexantes. Un exemplo é a preparación industrial de ácido nitrilotrismetilenfosfónico:
- NH3 + 3 H3PO3 + 3 CH2O → N(CH2PO3H2)3 + 3 H2O
O ácido fosfónico tamén pode ser alquilado con derivados do ácido acrílico para producir ácidos fosfónicos funcionalizados con carboxilo. Esta reacción é unha variante da adición de Michael:
- CH2=CHCO2R + 3 H3PO3 → (HO)2P(O)CH2CH2CO2R
Os ésteres fosfónicos prepáranse usando a reacción de Michaelis–Arbuzov. Por exemplo, o ioduro de metilo cataliza a conversión de trimetilfosfito ao éster fosfonato dimetil metilfosfonato:
- P(OMe)3 → MePO(OMe)2
Estes ésteres poden ser hidrolizados ao ácido (Me = metilo):
- MePO(OMe)2 + H2O → MePO(OH)2 + 2 MeOH
Na reacción de Michaelis–Becker, un hidróxeno fosfonato diéster desprotónase primeiro e o anión resultante é alquilado.
Bisfosfonatos
[editar | editar a fonte]Os bisfosfonatos sintetizáronos por primeira vez Von Baeyer e Fritz Hofmann en 1897. Un exemplo deste tipo de compostos é o ácido etidrónico (HEDP, ou Didronel), que é o ácido 1-hidroxietano-1,1-difosfónico, o cal se prepara a partir de ácido fosforoso e anhídrido acético:[1]
- 2 H3PO3 + (CH3CO)2O → CH3C(OH)(PO3H2)2 + CH3CO2H
Os fosfonatos na natureza
[editar | editar a fonte]

O fosfonato natural ácido 2-aminoetilfosfónico foi identificado en 1959 en plantas e moitos animais, onde se localiza nas membranas celulares. Os fosfonatos son bastante comúns en diferentes organismos, desde procariotas a fungos, moluscos, insectos e outros. Newman e Tate atopáronos en solos naturais en 1980. Do papel biolóxico dos fosfonatos naturais sábese pouco. Os bis ou polifosfonatos non se atoparon ata agora en fontes naturais.
Usos
[editar | editar a fonte]En 1998 o consumo de fosfonatos no mundo foi de 56.000 toneladas, das cales 40.000 se consumiron nos Estados Unidos, 15.000 toneladas en Europa e menos de 800 no Xapón. A demanda de fosfonatos crece un 3% cada ano.
Quelantes de metais
[editar | editar a fonte]Desde os traballo de Schwarzenbach en 1949, sábese que os ácidos fosfónicos son axentes quelantes efectivos. A introdución dun grupo amina na molécula para obter -NH2-C-PO(OH)2 incrementa a capacidade de unirse a metais dos fosfonatos. Exemplos de ditos compostos son: NTMP, EDTMP e DTPMP. Estes fosfonatos son os análogos estruturais de aminopolicarboxilatos ben coñecidos como o EDTA. A estabilidade dos complexos metálicos aumenta ao incrementarse o número de grupos ácido fosfónico. Os fosfonatos son moi hidrosolubles mentres que os ácidos fosfónicos só o son moderadamente.
Os fosfonatos son axentes quelantes efectivos, xa que se unen fortemente a ións metálicos di- e trivalentes, o cal é útil para o abrandamento da auga (eliminación de calcio, magnesio e outros catións). Deste modo, preveñen a formación de precipitados insolubles (incrustacións). A unión destes ligandos tamén suprime as propiedades catalíticas dos ións metálicos. Son estables en condicións duras. Por estas razóns un uso industrial importante dos fosfonatos é o arrefriamento de augas, sistemas de desalinización, e en campos petrolíferos para inhibir a formación de incrustacións. Os fosfonatos son tamén utilizados con regularidade en sistemas de osmose inversa como antiincrustantes. Os fosfonatos en sistemas de arrefriamento de augas serven tamén para controlar a corrosión do ferro e o aceiro. Na fabricación de papel e polpa de papel e na industria téxtil serven como "estabilizadores do branqueante peróxido", ao quelar metais que poderían inactivar o peróxido. Nos deterxentes utilízanse como unha combinación de axente quelante, inhibidor de incrustacións, e estabilizador do branqueante. Os fosfonatos úsanse cada vez máis tamén en medicina para tratar trastornos asociados coa formación dos ósos e o metabolismo do calcio. Ademais, serven como transportadores de radionúclidos nos tratamentos de cancro óseo (por exemplo, o samario-153-etilendiaminatetrametilenfosfonato).
Usos en síntese orgánica
[editar | editar a fonte]En síntese orgánica, os fosfonatos utilízanse na reacción de Horner-Wadsworth-Emmons. En conxunción con organosilicatos, os fosfonatos utilízanse tamén no tratamento de pragas que afectan aos carballos causadas polo eucariota de bioloxía similar a un fungo Phytophthora ramorum.
Toxicidade
[editar | editar a fonte]A toxicidade dos fosfonatos para os organismos acuáticos é baixa. Informouse de valores LC50 48 h para peixes de entre 0,1 e 1,1 mM. Tamén o factor de bioconcentration para os peixes é moi baixo.
Biodegradación
[editar | editar a fonte]Na natureza as bacterias xogan o principal papel na degradación dos fosfonatos.[3] Debido á presenza de fosfonatos naturais no medio ambiente, nas bacterias evolucionou a capacidade de metabolizar os fosfonatos como fontes de nutrientes. Algunhas bacterias usan os fosfonatos como fonte de crecemento. Os aminofosfonatos poden tamén utilizarse como única fonte de nitróxeno por algunhas bacterias. Os fosfonatos utilizados na industria difiren grandemente das fontes naturais como o ácido 2-aminoetilfosfónico, porque son moléculas moito máis grandes, levan unha carga negativa alta e están acomplexados con metais. Nas probas de biodegradación con lodos de plantas de tratamento de augas residuais urbanas con HEDP e NTMP non se observou ningunha degradación. Unha investigación sobre HEDP, NTMP, EDTMP e DTPMP en probas de biodegradación estándar tampouco atopou que houbese biodegradación. Porén, indicouse que nalgunhas probas debido á alta proporción lodo/fosfonato, observouse unha eliminación da substancia da proba da solución detectada como perda de DOC (carbono orgánico disolto). Este factor foi atribuído á adsorción en vez de á biodegradación. Non obstante, illáronse dos solos, lagos, auga residual, lodos activados e compost cepas bacterianas con capacidade de degradar aminopolifosfonatos e HEDP baixo condicións limitadas en P.
"Non se observa biodegradación de fosfonatos durante o tratamento das augas pero a fotodegradación de complexos de Fe(III) é rápida. En augas residuais detectouse que os aminopolifosfonatos son tamén oxidados rapidamente en presenza de Mn(II) e oxíxeno e fórmanse produtos de degradación estables. A falta de información sobre os fosfonatos no medio ambiente está ligada con problemas analíticos para a súa determinación a concentracións traza nas augas naturais. Os fosfonatos están presentes principalmente como complexos con Ca e Mg nas augas naturais e, por tanto, non afectan á especiación ou transporte de metais".[4] Os fosfonatos interaccionan fortemente con algunhas superficies, o cal dá lugar a unha significativa eliminación en sistemas naturais e técnicos.
Compostos fosfonato
[editar | editar a fonte]
- AEPn: Ácido aminometilfosfónico, produto de degradación do herbicida "Roundup" (glifosato).
- DMMP: Dimetil metilfosfonato, un dos fosfonato diésteres máis simples.
- HEDP: Ácido 1-hidroxietilideno-1,1-difosfónico, usado en deterxentes, tratamento de augas, cosmética e farmacéutica.
- ATMP: Ácido aminotrismetilenfosfónico, axente quelante.
- EDTMP: Ácido etilenodiaminotetrametilenfosfónico, axente quelante.
- TDTMP: Ácido tetrametilenodiaminotetrametilenfosfónico, axente quelante.
- HDTMP: Ácido hexametilendiaminotetrametilenfosfónico, axente quelante.
- DTPMP: Ácido dietilentriaminopentametilenfosfónico, axente quelante.
- PBTC: Ácido fosfonobutano-tricarboxílico.
- PMIDA: Ácido N-(fosfonometil)iminodiacético.
- CEPA: Ácido 2-carboxietil fosfónico.
- HPAA: Ácido 2-hidroxifosfonocarboxílico.
- AMP: Ácido amino-tris-metilenfosfónico.
- BPMG: N,N-Bis(fosfonometil)glicina.
- Glifosato, herbicida chamado "Roundup".
- Foscarnet, para o tratamento do herpes.
- Perzinfotel, para o tratamento da apoplexía.
- Ácido di-(2-etilhexil)fosfórico, extractor de uranio.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 Svara, J.; Weferling, N.; Hofmann, T. "Phosphorus Compounds, Organic," In 'Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2008. doi 10.1002/14356007.a19_545.pub2.
- ↑ 2,0 2,1 Modern Phosphonate Chemistry By Philippe Savignac and Bogdan Iorga, CRC Press, Boca Raton, FL. 2003. ISBN 0-8493-1099-7.
- ↑ Huang J, Su Z, Xu Y (2005). "The evolution of microbial phosphonate degradative pathways". Journal of Molecular Evolution 61 (5): 682–90. PMID 16245012. doi:10.1007/s00239-004-0349-4.
- ↑ Nowack, Bernd "Environmental chemistry of phosphonates" Water Research 2003, vol. 37, p 2533-2546 .doi 10.1016/S0043-1354(03)00079-4
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Organofosforados
- Óxido de fosfina - OPR3
- Fosfinito - P(OR)R2
- Fosfonito - P(OR)2R
- Fosfito - P(OR)3
- Fosfinato - OP(OR)R2
- Fosfato - OP(OR)3
Bibliografía
[editar | editar a fonte]- Newman, R.H., and K.R. Tate. 1980. Soil characterized by 31P nuclear magnetic resonance* Communications in Soil Science and Plant Analysis11:835-842.
- Abhimanyu S. Paraskar and Arumugam Sudalai (2006). "A novel Cu(OTf)2 mediated three component high yield synthesis of α-aminophosphonates" (PDF). Arkivoc (1838EP): 183–9.
- Singh R, Nolan SP (2005). "Synthesis of phosphorus esters by transesterification mediated by N-heterocyclic carbenes (NHCs)". Chemical Communications (43): 5456–8. PMID 16261245. doi:10.1039/b509783e.
