Telofase

Telofase ou telocinese[1] (do grego; τέλος (telos), "fin" + φάσις (fase), "etapa" ; "Fase final") é a etapa final tanto na meiose como na mitose, despois do proceso de anafase, dunha célula eucariota.
Durante a telofase, os efectos da profase e da prometafase invírtense (cando o núcleo e a membrana nuclear se desintegran). A medida que os cromosomas chegan aos polos das células, créase unha membrana nuclear arredor de cada conxunto de cromátidas, os nucléolos reaparecen e os cromosomas comezan a descondensarse para formar a cromatina que está presente na interfase. Desfaise o fuso acromático e despolimerízanse os eixes dos microtúbulos.
A citocinese comeza antes da telofase tardía e, cando se completa, segrega os dous núcleos fillos entre un par de células fillas separadas.[2]
A telofase baséase principalmente na desfosforilación de substratos de quinases dependentes de ciclina (Cdk).[2]
A telofase representa aproximadamente o 2 % do tempo do ciclo celular. Unha vez completada a telofase, a mitose está completa e a célula entra no período de interfase.
Mitose
[editar | editar a fonte]Durante esta fase:
- cromosomas que se descondensan sen microtúbulos cinetocoros;
- os microtúbulos polares deixan o seu alongamento;
- fórmase de novo a membrana nuclear para crear dous novos núcleos;
A última fase da telofase chámase citodierese. É a separación da célula nai en dúas células fillas. Nas células animais, un surco de división separa a célula en dúas, baixo a acción dun anel contráctil intracelular formado por microfilamentos de actina que se unen ás moléculas de miosina. A actina e a miosina son dúas das moléculas responsábeis da contracción muscular. O anel contráctil fórmase pola contracción da miosina e a actina. É esta contracción a que diminuirá o tamaño do anel e, polo tanto, fará que a célula se separe en dúas células. Os microtúbulos astrais, que xogan un papel importante na formación do plano ecuatorial, inflúen na localización do suco divisorio.
Meiose
[editar | editar a fonte]Durante a meiose ocorren dous procesos de división do núcleo, a meiose I (dividida en profase I, metafase I, anafase I e telofase I) e meiose II (dividida en profase II, metafase II, anafase II e telofase II).
- A telofase I é semellante á telofase da mitose.
- Durante a telofase II :
- a membrana nuclear fórmase arredor dos cromosomas individuais;
- o surco de división separa a célula en dúas, polo que se forman dúas células haploides con n cromosomas
Desfosforilación de substratos de Cdk
[editar | editar a fonte]A fosforilación das dianas da proteína M-Cdk ( quinase dependente da ciclina da mitose) ten como resultado a formación de fusos acromáticos, a condensación de cromosomas e a descomposición da membrana nuclear ao comezo da mitose. A desfosforilación destes mesmos substratos produce a desmontaxe dos fusos, a descondensación dos cromosomas e a reconstrución dos núcleos fillos durante a telofase. O establecemento dun grao de desfosforilación admisible para eventos de telofase require tanto a inactivación dos substratos de Cdk como a activación das fosfatases.
A inactivación de Cdk é principalmente o resultado da destrución da súa ciclina asociada. As ciclinas teñen como obxectivo a degradación proteolítica polo complexo promotor de anafase (APC/C), tamén coñecido como ciclosoma,[3] unha ubiquitina-ligase. O complexo proteico APC - CDC20 (APC/C CDC20) ten como obxectivo a degradación das ciclinas mitóticas que comeza durante a anafase.[4] A adición experimental de M-ciclina non degradable ás células induce a detención do ciclo celular nun estado post-anafase/pre-telofase, con cromosomas condensados capturados nos polos celulares, un fuso acromático intacto e sen modificación da membrana nuclear. Isto mostrouse en ovos de sapo ( Xenopus ) e moscas de vinagre ( Drosophilla melanogaster ), no lavado de cervexa (Saccharomyces cerevisiae), no lavado de fisión (Schizosaccharomyces pombe) e en varias liñas de células humanas.[5]
O requisito para a activación da fosfatase pódese ver no xemo que se reproduce por xemación, que non ten fosfatases redundantes para rematar a mitose e que dependen da fosfatase cdc14. O bloqueo pola activación de cdc14 nestas células tradúcese do mesmo xeito que a detención fenotípica que bloquea a degradación da M-ciclina.[6] [4]
Historicamente, pensouse que a anafase e a telofase son eventos que ocorren de forma pasiva despois de que se cumpre o punto de control do fuso-ensamblaxe (SAC, spindle-assembly checkpoint) que define a transición metafase-anafase.[7] Non obstante, a existencia de fases diferenciais na actividade cdc14 entre anafase e telofase suxire que existen puntos de control mitótico adicionais descoñecidos. Cdc14 actívase pola súa liberación do núcleo (desde a súa captura dentro do nucléolo) e posterior exportación ao citoplasma. A vía de liberación de cdc14 durante a anafase temperá (que estabiliza o fuso acromático) tamén libera cdc14 do núcleo, pero restrinxeo ao núcleo. A liberación e o mantemento completos da activación de cdc14 conséguense separando o camiño da Rede de Saída Mitótica (MEN) ata un grao suficiente para desencadear a desmontaxe do fuso acromático e volver crear a membrana nuclear, despois dunha anafase tardía.[8][9]
A desfosforilación mediada por Cdc14 activa os procesos de regulación posteriores exclusivos da teleghase. Por exemplo, a desfosforilación de CDH1 permite que APC/C se una a CDH1. APC/C CDH1 marca CDC20 para a proteólise, o que resulta nun cambio celular da actividade APC/CC DC20 á actividade APC/C CDH1.[5] A ubiquitinación das ciclinas mitóticas continúa xunto coa das dianas específicas de APC/C CDH1 como compoñente do fuso acromático do levedo (Ase1) [6] e cdc5, cuxa degradación é necesaria para o retorno das células na fase G1.[8]
Mecanismos adicionais de condución da telofase
[editar | editar a fonte]Un cambio no perfil das fosfoproteínas en toda a célula é só o máis amplo dos moitos mecanismos reguladores que contribúen á aparición de eventos individuais durante a telofase.
- O espazamento cromosómico mediado pola anafase da placa metafásica pode desencadear indicios espaciais para a aparición de telofase.[10]
- Un efector e regulador importante da telofase é a cdc48 (o homólogo do levedo cdc48 é a p97 humana, tanto estrutural como funcionalmente), unha proteína que usa mecanicamente a súa actividade ATPasa para alterar a conformación das proteínas diana. Cdc48 é necesario para a desmontaxe do fuso acromático, a montaxe da membrana nuclear e a descondensación do cromosoma. Cdc48 modifica as proteínas estruturalmente implicadas nestes procesos, así como algunhas proteínas ubiquitinadas que polo tanto están dirixidas ao proteasoma.[6][11]
A desmontaxe do fuso acromático
[editar | editar a fonte]A rotura do fuso acromático, común á terminación da mitose en todos os eucariotas, é o evento máis utilizado para definir a transición da anafase B á telofase, [6] [12] que o inicio da ensamblaxe da membrana nuclear tende a preceder ao da desmontaxe do fuso.[13]
A desmontaxe do fuso é un proceso irreversíbel que non debe afectar á degradación final, senón á reorganización dos microtúbulos constituíntes; os microtúbulos sepáranse dos cinetocoros e centrosomas e volven aos seus estados de interfase.
A despolimerización do fuso acromático durante a telofase prodúcese desde o extremo máis afastado e, polo tanto, é a operación inversa do conxunto do fuso.[14] O conxunto posterior da matriz de microtúbulos está, a diferenza do fuso polarizado, interpolado. Isto é especialmente evidente nas células animais que inmediatamente, despois da desmontaxe do fuso acromático, deben establecer o feixe antiparalelo de microtúbulos coñecido como fuso central para regular a citocinese.[6] A ATPase p97 é necesaria para o establecemento de matrices de microtúbulos de interface relativamente estables e longas despois da desmontaxe do fuso acromático altamente dinámico e relativamente curto.[15]
-
Telofase dunha célula animal, onde se pode ver o fuso acromático
-
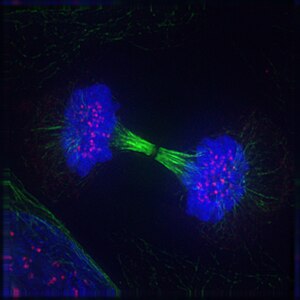
Imaxe de dúas células fillas durante a telofase. Podes ver o fuso acromático (tinción inmunolóxica antitubulina; laranxa), o citoesqueleto (tinción faloides; verde) e a cromatina (tinción DAPI; cian)
Aínda que o conxunto do fuso acromático foi estudado e caracterizado como un proceso no que se constrúen estruturas temporais polo SAC, a base molecular da desmontaxe do fuso aínda non se comprende con detalles comparables. Considérase que a cascada de desfosforilación mitótica tardía dos substratos de M-Cdk pola rede de saída da mitose (MEN) é a responsable do desmantelamento dos fusos. Os estados de fosforilación dos factores estabilizadores e desestabilizadores dos microtúbulos, así como os nucleótidos dos microtúbulos, son os principais reguladores das súas actividades.[16] Por exemplo, NuMA é unha proteína entrecruzada no extremo inferior e o substrato Cdk, cuxa disociación do microtúbulo, vese afectada pola súa desfosforilación durante a telofase.[6]
Un modelo xeral para a desmontaxe do fuso nos lévedos é que os tres subprocesos funcionais superpostos de desconexión, desestabilización e despolimerización do fuso están afectados principalmente por APC/C CDH1, quinases específicas para estabilizar microtúbulos e despolimerases dos microtúbulos do extremo máis afastado, respectivamente. Sábese que estes efectores están moi ben conservados entre os eucariotas superiores e os de lévedo. APC/C CDH1 diríxese ás proteínas asociadas a microtúbulos entre enlaces cruzados (NuMA, Ase1, Cin1 e máis). Aurora B (levedo IpI1) fosforilase o fuso asociado á proteína estabilizadora EB1 (levedo Bim1), que despois se disocia dos microtúbulos, e ao desestabilizador She1, que logo se asocia cos microtúbulos. A kinesina 8 (levedo Kip3), unha despolimerase dependente do ATP, acelera a despolimerización dos microtúbulos no extremo máis afastado. Demostrouse que a interrupción simultánea destes mecanismos, pero non dalgúns, provoca unha dramática hiperestabilidade do fuso durante a telofase, o que suxire unha superposición funcional a pesar da diversidade de mecanismos.
Reconstrución da membrana nuclear
[editar | editar a fonte]Os principais compoñentes da membrana nuclear son unha dobre membrana, formada por complexos de poros nucleares, e unha lámina nuclear interna dentro da membrana nuclear interna. Estes compoñentes se desintegran durante a profase e a prometafase, e reconstrúense durante a telofase, cando a membrana nuclear se volve a formar na superficie das cromátidas irmás separadas.[17] [18] A membrana nuclear é fragmentada e absorbida parcialmente polo retículo endoplasmático durante a prometafase, e a agregación da membrana nuclear interna (con vesículas do retículo endoplasmático que conteñen proteínas) á cromatina ocorre durante a telofase nunha reversión deste proceso. As vesículas formadoras de membrana agréganse directamente na superficie da cromatina, onde se fusionan lateralmente nunha membrana continua.[6]
O Ran-GTP é necesario para a ensamblaxe precoz da membrana nuclear na superficie dos cromosomas; libera compoñentes da membrana capturados pola importina-β durante a mitose temperá. Ran-GTP sitúase preto dos cromosomas a través da mitose, pero non desencadea a disociación das proteínas da membrana nuclear da importina-β ata que as dianas M-Cdk son desfosforiladas na telofase.[6] Estes compoñentes da membrana inclúen varios compoñentes do poro nuclear, o máis estudado dos cales é a proteína de armazón do poro nuclear ELYS, que pode recoñecer rexións de ADN ricas en pares de bases A : T ( in vitro ) e, polo tanto, pode unirse directamente ao ADN.[19] Porén, os experimentos con extractos de ovos de Xenopus concluíron que ELYS non se asocia co ADN espido e só se une directamente aos dímeros de histonas e nucleosomas.[20] Despois de unirse á cromatina, ELYS recruta outros compoñentes do armazón do poro nuclear e das proteínas dos poros transmembrana. O complexo de poros nucleares ensambla e intégrase na membrana nuclear dun xeito organizado, engadindo Nup107-160, POM121 e FG Nups consecutivamente.[21]
Debátese se o mecanismo da reconstrución da membrana nuclear implica a montaxe inicial dos poros nucleares e o posterior recrutamento de vesículas de membrana ao redor dos poros, ou se a membrana nuclear está formada principalmente a partir de cisternas do retículo endoplasmático estendido do conxunto de poros nucleares:
- Nas células onde a membrana nuclear se fragmenta en vesículas non-ER durante a mitose, unha vía dependente de Ran-GTP pode dirixir estas poboacións de vesículas discretas á cromatina, onde se fusionan para reconstruír a membrana nuclear.[22]
- Nas células onde a membrana nuclear é absorbida dentro do retículo endoplasmático durante a mitose, a reconstrución implica a expansión lateral arredor da cromatina coa estabilización da membrana en expansión na superficie da cromatina.[23] Estudos que afirman que este mecanismo é un requisito previo para a formación de poros nucleares descubriron que os complexos Nup107-160 asociados á cromatina núa están presentes en unidades simples no canto de estar ensamblados antes da formación dos poros.[24]
A membrana é suavizada e expandida encerrando todo o conxunto de cromátidas no seu interior. Isto probabelmente débese á importación de follas dos poros nucleares, que poden conservarse dentro dunha membrana continua. As membranas nucleares dos extractos de ovos de Xenopus non amoleceron cando se inhibiu a importación da película nuclear, deixándoa engurrada e unida firmemente aos cromosomas condensados.[25] Non obstante, no caso da expansión lateral do retículo endoplásmico, a importación nuclear comeza antes de que se complete a reensamblaxe da membrana nuclear, o que dá lugar a un gradiente temporal de proteínas intranucleares entre os aspectos distal e medial do núcleo, que se forma.[21]
As subunidades das láminas desmontadas en profase actívanse e captúranse durante a mitose. O ensamblaxe das follas é desencadeada pola desfosforilación da folla (e, ademais, pola esterificación metílica dos residuos de COOH da folla B ). O laminado B pode orientarse á cromatina ata a metade da anafase . Durante a telofase, cando se restablece a importación nuclear, a folla A entra no núcleo reconstruído, pero continúa montando lentamente na lámina periférica durante varias horas ao longo da fase G 1.[19]
Os extractos de ovos de Xenopus e as liñas celulares de cancro humano foron os principais modelos utilizados para o estudo da reconstrución da membrana nuclear.
Os lévedos non teñen láminas; a súa membrana nuclear permanece intacta durante toda a mitose e a división nuclear ocorre durante a citocinese.[26]
Descondensación cromosómica
[editar | editar a fonte]A descondensación do cromosoma (tamén coñecida como relaxación ou descompactación ) para converterse en cromatina expandida é necesaria para que a célula retome os procesos de interfase, e ocorre en paralelo ao ensamblaxe da membrana nuclear durante a telofase en moitos eucariotas . A desfosforilación de Cdk mediada pola rede de saída da mitose (MEN) é necesaria para a descondensación cromosómica.[6][5]
Nos vertebrados, a descondensación cromosómica só comeza despois de que se restableza a importación nuclear. Se se impide o transporte das láminas a través dos poros nucleares, os cromosomas permanecen condensados despois da citocinese e as células non logran volver a entrar na seguinte fase S (fase de síntese). Nos mamíferos, a liberación de ADN para a fase S (a asociación da cromatina cos múltiples factores proteicos necesarios para a súa replicación) tamén se produce coincidindo coa maduración da membrana nuclear durante a telofase.[27] Isto pode atribuír e proporcionar probas da restitución da maquinaria de importación nuclear a partir de localizacións interfaciais de proteínas nucleares e citoplásmicas durante a telofase.
-
Ciclo celular completo. A telofase forma parte da mitose (M). Unha vez rematada, comeza a fase G1 da interfase
-
Cambios que ocorren nunha célula durante a mitose (I, II, III: Profase ; IV: Prometafase ; V: Metafase ; VI: Anafase ; VII, VIII: Telofase )
-
Células na zona do meristemo da punta da raíz da cebola (Allium cepa) durante a telofase
Notas
[editar | editar a fonte]- ↑ "bUSCatermos; telofase". aplicacions.usc.es. Consultado o 2022-05-30.[Ligazón morta]
- ↑ 2,0 2,1 Morgan, David Owen (2007). The Cell Cycle: Principles of Control (en inglés). New Science Press. ISBN 978-0-9539181-2-6.
- ↑ Juang, YL; Huang, J; Peters, JM; McLaughlin, ME; et al. (febreiro de 1997). "«APC-mediated proteolysis of Ase1 and the morphogenesis of the mitotic spindle»". Science (en inglés). 275(5304): 1311–1314. PMID 9036857.
- ↑ 4,0 4,1 Alberts et al. 2015, p. 995-996.
- ↑ 5,0 5,1 5,2 Inzé 2007, p. 99-103.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 6,8 Morgan 2007, p. 154-155.
- ↑ Afonso, Olga; Matos, Irina; Maiato, Helder (2014-10-01). "Spatial control of the anaphase-telophase transition". Cell Cycle 13 (19): 2985–2986. ISSN 1538-4101. PMC 4614036. PMID 25486554. doi:10.4161/15384101.2014.959853.
- ↑ 8,0 8,1 Monje-Casas & Queralt 2017, p. 3-8.
- ↑ Yellman, Christopher M.; Roeder, G. Shirleen (2015-06-19). "Cdc14 Early Anaphase Release, FEAR, Is Limited to the Nucleus and Dispensable for Efficient Mitotic Exit". PLOS ONE (en inglés) 10 (6): e0128604. ISSN 1932-6203. PMC 4474866. PMID 26090959. doi:10.1371/journal.pone.0128604.
- ↑ Afonso, Olga; Matos, Irina; Maiato, Helder (2014-10-01). "Spatial control of the anaphase-telophase transition". Cell Cycle 13 (19): 2985–2986. ISSN 1538-4101. PMC 4614036. PMID 25486554. doi:10.4161/15384101.2014.959853.
- ↑ Hetzer, M; Meyer, HH; Walther, TC; Bilbao-Cortes, D; et al. (desembre de 2001). "Distinct AAA-ATPase p97 complexes function in discrete steps of nuclear assembly". Nature Cell Biology. 3(12): 1086–1091. PMID 11781570. doi:10.1038/ncb1201-1086.
- ↑ Afonso, O; Matos, I; Maiato, H (2014). "Spatial control of the anaphase-telophase transition". Cell Cycle (en inglés). 13(19): 2985-2986. PMC 4614036. PMID 25486554. doi:10.4161/15384101.2014.959853.
- ↑ Aist, JR (1 de xaneiro de 2002). "Mitosis and motor proteins in the filamentous ascomycete, Nectria haematococca, and some related fungi". International Review of Cytology (en inglés) 212: 239–263. PMID 11804038. doi:10.1016/S0074-7696(01)12007-3.
- ↑ Woodruff, Jeffrey Blake (2011). "Mechanisms of Mitotic Spindle Disassembly and Positioning in Saccharomyces cerevisiae". UC Berkeley (en inglés).
- ↑ Cao, K; Nakajima, R; Meyer, HH; Zheng, Y (outubro de 2003). "The AAA-ATPase Cdc48/p97 regulates spindle disassembly at the end of mitosis". Cell (en inglés). 115(3): 355–367. PMID 14636562. doi:10.1016/S0092-8674(03)00815-8.
- ↑ Cao, Kan; Nakajima, Reiko; Meyer, Hemmo H.; Zheng, Yixian (2003-10). "The AAA-ATPase Cdc48/p97 Regulates Spindle Disassembly at the End of Mitosis". Cell 115 (3): 355–367. ISSN 0092-8674. doi:10.1016/s0092-8674(03)00815-8.
- ↑ Yael et al. 2013, p. 281-283.
- ↑ W H Freeman (ed.). "«Molecular Cell Biology". www.ncbi.nlm.nih.gov/books/NBK21704/ (en inglés).
- ↑ 19,0 19,1 Pollard et al. 2017, p. 770-771.
- ↑ Zierhut, Christian; Jenness, Christopher; Kimura, Hiroshi; Funabiki, Hironori (2014-07). "Nucleosomal regulation of chromatin composition and nuclear assembly revealed by histone depletion". Nature Structural & Molecular Biology (en inglés) 21 (7): 617–625. ISSN 1545-9985. PMC 4082469. PMID 24952593. doi:10.1038/nsmb.2845.
- ↑ 21,0 21,1 Gay, S; Foiani, M (1 de xaneiro de 2015). "«Nuclear envelope assembly in Xenopus extracts visualized by scanning EM reveals a transport-dependent 'envelope smoothing' event»". International Review of Cell and Molecular Biology (en inglés) 317: 267–330. PMID 26008788. doi:10.1016/bs.ircmb.2015.03.001.
- ↑ Clarke, PR; Zhang, C (2004). "«Spatial and temporal control of nuclear envelope assembly by Ran GTPase»". Symposia of the Society for Experimental Biology (en inglés) 56: 193–204. PMID 15565882.
- ↑ Hetzer, MW (març 2010). "«The nuclear envelope»". Cold Spring Harbor Perspectives in Biology (en inglés) 2(3): a000539. PMC 2829960. PMID 20300205. doi:10.1101/cshperspect.a000539.
- ↑ Lu, L; Ladinsky, MS; Kirchhausen, T (agosto de 2011). "Formation of the postmitotic nuclear envelope from extended ER cisternae precedes nuclear pore assembly". The Journal of Cell Biology (en inglés). 194(3): 425–440. PMC 3153650. PMID 21825076. doi:10.1083/jcb.201012063.
- ↑ Wiese, C; Goldberg, MW; Allen, TD; Wilson, KL (xullo de 1997). "Nuclear envelope assembly in Xenopus extracts visualized by scanning EM reveals a transport-dependent 'envelope smoothing' event". Journal of Cell Science (en inglés). 110(13): 1489–1502. PMID 9224766.
- ↑ Taddei, A; Schober, H; Gasser, SM (agosto de 2010). "The budding yeast nucleus". Cold Spring Harbor Perspectives in Biology (en inglés) 2(8): a000612. PMC 2908769. PMID 20554704. doi:10.1101/cshperspect.a000612.
- ↑ Fukushima, K; Wang, M; Naito, Y; Uchihashi, T; et al. (marzo de 2017). "GAK is phosphorylated by c-Src and translocated from the centrosome to chromatin at the end of telophase". Cell Cycle (en inglés). 16(5): 415–427. PMC 5351929. PMID 28135906. doi:10.1080/15384101.2016.1241916.
Véxase tamén
[editar | editar a fonte]-
Telofase
| Wikimedia Commons ten máis contidos multimedia na categoría: Telofase |
Bibliografía
[editar | editar a fonte]- Alberts, B; Johnson, A; Lewis, J; Morgan, D; et al.. Molecular Biology of the Cell (en inglés). Nova York, NY: Garland Science, Taylor and Francis Group, 2015. ISBN 978-0-8153-4432-2 .
- Inzé, Dirk. Cell Cycle Control and Plant Development (en inglés). Oxford, UK: Blackwell Publishing Ltd., 2007. ISBN 978-1-4051-5043-9.
- Monje-Casas, Fernando; Queralt, Ethel. The Mitotic Exit Network (en inglés). Nova York, NY: Humana Press, 2017. ISBN 9781493965007.
- Morgan, David. The Cell Cycle. Londres, UK: New Science Press Ltd., 2007, p. 154–155. ISBN 0-9539181-2-2.
- Pollard, TD; Earnshaw, WC; Lippincott-Schwartz, J; Johnson, GT. Cell Biology (en inglés). Filadelfia, PA: Elsevier, 2017. ISBN 978-0-323-34126-4.
- Reece, Jane; Urry, Lisa; Cain, Michael; Wasserman, Steven; et al.. Campbell Biology (en inglés). Pearson, 2011. ISBN 978-0-321-77565-8.
- Yael, Avisar; Choi, Jung; DeSaix, Jean; Jurukovski, Vladimir; et al.. Biology (en inglés). Texas, EEUU: OpenStax College, 2013. ISBN 978-1-938168-09-3.