Agarosa

A agarosa é un polisacárido xeralmente extraído de certas algas vermellas.[1] É un polímero liñal feito de unidades repetidas de agarobiosa, que é un disacárido constituído por D-galactosa e 3,6-anhidro-L-galactopiranosa.[2] A agarosa é un dos principais compoñentes do ágar-ágar, e purifícase a partir do mesmo retirando o seu outro compoñente, a agaropectina.[3]
A agarosa úsase frecuentemene en bioloxía molecular para a separación de grandes moléculas, especialmente ADN, por electroforese en xel de agarosa. As láminas de xeles de agarosa (xeralmente ao 0,7 - 2%) para electroforese prepáranse doadamente vertendo unha solución líquida quente nun molde. COmercialízanse unha gran variedade de agarosas de diversos pesos moleculares e propiedades para este propósito. A agarosa pode tamén producirse como pequenas boliñas e utilizada en varios métodos cromatográficos para a purificación de proteínas.
Estrutura
[editar | editar a fonte]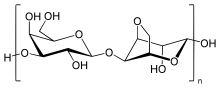
A agarosa é un polímero liñal cun peso de molecular duns 120 000 Da, que consta de unidades alternadas de D-galactosa e 3,6-anhidro-L-galactopiranosa unidas por enlaces glicosídicos α-(1→3) e β-(1→4). A 3,6-anhidro-L-galactopiranosa é unha L-galactosa cunha ponte anhidro entre as posicións 3 e 6, aínda que algunhas das unidades de L-galactosa do polímero poden non conter a ponte. Algunhas unidades de D-galactosa e L-galactosa poden estar metiladas e o piruvato e o sulfato tamén se encontran en pequenas cantidades.[4]
Cada cadea de agarosa contén ~800 moléculas de galactosa, e as cadeas do polímero de agarosa forman fibras helicoidais que se agregan en estruturas superenroladas cun raio de 20-30 nm.[5] As fibras son case ríxidas e teñen un amplo rango de lonxitudes dependendo da concentración de agarosa.[6] Cando se solidifican, as fibras forman unha rede tridimensional de canles de diámetros que van desde os 50 nm a >200 nm dependendo da concentración de agarosa usada ; as concentracións maiores renden poros de menores diámetros medios. A estrutura tridimensional mantense unida por enlaces de hidróxeno e pode, por tanto, ser alterada pola calor, volvéndoa ao estado líquido.
Propiedades
[editar | editar a fonte]A agarosa está dispoñible en forma de pos brancos que se disolven en auga case fervendo e forman un xel ao arrefriar. A agarosa mostra o fenómeno da histérese térmica na súa transición de líquido a xel, é dicir, xelifícase e funde a diferentes temperaturas. As temperaturas de xelificaciónn e fusión varían dependendo do tipo de agarosa. As agarosas estándar derivadas da alga Gelidium teñen unha temperatura de xelificación de 34-38 °C e unha temperatura de fusión de 90-95 °C, mentres que as derivadas de Gracilaria, debido aos seus maiores substituíntes metoxi, teñen unha temperatura de xelificación de 40-52 °C e unha temperatura de fusión de 85-90 °C.[7] As temperaturas de xelificación e fusión poden depender da concentración do xel, especialmente a concentracións de xel baixas de menos do 1%. Ambas as temperaturas deben, por tanto, darse a unha concentración especificada de agarosa.
A agarosa natural contén grupos metilo non cargados e o grao de metilación é directamente proporcional á temperatura de xelificación. Porén, a metilación sintética ten o efecto inverso, mentres que un incremento na metilación fai baixar a temperatura de xelificación.[8] Disponse de diversas agrosas modificadas quimicamente con diferentes temperaturas de fusión e xelificación.
A agarosa no xel forma un enguedello que contén poros e o tamaño dos poros depende da súa concentración de agarosa. En vertical os xeles de agarosa son tendentes á sinérese (extrusión de auga pola superficie do xel), mais o proceso é o suficientemente lento para non interferir co uso do xel.[9][10]
O xel de agarosa pode ter unha alta forza de xel a baixas concentracións, o que o fai moi axeitado como medio anticonvección para a electroforese en xel. Os xeles de agarosa diluídos ao 0,15% poden formar láminas para a electroforese en xel.[11] O polímero de agarosa contén grupos cargados, especialmente de piruvato e sulfato.[8] Estes grupos cargados negativamente poden retardar o movemento de moléculas de ADN nun proceso chamado electroendosmose (EEO), e prefírese unha agarosa de EEO baixa para usala en electroforese en xel de ácidos nucleicos en agarosa. As agarosas de EEO cero tamén existen, pero estas poden ser pouco desexables para algunhas aplicacións, xa que poden fabricarse engadindo grupos cargados positivamente que poden afectar a posteriores reaccións encimáticas.[12] A electroendosmose é unha razón pola que se usa preferentemente a agarosa ao ágar, xa que a agaropectina do ágar contén unha cantidade significativa de grupos sulfato e carboxilo con carga negativa. A eliminación da agaropectina na agarosa reduce substancialmente a EEO, así como reduce a adsorción non específica de biomoléculas á matriz do xel. Porén, para algunhas aplicacións como a elecroforese de proteínas séricas, pode ser desexable unha alta EEO, e a pode engadirse agaropectina no xel usado.[13]
Agarosas de temperaturas de fusión e xelificación baixas
[editar | editar a fonte]As temperaturas de xelificación e fusión da agarosa poden variarse por modificacións químicas, as máis comúns son as hidroxietilacións, que reducen o número de enlaces de hidróxeno entre fibras, o que ten como resultado unhas menores temperaturas de fusión e callado do xel que as das agarosas estándar.[14] A temperatura exacta determínase polo grao de substitución e moitas agarosas de baixo punto de fusión dispoñibles poden permanecer fluídas no intervalo 30-35 °C. Esta propiedade permite que se leven a cabo manipulacións encimáticas directamente despois da electroforese en xel do ADN engadindo láminas de xel fundido que conteñen o fragmento de ADN de interese á mestura de reacción. A agarosa de baixo punto de fusión contén menos sulfatos, o cal pode afectar a algunhas reaccións encimáticas e, por tanto, úsase preferiblemente para algunhas aplicacións. A hidroxietilación pode reducir o tamaño do poro ao reducir a densidade de empaquetamento dos feixes de agarosa, polo que o xel de baixa temperatura de fusión pode tamén ter un efecto sobre o tempo e a separación durante a electroforese.[15] Agarosas de temperatura de fusión ou xerilificación ultrabaixas poden xelificar a tan só 8-15 °C.
Aplicacións
[editar | editar a fonte]
A agarosa é unha matriz preferente para traballar con proteínas e ácidos nuclecios, xa que ten un amplo rango de estabilidade física, química e térmica e o seu grao máis baixo de complexidade química tamén fai menos probable que interaccione con biomoléculas. A agarosa utilízase principalmente como medio para a separación electroforética a escala analítica na electroforese en xel de agarosa. Os xeles feitos de agarosa purificada teñen un tamaño de poro relativamente grande, polo que son útiles para a separación de grandes moléculas, como as proteínas e complexos proteicos de >200 kDa, así como fragmentos de ADN de >100 pares de bases. A agarosa utilízase tamén moito para outras aplicacións, por exemplo a inmunodifusión e a inmunoelectroforese, xa que as fibras de agarosa funcionan como unha áncora para os inmunocomplexos.
Electroforese en xel de agarosa
[editar | editar a fonte]- Artigo principal: Electroforese en xel de agarosa.
A electroforese en xel de agarosa é o método de rutina para resolver o ADN no laboratorio. Os xeles de agarosa teñen un poder de resolcuión menor para o ADN que os xeles de poliacrilamida, pero teñen un maior rango de separación e son utilizados para fragmentos de ADN con lonxitudes de 50–20000 pares de bases, aínda que é posible que unha resolución dun 6 Mb con electroforese en xel de campo pulsado (PFGE).[16] Pode tamén usarse para separar grandes moléculas de proteínas e é a matriz preferida para a electroforese en xel de partículas con raios efectivos maiores de 5-10 nm.[11]
O tamaño de poro do xel afecta o tamaño do ADN que pode ser cribado. Canto menor é a concentración do xel, maior é o tamaño de poro e maior é o ADN que se pode cribar. Porén, os xeles de baixa concentración (0,1 - 0,2%) son fráxiles e, por tanto, difíciles de manipular, e a electroforese de moléculas de ADN grandes pode tardar varios días. O límite de resolución para a electroforese en xel de agarosa estándar é duns 750 kb.[16] Este límite pode superarse pola electroforese en xel de campo pulsado, producido por campos eléctricos ortogonais aplicados ao xel. Os fragmentos de ADN reoriéntanse cando o campo aplicado cambia de dirección, pero as moléculas máis grandes do ADN tardan máis en realiñarse cando se altera o campo eléctrico, mentres que para os menores é máis rápido e o ADN pode ser fraccionado segundo o seu tamaño.
Os xeles de agarosa vértense nun molde, e cando callan, xeralmente se poñen a funcionar horizontalmente mergullados nunha solucion tampón. Os tampóns Tris-acetato-EDTA e o Tris-Borato-EDTA son os que se utilizan comunmente, pero outros tampóns como o Tris-fosfato ácido barbirútico-barbiturato de sodio ou Tris-barbiturato poden utilizarse noutras aplicacións.[1] O ADN é normalmente visualizado por tinguidura con bromuro de etidio e despois visto baixo luz UV, pero disponse doutros métodos de tingidura, como o verde SYBR, GelRed, azul de metileno e cristal violeta. Se os fragmentos de ADN separados son necesarios para un posterior experimento, poden ser sacados do xel cortándoo en láminas para unha manipulación posterior.

Purificación de proteínas
[editar | editar a fonte]As matrices de xel de agarosa que se adoitan utilizar para a purificación de proteínas, por exemplo, na separación a escala preparativa baseada en columnas, como a cromatografía de filtración en xel (xelfiltración), cromoatografía de afinidade e cromatografía de intercambio iónico. Porén, non se usa como un xel continuo, senón que se forma con boliñas porosas ou resinas de diversas finuras.[17] As boliñas son moi porosas para que as proteínas poidan fluír libremente das bólas. Estas boliñas baseadas na agarosa son xeralmene brandas e quedan esmagadas doadamente, polo que deberían utilizarse baixo un fluxo gravitacional, con centrifugación de baixa velocidade ou procedementos a baixa presión.[18] A forza das resinas pode mellorarse incrementando os enlaces cruzados e o endurecemento químico das resinas de agarosa, porén, cada cambio pode tamén ter como resultado unha menor capacidade de unión ás proteínas nalgúns procedementos de separación como a cromatografía de afinidade.
A agarosa é un material útil para a cromatografía porque non absorbe biomoléculas de forma significativa, ten unhas boas propiedades de fluxo e pode tolerar pHs e forzas iónicas extremas así como altas concentracións de desnaturlizantes como urea 8M ou cloruro de guanidinio 6M.[19] Exemplos de matrices baseadas en agarosa para cromatografía de filtración en xel son a Sepharose e as WorkBeads 40 SEC (boliñas de agarosa con enlaces cruzados), Praesto e Superose (boliñas de agarosa con moitos enlaces cruzados) e Superdex (dextrano ligado covalentemente á agarosa).
Para a cromotografía de afinidade, a agarosa en boliñas é a resina matriz máis utilizada para a unión de ligandos que se unen a proteínas.[20] Os ligandos están ligados covalentemente por medio dun espazador a grupos hidroxilo activados de polímeros de boliñas de agarosa. As proteínas de interese poden despois unirse selectivamente aos ligandos para separalas doutras proteínas, despois do cal poden ser eluídas. As boliñas de agarosa usadas son normalmente de densidades do 4% e 6% con alta capacidade de unión a proteínas.
Medios de cultivo sólidos
[editar | editar a fonte]As placas de agarosa poden ás veces utilizarse en vez do ágar para o cultivo de organismos, xa que o ágar pode conter impurezas que poden afectar ao crecemento do organismo ou algúns procedementos que se fan posteriormente como a reacción en cadea da polimerase (PCR). A agarosa é tamén máis dura que o ágar e pode, por tanto, ser preferible onde cómpre unha maior forza de xel, e a súa menor temperatura de xelificación pode impedir que se cause un shock térmico ao organismo cando as céllas son suspendidas nun líquido antes da xelificación. Pode usarse para o cultivo de bacterias autótrofas estritas, protoplastos de plantas,[21] Caenorhabditis elegans,[22] outros organismos e varias liñas celulares.
Cultivos celulares tridimensionais
[editar | editar a fonte]A agarosa utilízase comunmente como soporte para o cultivo tridimensional de células humanas e animais. Como a agarosa forma hidroxeles non citotóxicos, pode utilizarse para reproducir o ambiente natural das células no corpo humano, a matriz extracelular. Porén, a agarosa forma un hidroxel inerte ríxido que non porta ningunha información biolóxica, e así as células humanas e animais non poden adherirse ao polisacárido. Debido a estas propiedades específicas, o hidroxel de agarosa imita o ambiente natural das células cartilaxinosas e son o soporte para a diferenciación de condrocitos en cartilaxe. Para modificar as propiedades mecánicas da agarosa para reproducir o ambiente natural doutras células humanas, a agarosa pode modificarse quimicamente por medio da oxidación precisa do alcohol primario da D-galactosa en ácido carboxílico. Esta modificación química proporciona unha nova clase de material denominado agarosa carboxilada. Controlando o número de D-galactosas carboxiladas no esqueleto de polisacárido, as propiedades mecánicas do hidroxel resultante poden ser controladas con precisión. Estes hidroxeles de agarosa carboxilados poden despois ser unidos covalentemente a péptidos para formar hidroxel ao cal se poden adherir as células. Estes hidroxeles de agarosa carboxilados dirixen a organización das células endoteliais humanas en lumes polarizados.[23] A mestura de agarosa completamente carboxilada con agarosa natural pode utilizarse para facer hidroxeles que abrangan un conxunto completo de propiedades mecánicas.[24][25]
Ensaios de motilidade
[editar | editar a fonte]A agarosa utilízase ás veces en lugar do ágar-ágar para medir a motilidade de microorganismos. As especies móbiles poden migrar, aínda que de vagariño, a través do xel poroso e as taxas de infiltración poden visualizarse despois. A porosidade do xel está directamente relacionada coa concentración de ágar ou agarosa no medio, polo que poden utilizarse xeles de diferentes concentracións para avaliar a capacidade natatoria, de enxameamento, de deslizamento e de retorcemento. Con agarosa os ensaios de migración celular poden usarse para medir a quimiotaxe e quimiocinese. Unha capa de xel de agarosa sitúase entre unha poboación celular e un quimioatractor. Como o gradiente de concentración se desenvolve por difusión de quimioatractores no xel, varias poboacións celulares que requiren niveis de estimulación diferentes para migrar poden despois ser visualizadas co tempo usando microfotografía a medida que ascenden polo xel contra a gravidade ao longo do gradiente.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Jeppson, J. O., C. B. Laurell, and Bi Franzen (1979). "Agarose gel electrophoresis". Clinical Chemistry 25 (4): 629–638. PMID 313856.
- ↑ Agar Arquivado 16 de outubro de 2007 en Wayback Machine. en lsbu.ac.uk Water Structure and Science
- ↑ "Agar". Food and Agricultural Organization of the United Nations.
- ↑ Rafael Armisen; Fernando Galatas. "Chapter 1 - Production, Properties and Uses of Agar". Fao.org.
- ↑ Tom Maniatis; E. F. Fritsch; Joseph Sambrook. "Chapter 5, protocol 1". Molecular Cloning - A Laboratory Manual 1. p. 5.4. ISBN 978-0879691363.
- ↑ Alistair M. Stephen; Glyn O. Phillips, eds. (2006). Food Polysaccharides and Their Applications. CRC Press. p. 226. ISBN 978-0824759223.
- ↑ Workshop on Marine Algae Biotechnology: Summary Report. National Academy Press. 1986. p. 25.
- ↑ 8,0 8,1 "Appendix B: Agarose Physical Chemistry" (PDF). Lonza Group.
- ↑ S.E. Hill; David A. Ledward; J.R. Mitchell, eds. (1998). Functional Properties of Food Macromolecules. Springer. p. 149. ISBN 978-0-7514-0421-0.
- ↑ Haesun Park; Kinam Park; Waleed S.W. Shalaby (1993). Biodegradable Hydrogels for Drug Delivery. CRC Press. p. 102. ISBN 978-1566760041.
- ↑ 11,0 11,1 Philip Serwer (1983). "Agarose gels: Properties and use for electrophoresis". Electrophoresis 4 (6): 375–382. doi:10.1002/elps.1150040602.
- ↑ Joseph Sambrook; David Russell. "Chapter 5, protocol 1". Molecular Cloning - A Laboratory Manual 1 (3rd ed.). p. 5.7. ISBN 978-0-87969-577-4.
- ↑ Keren, David (26 September 2003). Protein Electrophoresis in Clinical Diagnosis. CRC Press. pp. 7–8. ISBN 978-0340812136.
- ↑ Tom Maniatis; E. F. Fritsch; Joseph Sambrook. "Chapter 5, protocol 6". Molecular Cloning - A Laboratory Manual 1. p. 5.29. ISBN 978-0879695774.
- ↑ Lee PY, Costumbrado J, Hsu CY, Kim YH (20 April 2012). "Agarose gel electrophoresis for the separation of DNA fragments". J Vis Exp 62: 3923. PMC 4846332. PMID 22546956. doi:10.3791/3923.
- ↑ 16,0 16,1 Tom Maniatis; E. F. Fritsch; Joseph Sambrook. "Chapter 5, protocol 1". Molecular Cloning - A Laboratory Manual 1. p. 5.2–5.3. ISBN 978-0879691363.
- ↑ David Freifelder (1982). Physical Biochemistry: Applications to Biochemistry and Molecular Biology (2nd ed.). WH Freeman. p. 240. ISBN 978-0716714446.
- ↑ "Overview of Affinity Purification". Thermo Scientific.
- ↑ David Freifelder (1982). Physical Biochemistry: Applications to Biochemistry and Molecular Biology (2nd ed.). WH Freeman. p. 258. ISBN 978-0716714446.
- ↑ Pedro Cuatrecasas; Meir Wilchek (2004). William J. Lennarz; M. Daniel Lane, eds. Encyclopedia of Biological Chemistry. Volume 1. Academic Press. p. 52. ISBN 9780124437104.
- ↑ J.M. Bonga; Patrick von Aderkas (1992). In Vitro Culture of Trees. Springer. p. 16. ISBN 978-0792315407.
- ↑ Guy A. Caldwell; Shelli N. Williams; Kim A. Caldwell (2006). Integrated Genomics: A Discovery-Based Laboratory Course. Wiley. pp. 94–95. ISBN 978-0470095027.
- ↑ A. Forget; J. Christensen; S. Lüdeke; E. Kohler; S. Tobias; M. Matloubi; R. Thomann; V. P. Shastri (2013). "Polysaccharide hydrogels with tunable stiffness and provasculogenic properties via α-helix to β-sheet switch in secondary structure". Proceedings of the National Academy of Sciences of the United States of America 110 (32): 12887–12892. PMC 3740890. PMID 23886665. doi:10.1073/pnas.1222880110.
- ↑ A. Forget; R. A. Pique; V. Ahamadi; S. Lüdeke; V. P. Shastri (2015). "Mechanically tailored agarose hydrogels through molecular alloying with beta-sheet polysaccharides". Macromolecular Rapid Communications 36 (2): 196–203. doi:10.1002/marc.201400353.
- ↑ A. Rüther; A. Forget; A. Roy; C. Carballo; F. Mießmer; R. K. Dukor; L. A. Nafie; C. Johannessen; V. P. Shastri; S. Lüdeke (2017). "unravelling a direct role for polysaccharide beta-strands in the Higher Order Structure of Physical Hydrogels". Angewandte Chemie International Edition 56: 1–6. doi:10.1002/anie.201701019.
