Ácido fosfatídico

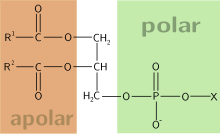
Os ácidos fosfatídicos (abreviadamente PA) son un tipo de fosfolípido composto por un glicerol que ten esterificados os seus grupos OH con dous ácidos graxos e un ácido fosfórico. Tamén pode describirse como un diacilglicérido fosfatado, o fosfolípido máis simple. O ácido fosfórico está ionizado a pH celular, orixinando fosfatidatos. Os ácidos fosfatídicos diferéncianse uns doutros polos ácidos graxos que leven.
Os ácidos fosfatídicos son o esqueleto básico de todos os fosfolípidos, os cales levan unha molécula polar esterificada no fosfato do ácido fosfatídico, polo que reciben o nome de fosfatidil + nome da cabeza polar, por exemplo fosfatidilcolina, fosfatidiletanolamina etc. Os fosfolípidos son os principais constituíntes das membranas celulares.
O ácido fosfatídico é tamén o punto de partida para a síntese de triacilglicéridos (triglicéridos).
Biosíntese
[editar | editar a fonte]A ruta metabólica principal de síntesis de novo do ácido fosfatídico iníciase co glicerol 3-fosfato, o cal provén da dihidroxiacetona fosfato, un intermediario da glicólise, que é transformada polo encima glicerol-3-fosfato deshidroxenase:

Outra vía máis minoritaria de obtención de glicerol 3-fosfato é por fosforilación de glicerol libre catalizada pola glicerol quinase con consumo dun ATP.[1]
A síntese de novo de ácido fosfatídico implica dous pasos con adición secuencial de dous ácidos graxos nos hidroxilos 1 e 2 do glierol 3-fosfato, reaccións catalizadas polas aciltransferases I e II; os ácidos graxos son traídos polo coencima A en forma de acilo graxos-CoA [1]:

Ademais da síntese de novo, o ácido fosfatídico pode formarse doutras tres maneiras:
- Pola acción da fosfolipase D (PLD), por medio da hidrólise do enlace P-O da fosfatidilcolina para producir ácido fosfatídico e colina.[2]
- Pola fosforilación dun diacilglicérido pola diacilglicerol quinase
- Pola acilación do ácido lisofosfatídico pola ácido lisofosfatídico-aciltransferase; esta é a vía metabólica máis común.
O ácido fosfatídico degrádase por conversión en diacilglicéridos pola fosfatidato fosfatase [3][4] ou en ácido liso-fosfatídico por acción da fosfolipase A.
Funcións do ácido fosfatídico na célula
[editar | editar a fonte]As funcións exercidas polo ácido fosfatídico nas células poden agruparse en tres categorías:
- O ácido fosfatídico é o precursor para a biosíntese de moitos outros lípidos.
- As propiedades físicas do ácido fosfatídico teñen influencia na curvatura da membrana.
- O ácido fosfatídico actúa como un lípido sinalizador, recrutando proteínas citosólicas nas membranas axeitadas (por exemplo, a esfingosina quinase 1[5]).
Estas tres funcións non son mutuamente excluíntes. Por exemplo, o ácido fosfatídico pode estar implicado na formación de vesículas ao favorecer a curvatura da membrana e recrutar as proteínas que levarán a cabo a tarefa de estrangulamento da vesícula e evaxinación, moito menos favorable enerxeticamente.
O ácido fosfatídico como precursor biosintético
[editar | editar a fonte]O ácido fosfatídico é un lípido vital para a acélula, que actúa (directa ou indirectamente) como un precursor biosintético para a formación de todos os glicerolípidos da célula.[6]
Nos mamíferos e lévedos, coñécense dúas rutas metabólicas para a síntese de novo do ácido fosfatídico, a vía do glicerol 3-fosfato e a da dihidroxiacetona fosfato. Nas bacterias, só funciona a primeira, e as mutacións que bloquean esta vía son letais, o que demostra a importancia do ácido fosfatídico na célula. Nos mamíferos e lévedos, nos que os encimas destas vías son redundantes, as mutacións nun destes encimas non son letais. Porén, hai que salientar que in vitro as diferentes aciltransferases mostran diferentes especificidades de substrato con respecto aos acil-CoAs que incorporan ácidos graxos ao ácido fosfatídico. Ademais as diferentes aciltransferases teñen tamén diferentes distribucións intracelulares, como o retículo endoplasmático, a mitocondria ou os peroxisomas, e hai diferentes concentracións locais de ácidos graxos activados. Isto suxire que as distintas aciltransferases presentes nas células de mamífero e lévedo poden ser responsables de producir distintos conxuntos de ácidos fosfatídicos.[6]
A conversión do ácido fosfatídico en diacilglicerol (DAG) feita polas lípido fosfato fosfohidrolases (LPP) é o paso crítico para a produción de fosfatidilcolina (PC), fosfatidiletanolamina (PE) e fosfatidilserina (PS). Ademais, o diacilglicérido convértese en CDP-diacilglicérido, o cal é o precursor do fosfatidilglicerol (PG), do fosfatidilinositol (PI) e dos fosfoinosítidos (PIP, PIP2, PIP3).[6]
As concentracións de ácido fosfatídico mantéñense a niveis extremadamente baixos na célula pola actividade das potentes lípido fosfato fosfohidrolases (LPP).[3] Estas converten o ácido fosfatídico en diacilglicérido moi rapidamente e, como o diacilglicérido é o precursor de moitos outros lípidos, tamén el é metabolizado axiña formando lípidos de membrana. Isto significa que calquera aumento na produción de ácido fosfatídico ten que estar en correspondencia en cada momento cun aumento na actividade das LPPs e dos encimas do metabolismo dos diacilglicéridos.
O ácido fosfatídico é, por tanto, esencial para a síntese lipídica e a supervivencia da célula, aínda que, en condicións normais, mantense na célula en niveis moi baixos.
Propiedades biofísicas do ácido fosfatídico
[editar | editar a fonte]O ácido fosfatídico é o único fosfolípido que ten un grupo químico pequeno e fortemente cargado no extremo da molécula, que está situado moi próximo ao esqueleto de glicerol da molécula. Sábese que o ácido fosfatídico xoga un papel tanto na fisión de vesículas[7] coma na fusión,[8] e estas funcións poden relacionarse coas súas propiedades biofísicas.
Nos lugares da membrana onde hai evaxinación ou fusión de vesículas, a membrana é ou faise moi curvada. Un fenómeno esencial na evaxinación de vesículas, como as que transportan produtos desde o aparato de Golgi, é a creación na membrana dunha zona de estreitamento e a súa subseguinte estrangulación. Diversos estudos suxiren que este proceso pode estar dirixido por lípidos, e postulouse un papel central dos diacilglicéridos debido á súa forma molecular probablemente única na célula. A presenza de dúas cadeas de ácido graxo e a ausencia de grupos de cabeza adicionais orixina unha grande curvatura negativa na membrana.[9]
A ácido lisofosfatídico-aciltransferase (LPAAT) BARS-50 foi tamén implicada na evaxinación de vesículas desde o aparato de Golgi.[7] Isto suxire que a conversión do ácido lisofosfatídico en ácido fosfatídico podería afectar á curvatura da membrana. A actividade da LPAAT fai que se duplique o número de cadeas de ácido graxo, incrementando notablemente a área da sección do lípido que está "dentro" da membrana, á vez que o grupo de cabeza da superficie non sofre cambios. Isto pode dar lugar a unha maior curvatura negativa na membrana. Os investigadores da Universidade de Utrecht examinaron o efecto sobre a curvatura da membrana do ácido lisofosfatídico comparado co do ácido fosfatídico medindo o efecto destes na temperatura de transición da fosfatidiletanolamina das bicapas lipídicas a fases non laminares utilizando 31P-NMR (resonancia magnética nuclear).[10] A curvatura inducida por estes lípidos demostrou ser dependente non só da estrutura do ácido lisofosfatídico en relación coa do ácido fosfatídico senón tamén de propiedades dinámicas, como a hidratación dos grupos químicos de cabeza e de interaccións inter- e intramoleculares. Por exemplo, o Ca2+ pode interaccionar con dúas moléculas de ácido fosfatídico para formar un complexo neutro pero moi curvado. A neutralización das cargas das cabezas polares, que doutro modo orixinarían repulsión, e a ausencia de calquera impedimento estérico permite interaccións intermoleculares moito máis fortes entre as cadeas de ácidos graxos, orixinando microdominios ricos en ácido fosfatídico. Así, in vitro, os cambios fisiolóxicos de pH, temperatura, e concentracións de catións teñen intensos efectos sobre a curvatura da membrana inducidos polos ácidos fosfatídico e lisofosfatídico.[10] A interconversión entre o ácido lisofosfatídico, o ácido fosfatídico e os diacilglicéridos, xunto cos cambios no pH e na concentración de catións, poden causar que a membrana se dobre e desestabilice, polo que teñen unha influencia directa na fisión de membranas simplemente debido ás súas propiedades biofísicas. Non obstatante, aínda que os ácidos fosfatídico e lisofosfatídico está claro que in vitro afectan á curvatura da membrana; non está tan claro que o fagan in vivo.
O papel exercido polos ácidos fosfatídico e lisofosfatídico, e dos diacilglicéridos de promover a curvatura da membrana non impide que tamén teñan un papel no recrutamento de proteínas na membrana. Por exemplo, os requirimentos de Ca2+ para a fusión de liposomas complexos non se ve moi afectada pola adición de anexina I, pero si se reduce pola fosfolipase D (PLD). Porén, con anexina I e PLD actuando conxuntamente, o grao de fusión de membranas se ve moi aumentado, e o requirimento de Ca2+ redúcese case 1000 veces ata case os niveis fisiolóxicos.[8]
Deste modo, as funcións metabólicas, biofísicas o recrutamento e o papel sinalizador do ácido fosfatídico poden estar interrelacionadas.
Medidda da produción de ácido fosfatídico
[editar | editar a fonte]Como os ácidos fosfatídicos son rapidamente convertidos en diacilglicéridos, esas moléculas teñen unha vida moi curta na célula. Isto significa que é difícil medir a produción de ácido fosfatídico e, por tanto, estudar as súas funcións na célula. Porén, a actividade da fosfolipase D (PLD) pode medirse pola adición de alcohois primarios á célula.[11] A fosfolipase D leva a cabo entón a reacción de transfosfatidilación, en vez dunha reacción de hidrólise, producindo fosfatidil alcohois en lugar de ácidos fosfatídicos. Os fosfatidil alcohois son vías metabólicas sen saída, e poden ser doadamente extraídos e medidos. Así poden medirse a actividade da fosfolipase D e a produción de ácidos fosfatídicos, e, bloqueando a formación de ácidos fosfatídicos, interfírese a función destes nos procesos celulares.
O ácido fosfatídico como lípido de sinalización
[editar | editar a fonte]Como xa se explicou, a fosfolipase D (PLD) hidroliza a fosfatidilcolina a ácido fosfatídico e colina. Como a colina é moi abundante na célula, a actividade da PLD non está afectada significativamente polos niveis de colina; e é improbable que a colina exerza unha función sinalizadora.
O papel da activación da fosfolipase D en numerosos contextos de sinalización celular, combinada coa comentada ausencia de función sinalizadora da colina, suxire que o ácido fosfatídico é importante na sinalización. Porén, o ácido fosfatídico é convertido rapidamente en diacilglicéridos, e os diacilglicéridos tamén se sabe que son moléculas sinalizadoras. Isto formula a cuestión de se o ácido fosfatídico ten un papel directo na sinalización ou se, polo contrario, simplemente actúa como un precursor para a produción de diacilglicéridos.[12][13] Se se encontra que o ácido fosfatídico actúa soamente como un precursor dos diacilglicéridos, entón pódese facer a pregunta de por que as células terían que producir os diacilglicéridos utilizando dous encimas cando dispoñen tamén de fosfolipase C (PLC) que podería producir os diacilglicéridos nunha soa reacción.
O ácido fosfatídico producido pola PLD ou pola diacilglicérido quinase (DAGK) pode distinguirse pola adición de [γ-32P]ATP. Este método mostra se o grupo fosfato deriva da actividade da quinase recente ou se procedía da fosfatidilcolina.[14]
Aínda que o ácido fosfatídico e os diacilglicéridos son interconvertibles, non actúan nas mesmas vías metabólicas. Os estímulos que activan a PLD non activan outros encimas que actúan na ruta despois dos diacilglicéridos, e viceversa. Por exemplo, comprobouse que a adición de PLD ás membranas dá lugar á produción de ácido fosfatídico marcado con [32P] e fosfoinosítidos marcados con [32P].[15] A adición de inhibidores da diacilglicérido quinase elimina a produción de ácido fosfatídico marcado con [32P] pero non a produción de fosfoinosítidos estimulada pola PLD.
É posible que, malia que o ácido fosfatídico e os diacilglicéridos son interconvertibles, se poidan manter conxuntos separados de lípidos sinalizadores e non sinalizadores. Certos estudos suxeriron que a sinalización por diacilglicéridos está mediada polos diacilglicéridos poliinsaturados, entanto que o ácido fosfatídico derivado da actividade da PLD é monoinsaturado ou saturado. Deste xeito, o ácido fosfatídico saturado/insaturado funcional pode ser degradado hidrolizándoo para formar diacilglicéridos saturados/monoinsaturados non funcionais, e os diacilglicéridos poliinsaturados funcionais poden ser degradados converténdoos en ácido fosfatídico poliinsaturado non funcional.[12][16]
Este modelo suxire que o ácido fosfatídico e os diacilglicéridos efectores deberían poder distinguir lípidos cos mesmos grupos químicos de cabeza pero con diferentes ácidos graxos. Aínda que algunhas proteínas de unión a lipidos poden inserirse nas membranas e poderían hipoteticamente recoñecer o tipo de ácido graxo ou as propiedades adquiridas pola membrana, moitas proteínas de unión a lípidos son citosólicas e localízanse na membrana por medio da unión a só as cabezas polares dos lípidos. Quizais os distintos ácidos graxos poden afectar ao ángulo en que se orientan as cabezas polares na membrana. De ser este o caso, iso suxeriría que o dominio de unión ao ácido fosfatídico non só debe poder unirse a el especificamente senón que tamén debe poder identificar as cabezas polares que están colocadas no ángulo correcto. Calquera que for o mecanismo, dita especificidade é posible, como se ve na diacilglicérido quinase dos testículos de porco, que é específica para diacilglicéridos poliinsaturados [17], e en dúas lípido fosfato fosforilases (LPP) dos hepatocitos de ratas que desfosforilan diferentes especies de ácido fosfatídico con diferentes actividades.[18] Ademais, a estimulación da actividade SK1 pola fosfatidilserina in vitro varía moito dependendo de se estamos utilizando as especies dioleoíl (C18:1), distearoíl (C18:0), ou 1-estearoíl, 2-oleoíl da fosfatidilserina.[19] Xa que logo, parece que, aínda que o ácido fosfatídico e os diacilglicéridos son interconvertibles, distintas especies de lípidos poden ter diferentes actividades biolóxicas; e isto pode permitir que ambos os lípidos teñan vías de sinalización separadas.
Proteínas coñecidas que interaccionan co ácido fosfatídico
[editar | editar a fonte]Esfingosina quinase 1, PDE4A1, Raf1, mTOR, Proteína fosfatase 1, SHP1, Spo20p, p47phox, PKCε, fosfolipase Cβ, fosfatidilinositol (4,5)-bisfosfato.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Devlin, T. M. 2004. Bioquímica, 4ª edición. Reverté, Barcelona. ISBN 84-291-7208-4
- ↑ Liscovitch M, Czarny M, Fiucci G, Tang X (2000). "Phospholipase D: molecular and cell biology of a novel gene family". Biochem. J. 345 Pt 3 (3): 401–15. PMC 1220771. PMID 10642495. doi:10.1042/0264-6021:3450401.
- ↑ 3,0 3,1 Brindley DN, Waggoner DW (1996). "Phosphatidate phosphohydrolase and signal transduction". Chem. Phys. Lipids 80 (1–2): 45–57. PMID 8681429. doi:10.1016/0009-3084(96)02545-5.
- ↑ Brindley DN, Waggoner DW (1998). "Mammalian lipid phosphate phosphohydrolases". J. Biol. Chem. 273 (38): 24281–4. PMID 9733709. doi:10.1074/jbc.273.38.24281. Arquivado dende o orixinal o 24 de setembro de 2019. Consultado o 14 de novembro de 2011.
- ↑ Delon C; Manifava M; Wood E; et al. (2004). "Sphingosine kinase 1 is an intracellular effector of phosphatidic acid". J. Biol. Chem. 279 (43): 44763–74. PMID 15310762. doi:10.1074/jbc.M405771200.
- ↑ 6,0 6,1 6,2 Athenstaedt K, Daum G (1999). "Phosphatidic acid, a key intermediate in lipid metabolism". Eur. J. Biochem. 266 (1): 1–16. PMID 10542045. doi:10.1046/j.1432-1327.1999.00822.x. Arquivado dende o orixinal o 18 de xaneiro de 2013. Consultado o 14 de novembro de 2011. Arquivado 18 de xaneiro de 2013 en Archive.is
- ↑ 7,0 7,1 Weigert R; Silletta MG; Spanò S; et al. (1999). "CtBP/BARS induces fission of Golgi membranes by acylating lysophosphatidic acid". Nature 402 (6760): 429–33. PMID 10586885. doi:10.1038/46587.
- ↑ 8,0 8,1 Blackwood RA; Smolen JE; Transue A; et al. (1997). "Phospholipase D activity facilitates Ca2+-induced aggregation and fusion of complex liposomes". Am. J. Physiol. 272 (4 Pt 1): C1279–85. PMID 9142853. Arquivado dende o orixinal o 24 de setembro de 2019. Consultado o 14 de novembro de 2011.
- ↑ Shemesh T, Luini A, Malhotra V, Burger KN, Kozlov MM (2003). "Prefission Constriction of Golgi Tubular Carriers Driven by Local Lipid Metabolism: A Theoretical Model". Biophys. J. 85 (6): 3813–27. Bibcode:2003BpJ....85.3813S. PMC 1303683. PMID 14645071. doi:10.1016/S0006-3495(03)74796-1. Arquivado dende o orixinal o 07 de maio de 2008. Consultado o 14 de novembro de 2011. Arquivado 07 de maio de 2008 en Archive.is
- ↑ 10,0 10,1 Kooijman EE, Chupin V, de Kruijff B, Burger KN (2003). "Modulation of membrane curvature by phosphatidic acid and lysophosphatidic acid". Traffic 4 (3): 162–74. PMID 12656989. doi:10.1034/j.1600-0854.2003.00086.x. Arquivado dende o orixinal o 18 de xaneiro de 2013. Consultado o 14 de novembro de 2011. Arquivado 18 de xaneiro de 2013 en Archive.is
- ↑ Morris AJ, Frohman MA, Engebrecht J (1997). "Measurement of phospholipase D activity". Anal. Biochem. 252 (1): 1–9. PMID 9324933. doi:10.1006/abio.1997.2299.
- ↑ 12,0 12,1 Hodgkin MN, Pettitt TR, Martin A, Michell RH, Pemberton AJ, Wakelam MJ (1998). "Diacylglycerols and phosphatidates: which molecular species are intracellular messengers?". Trends Biochem. Sci. 23 (6): 200–4. PMID 9644971. doi:10.1016/S0968-0004(98)01200-6.
- ↑ Wakelam MJ (1998). "Diacylglycerol--when is it an intracellular messenger?". Biochim. Biophys. Acta 1436 (1–2): 117–26. PMID 9838074. doi:10.1016/S0005-2760(98)00123-4.
- ↑ Cockcroft S, Baldwin JM, Allan D (1984). "The Ca2+-activated polyphosphoinositide phosphodiesterase of human and rabbit neutrophil membranes". Biochem. J. 221 (2): 477–82. PMC 1144062. PMID 6089740.
- ↑ Moritz A, De Graan PN, Gispen WH, Wirtz KW (1992). "Phosphatidic acid is a specific activator of phosphatidylinositol-4-phosphate kinase". J. Biol. Chem. 267 (11): 7207–10. PMID 1313792. Arquivado dende o orixinal o 24 de setembro de 2019. Consultado o 14 de novembro de 2011.
- ↑ Bocckino SB, Blackmore PF, Wilson PB, Exton JH (1987). "Phosphatidate accumulation in hormone-treated hepatocytes via a phospholipase D mechanism". J. Biol. Chem. 262 (31): 15309–15. PMID 3117799. Arquivado dende o orixinal o 24 de setembro de 2019. Consultado o 14 de novembro de 2011.
- ↑ Hodgkin MN, Gardner SD, Rose S, Paterson A, Martin A, Wakelam MJ (1997). "Purification and characterization of sn-1-stearoyl-2-arachidonoylglycerol kinase from pig testes". Biochem. J. 322 ( Pt 2) (Pt 2): 529–34. PMC 1218222. PMID 9065773.
- ↑ Fleming IN, Yeaman SJ (1995). "Purification and characterization of N-ethylmaleimide-insensitive phosphatidic acid phosphohydrolase (PAP2) from rat liver". Biochem. J. 308 ( Pt 3) (Pt 3): 983–9. PMC 1136819. PMID 8948459.
- ↑ Olivera A, Rosenthal J, Spiegel S (1996). "Effect of acidic phospholipids on sphingosine kinase". J. Cell. Biochem. 60 (4): 529–37. PMID 8707892. doi:10.1002/(SICI)1097-4644(19960315)60:4<529::AID-JCB9>3.0.CO;2-U.
