Fusión de vesículas
A fusión de vesículas é a fusión dunha vesícula con outras vesículas ou cunha parte dunha membrana da célula. No último caso, adoita ser o paso final da secreción por medio de vesículas secretoras, que expulsan os seus contidos fóra da célula por exocitose. As vesículas poden tamén fusionarse con outros compartimentos celulares, como os lisosomas ou o aparato de Golgi.
A fusión de vesículas pode depender das proteínas SNARE cando se produce un incremento da concentración de calcio intracelular (Ca2+). Hai varias teorías para explicar a fusión de vesículas.
Causantes
[editar | editar a fonte]Os estímulos que desencadean a fusión de vesículas actúan incrementando o Ca2+ intracelular.
- As vesículas sinápticas realizan a fusión de vesículas cando un impulso nervioso chega á zona de sinapse, activando os canles de calcio dependentes de voltaxe, que causan o influxo de Ca2+ cara ao interior da célula.
- No sistema endócrino, moitas hormonas son liberadas por medio da unión de hormonas liberadoras a receptores acoplados á proteína G na subunidade Gq alfa, activando así a vía IP3/DAG, o que incrementa o Ca2+. Exemplos deste mecanismo son:
- A hormona liberadora da gonadotropina [1]
- A hormona liberadora da tirotropina[1]
- A hormona liberadora da hormona do crecemento[1] (neste caso é unha vía menor, xa que a principal é a vía dependente do AMPc [2])
Sistemas modelo
[editar | editar a fonte]Os químico físicos estudaron sistemas modelo consistentes en membranas dun só fosfolípido ou unha mestura. A cardiolipina encóntrase principalmente nas membranas mitocondriais, e os ións calcio xogan un importante papel nos procesos respiratorios mediados polas mitocondrias. Propúxose que as forzas implicadas explican[3] este proceso en termos de nucleación por aglomeración de entidades supramoleculares máis pequenas ou cambios de fase na estrutura das biomembranas.[4]
Mecanismos
[editar | editar a fonte]Fusión na fenda sináptica
[editar | editar a fonte]Na fusión de vesículas sinápticas, a vesícula debe encontrarse a poucos nanómetros da membrana diana para que comece o proceso de fusión. Esta proximidade permite que a membrana celular e a da vesícula intercambien lípidos, no cal median certas proteínas que retiran a auga que está entre a unión en formación. Unha vez que a vesícula está en posición debe esperar ata que o Ca2+ entre na célula por causa da propagación dun potencial de acción á membrana presináptica.[5] O Ca2+ únese nas neuronas a proteínas específicas, unha das cales é a sinaptotagmina, o cal desencadea a completa fusión da vesícula coa membrana diana.[6]
Tamén se cre que as proteínas SNARE axudan na mediación para determinar que membrana é a diana de que vesícula.[7]
Formación do poro eproteínas SNARE
[editar | editar a fonte]- Artigo principal: SNARE.

A ensamblaxe de proteínas SNARE en complexos "trans" probablemente fai de ponte entre as bicapas lipídicas das membranas que pertencen á célula e ao gránulo secretor, achegándoas ata estaren en estreita proximidade e inducindo a súa fusión. O influxo do calcio ao interior da célula desencadea a terminación da reacción de ensamblaxe, que está mediada por unha interacción entre o suposto sensor de calcio, a sinaptotagmina, con lípidos de membrana e/ou o complexo SNARE parcialmente ensamblado.
Unha hipótese implica na fusión a molécula complexina do complexo SNARE e a súa interacción coa molécula sinaptotagmina.[9] Nesta hipótese coñecida como a hipótese da "grampa" ("clamp"), a presenza de complexina normalmente inhibe a fusión da vesícula coa membrana celular. Porén, a unión de ións calcio á sinaptotagmina desencadea que a complexina sexa liberada ou inactivada, de modo que a vesícula queda entón libre para fusionarse.[10]
Segundo a hipótese da "cremalleira" ("zipper"), a ensamblaxe do complexo empeza nas partes N-terminais dos motivos SNARE e avanza cara ao C-terminal por onde se ancoran as proteínas interaccionantes na membrana. A formación do complexo "trans"-SNARE realízase por medio dun complexo intermediario composto de SNAP-25 e sintaxina 1, no que posteriormente se acomoda a sinaptobrevina 2 (os mencionados isotipos de sintaxina e sinaptobrevina participan na liberación de neuromediadores neuronais).
Baseándose na estabilidade do complexo cis-SNARE resultante, postulouse que a enerxía liberada durante o proceso de ensamblaxe serve como medio para superar as forzas repulsivas entre as membranas. Hai varios modelos que propoñen unha explicación do seguinte paso, que é a formación dun talo e o poro de fusión, pero a natureza exacta deste proceso segue debaténdose. Dous dos modelos máis importantes sobre a formación do poro de fusión son as teorías do poro de fusión tapizado de lípido e a do poro de fusión tapizado de proteína.[11]
Teoría do poro de fusión tapizado de lípido
[editar | editar a fonte]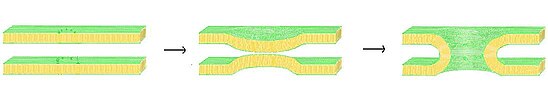
Un posible modelo para a formación do poro de fusión é a teoría do poro de fusión tapizado de lípido. Neste modelo, unha vez que as membranas se achegaron ata estar o suficientemente próximas por medio do mecanismo de "cremalleira" do complexo SNARE, a fusión das membranas ocorre espontaneamente. Cando as dúas membranas están á distancia crítica, os grupos das cabezas polares dos lípidos dunha membrana poden fusionarse coa membrana oposta.[12] No modelo de poro de fusión tapizado de lípido, o complexo SNARE actúa como un armazón, tirando da membrana e facendo que ambas as membranas se enruguen para que así cheguen a estar á distancia de fusión crítica. A medida que as dúas membranas empezan a fusionarse, orixínase un talo tapizado de lípido, que se expande radialmente cara a fóra conforma avanza a fusión.
Aínda que é posible a formación dun poro de fusión tapizado de lípido e pode presentar todas as propiedades observadas na formación de poros temperáns, non hai datos de abondo como para probar que este é o único método de formación.[13] Actualmente non se propuxo ningún mecanismo sobre a regulación intercelular para a flutuación de poros tapizados de lípido, e produciría problemas máis difíciles como o efecto chamado "bicar e correr" cando o comparamos coa teoría alternativa dos poros tapizados de proteína. A efectividade dos poros tapizados de lípido sería moi dependente da composición de ambas as membranas, e o seu éxito ou fracaso podería variar enormemente cos cambios de elasticidade e rixidez.[13]
Teoría do poro de fusión tapizado de proteína
[editar | editar a fonte]Outro posible modelo para explicar a formación do poro de fusión é a teoría do poro de fusión tapizado de proteína. Neste modelo, despois da activación da sinaptotagmina polo calcio, xúntanse varios complexos SNARE para formar unha estrutura en anel, no que a sinaptobrevina forma o poro na membrana da vesícula e a sintaxina forma o poro na membrana da célula.[14] A medida que o poro inicial se expande incorpora lípidos de ambas as bicapas, o que finalmente ten como resultado a fusión completa das dúas membranas. O complexo SNARE ten un papel moito máis activo na teoría do poro de fusión tapizado de proteína, e dado que o poro consta inicialmente só de proteínas SNARE, o poro pode doadamente sufrir unha regulación intercelular, facendo que os mecanismos de flutuación e de "bicar e correr" sexan facilmente alcanzables.[9]
Un poro tapizado de proteína satisfai perfectamente todos os requirimentos observados dun poro de fusión temperán, e aínda que hai algúns datos que non apoian esta teoría,[14] non existen datos dabondo para consideralo o principal método de fusión. Tamén hai que indicar que un poro tapizado de proteína require polo menos cinco copias de complexos SNARE, aínda que se observou a fusión con só dous.[14]
En ambas as teorías a función do complexo SNARE é basicamene a mesma, e cómpre o complexo SNARE completo para iniciar a fusión. Porén, probouse que in vitro a sintaxina por si soa é suficiente para impulsar a fusión espontánea independente do calcio de vesículas sinápticas que conteñan v-SNAREs.[15] Isto suxire que na exocitose neuronal dependente de Ca2+ a sinaptotagmina é un regulador dual, que en ausencia de ións Ca2+ inhibe a dinámica dos SNARE, mentres que en presenza de ións Ca2+ actúa como agonista no proceso de fusión de membranas.
Hipótese de bicar e correr
[editar | editar a fonte]Nas vesículas sinápticas, algúns neuroquímicos suxeriron que as vesículas ocasionalmente pode que non se fusionen completamente coas membranas presinápticas na liberación de neurotransmisores na fenda sináptica. A controversia aquí está en se a endocitose ocorre sempre ou non sempre cando se volve a formar a vesícula despois da liberación do neurotransmisor. Outro mecanismo proposto para a liberación do contido das vesículas ao fluído extracelular é a chamada fusión de bicar e correr (kiss-and-run fusion)
Hai varios datos que indican que as vesículas só poden formar un pequeno poro na membrana presináptica, que permite que se libere o contido por difusión normal durante un curto tempo antes de que se retiren de novo ao interior da célula presináptica. Este mecanismo pode ser similar á endocitose mediada por clatrina. Tamén se propuxo que a vesícula non necesita retornar a un endosoma para volver a encherse, aínda que non se comprende totalmente o mecanismo por medio do cal se volvería a encher. Tamén hai que salientar que isto non exclúe a fusión completa de vesículas, senón que só afirma que ambos os mecanismos operan nas fendas sinápticas.
O mecanismo de "bicar e correr" sábese que ocorre nas células endócrinas, aínda que non foi observado directamente en espazos sinápticos.[16]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 Page 237 in: Costanzo, Linda S. (2007). Physiology. Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 0-7817-7311-3.
- ↑ Walter F., PhD. Boron (2003). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. p. 1300. ISBN 1-4160-2328-3.
- ↑ Papahadjopoulos, Demetrios (1990). "Molecular mechanisms of calcium-induced membrane fusion". Journal of Bioenergetics and Biomembranes 22 (2): 157–179. PMID 2139437. doi:10.1007/BF00762944.
- ↑ "sciencedirect". Arquivado dende o orixinal o 11 de setembro de 2012. Consultado o 19 de marzo de 2016.
- ↑ Pigino, Gustavo; Morfini, Gerardo; Brady, Scott (2006). "Chapter 9: Intracellular Trafficking". En Siegal, George J.; Albers, R. Wayne; Brady, Scott T.; et al. Basic Neurochemistry: Molecular, Cellular and Medical Aspects (Textbook) (7th ed.). Burlington, MA: Elsevier Academic Press. p. 143. ISBN 0-12-088397-X.
- ↑ Pigino et al. p 158
- ↑ Pigino et al. p.143
- ↑ Georgiev, Danko D .; James F . Glazebrook (2007). "Subneuronal processing of information by solitary waves and stochastic processes". En Lyshevski, Sergey Edward. Nano and Molecular Electronics Handbook. Nano and Microengineering Series. CRC Press. pp. 17–1–17–41. ISBN 978-0-8493-8528-5. Arquivado dende o orixinal o 16 de xaneiro de 2016. Consultado o 19 de marzo de 2016.
- ↑ 9,0 9,1 Kümmel, D.; Krishnakumar, S. S.; Radoff, D. T.; Li, F.; Giraudo, C. G.; Pincet, F.; Rothman, J. E.; Reinisch, K. M. (2011). "Complexin cross-links prefusion SNAREs into a zigzag array". Nature Structural & Molecular Biology 18 (8): 927–933. PMC 3410656. PMID 21785414. doi:10.1038/nsmb.2101.
- ↑ Richmond, Janet. "Synapse Function".
- ↑ Jackson, Meyer B.; Chapman, Edwin R. "FUSION PORES AND FUSION MACHINES IN CA 2+ -TRIGGERED EXOCYTOSIS". Annual Review of Biophysics and Biomolecular Structure 35 (1): 135–160. doi:10.1146/annurev.biophys.35.040405.101958.
- ↑ Marrink, Siewert J.; Mark, Alan E. (2003-09-01). "The Mechanism of Vesicle Fusion as Revealed by Molecular Dynamics Simulations". Journal of the American Chemical Society 125 (37): 11144–11145. ISSN 0002-7863. doi:10.1021/ja036138+.
- ↑ 13,0 13,1 Nanavati, C; Markin, V S; Oberhauser, A F; Fernandez, J M (1992-10-01). "The exocytotic fusion pore modeled as a lipidic pore.". Biophysical Journal 63 (4): 1118–1132. ISSN 0006-3495. PMC 1262250. PMID 1420930.
- ↑ 14,0 14,1 14,2 Chang, Che-Wei; Hui, Enfu; Bai, Jihong; Bruns, Dieter; Chapman, Edwin R.; Jackson, Meyer B. (2015-04-08). "A Structural Role for the Synaptobrevin 2 Transmembrane Domain in Dense-Core Vesicle Fusion Pores". The Journal of Neuroscience 35 (14): 5772–5780. ISSN 0270-6474. PMC 4388931. PMID 25855187. doi:10.1523/JNEUROSCI.3983-14.2015.
- ↑ Woodbury DJ, Rognlien K (2000). "The t-SNARE syntaxin is sufficient for spontaneous fusion of synaptic vesivles to planar membranes" (PDF). Cell Biology International 24 (11): 809–818. PMID 11067766. doi:10.1006/cbir.2000.0631. Arquivado dende o orixinal (PDF) o 19 de xullo de 2011. Consultado o 19 de marzo de 2016.
- ↑ Piginio et al. pp. 161-162
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- SNARE
- Zona activa presináptica
- Liposomas, usados como modelos de células artificiais en estudos de fusión de membranas.
