Termoxenina
| UCP1 | |||
|---|---|---|---|
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB | ||
| Identificadores | |||
| Nomenclatura | Outros nomes
| ||
| Identificadores externos | |||
| Locus | Cr. 4 q31.1 | ||
| Padrón de expresión de ARNm | |||
 | |||
| Máis información | |||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
A termoxenina (/ ʃ /), chamada polos seus descubridores proteína desacoplante e agora coñecida como proteína desacoplante 1 ou UCP1,[1] é unha proteína transportadora mitocondrial que se atopa nas mitocondrias do tecido adiposo marrón (graxa marrón). Utilízase para xerar calor por termoxénese sen tremelicar, e fai unha contribución cuantitativamente importante para contrarrestar a perda de calor nos bebés, que se tende a producir neles debido á súa alta proporción área-volume.
Mecanismo[editar | editar a fonte]
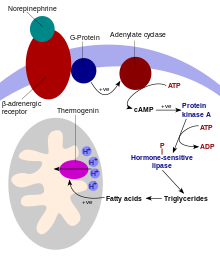
A UCP1 pertence á familia da UCP, formada por proteínas transmembrana que fan diminuír o gradiente de protóns xerado na fosforilación oxidativa. Fan isto incrementando a permeabilidade da membrana mitocondrial interna, o que permite que os protóns que foron bombeados ao espazo intermembranoso regresen á matriz mitocondrial. A xeración de calor mediada pola UCP1 na graxa marrón desacopla a cadea respiratoria, posibilitando unha rápida oxidación dos substratos cunha baixa taxa de produción de ATP. A UCP1 está realcionada con outros transportadores de metabolitos mitocondriais, como o translocador de nucleótidos de adenina, que é unha canle de protóns da membrana mitocondrial interna que permite a translocación de protóns desde o espazo intermembranoso mitocondrial á matriz mitocondrial. A expresión da UCP1 está restrinxida ao tecido adiposo marrón, onde proporciona un mecanismo para a enorme capacidade xeradora de calor do tecido.
A UCP1 é activada nas células da graxa marrón pola presenza de ácidos graxos e inhibida por nucleótidos.[2] Os ácidos graxos son liberados conforme á seguinte fervenza de sinalización: as terminais do sistema nervioso simpático liberan norepinefrina sobre un receptor β3 adrenérxico da membrana plasmática. Isto activa a adenilil ciclase, a cal cataliza a conversión de ATP en AMP cíclico (AMPc). O AMPc activa a proteína quinase A, causando que as súas subunidades C activas se liberen das súas subunidades R regulatorias. A proteína quinase A activada, á súa vez, fosforila a triacilglicerol lipase, o cal causa a súa activación. Esta lipase converte triacilglicerois en ácidos graxos libres, o cal é o que activa a UCP1, superando a inhibición causada polos nucleótidos púricos (GDP e ADP). No momento da terminación da termoxénese, a termoxenina é inactivada e os ácidos graxos residuais son desruídos por oxidación, o que fai que a célula volva a reiniciar o seu estado de conservación de enerxía normal.

A UCP1 é moi similar á proteína transportadora de ATP/ADP, ou translocador de nucleótidos de adenina (ANT).[3][4] O modelo de acceso alternante proposto para a UCP1 baséase no mecanismo similar do ANT.[5] O substrato chega á proteína UCP1 medio aberta desde o lado citoplásmico da membrana mitocondrial, a proteína pecha o seu lado citoplásmico de modo que o substrato queda encerrado na proteína, e despois o lado da matriz da proteína abre, permitindo que o substrato sexa liberado na matriz mitocondrial. A apertura e peche da proteína é realizado polo apertamento e afrouxamento de pontes salinas na superficie que dá á membrana da proteína. A aplicación deste modelo similar ao do ANT á UCP1 fundaméntase nos moitos residuos conservados entre as dúas proteínas que están implicados activamente no transporte de substratos a través da membrana. Ambas as proteínas son proteínas integrais de membrana localizadas na membrana mitocondrial interna, e teñen un padrón similar de pontes salinas, e residuos de prolina e de aminoácidos hidrófobos ou aromáticos que poden pecharse ou abrirse cando están no estado citoplásmico ou da matriz.[3]
Estrutura[editar | editar a fonte]

A estrutura atómica da proteína desacoplante 1 humana (UCP1) foi resolta por microscopia crioelectrónica.[6] A estrutura ten o típico pregamento dun membro da familia SLC25.[7][8] A UCP1 está bloqueada no estado citoplásmico-aberto polo guanosín trifosfato de maneira dependente do pH, impedindo a fuga de protóns.[6]
Evolución[editar | editar a fonte]
A UCP1 exprésase no tecido adiposo marrón, que se encontra funcionalmente nos euterios. O xene da UCP1 ou termoxenina orixinouse probablemente nun antepasado dos vertebrados modernos, pero inicialmente non permitía a ese devanceiro dos vertebrados utilizar a termoxénese sen tremelicar para quentarse. Non foi ata que se selleccionou adaptativamente a xeración de calor nos mamíferos placentarios descendentes dese antepasadocomún que evolucionou unha UCP1 coa súa actual función no tecido adiposo marrón para proporcionar calor adicional.[9] Aínda que a UCP1 exerce un papel termoxénico clave nunha ampla variedade de mamíferos placentarios, especialmente os que teñen corpos pequenos e nos que hibernan, o xene da UCP1 perdeu a súa funcionalidade en varias liñaxes de corpo grande (por exemplo, cabalos, elefantes, sirenios, baleas e hiracoideos) e en liñaxes con taxas metabólicas baixas (por exemplo, pangolíns, armadillos, preguiceiros e osos formigueiros).[10] Recentes descubrimentos de ortólogos non xeradores de calor da UCP1 en peixes e marsupiais, que son outros descendentes dos antepasados dos modernos vertebrados, mostran que este xene pasou a todos os vertebrdos modernos, pero á parte dos mamíferos placentarios, en ningún grupo máis produciu esta capacidade.[11] Isto suxire tamén que a UCP1 tiña un propósito orixinal diferente e, de feito, análises filoxenéticas e de secuencias indican que a UCP1 probablemente é unha forma mutada dunha proteína transportadora de dicarboxilatos que se adaptou para a termoxénese en mamíferos placentarios.[12]
Historia[editar | editar a fonte]
Investigadores que na década de 1960 que investigaban o tecido adiposo marrón (graxa marrón), atoparon que este tecido ademais de producir máis calor que o típico noutros tecidos, parecía cortacircuitar ou desacoplar o acoplamento da respiración.[13] A proteína desacoplante 1 decubrírona en 1976 David G. Nicholls, Vibeke Bernson e Gillian Heaton, e o descubrimento foi publicado en 1978 e demostrouse que era a proteína responsable para este efecto de desacoplamento.[14] A UCP1 foi posteriormente purificado por primeira vez en 1980 e clonouse por primeira vez en 1988.[15][16]
A proteína desacoplante 2 (UCP2), un homólogo da UCP1, identificouse en 1997. A UCP2 localízase nunha ampla variedade de tecidos e pénsase que está implicada na regulación de especies reactivas do oxíxeno. Na pasada década, identificáronse tres homólogos adicionais da UCP1, incluíndo a UCP3, UCP4 e UCP5 (tamén chamada BMCP1 ou SLC25A14).
Importancia clínica[editar | editar a fonte]
Os métodos de entrega da UCP1 ás células por terapia de transferencia xénica ou os métodos para a súa regulación á alza foron unhas importantes liñas de investigación para o tratamento da obesidade, debido á súa capacidade de disipar o exceso de almacenamentos metabólicos, como a graxa.[17]
Notas[editar | editar a fonte]
- ↑ "Entrez Gene: UCP1 uncoupling protein 1 (mitochondrial, proton carrier)".
- ↑ Fedorenko, Andriy; Lishko, Polina V.; Kirichok, Yuriy (2012-10-12). "Mechanism of Fatty-Acid-Dependent UCP1 Uncoupling in Brown Fat Mitochondria". Cell (en inglés) 151 (2): 400–413. ISSN 0092-8674. PMC 3782081. PMID 23063128. doi:10.1016/j.cell.2012.09.010.
- ↑ 3,0 3,1 Crichton, Paul G.; Lee, Yang; Kunji, Edmund R. S. (2017-03-01). "The molecular features of uncoupling protein 1 support a conventional mitochondrial carrier-like mechanism". Biochimie. UCP1: 40 years and beyond 134: 35–50. ISSN 0300-9084. PMC 5395090. PMID 28057583. doi:10.1016/j.biochi.2016.12.016.
- ↑ Ruprecht, J.J.; Kunji, E.R.S. (2021). "Structural mechanism of transport of mitochondrial carriers". Annu Rev Biochem 90: 535–558. PMID 33556281. doi:10.1146/annurev-biochem-072820-020508.
- ↑ Ryan, Renae M.; Vandenberg, Robert J. (2016-03-01). "Elevating the alternating-access model". Nature Structural & Molecular Biology (en inglés) 23 (3): 187–189. ISSN 1545-9985. PMID 26931415. doi:10.1038/nsmb.3179.
- ↑ 6,0 6,1 Jones, S.A.; Gogoi, P.; Ruprecht, J.J.; King, M.S.; Lee, Y.; Zogg, T.; Pardon, E.; Chand, D.; Steel, S.; Coperman, D.M.; Cotrim, C.A.; Steyaert, J.; Crichton, P.G.; Moiseenkova-Bell, V.; Kunji, E.R.S. (2023). "Structural basis of purine nucleotide inhibition of human uncoupling protein 1". Sci Adv 9 (22): eadh4251. Bibcode:2023SciA....9H4251J. PMC 10413660. PMID 37256948. doi:10.1126/sciadv.adh4251.
- ↑ Ruprecht, J.J.; Kunji, E.R.S. (2020). "The SLC25 Mitochondrial Carrier Family: Structure and Mechanism". Trends Biochem. Sci. 45 (3): 244–258. PMC 7611774. PMID 31787485. doi:10.1016/j.tibs.2019.11.001.
- ↑ Kunji, E.R.S.; King, M.S.; Ruprecht, J.J.; Thangaratnarajah, C. (2020). "The SLC25 Carrier Family: Important Transport Proteins in Mitochondrial Physiology and Pathology". Physiology (Bethesda) 35 (5): 302–327. PMC 7611780. PMID 32783608. doi:10.1152/physiol.00009.2020.
- ↑ Klingenspor, Martin; Fromme, Tobias; Hughes, David A.; Manzke, Lars; Polymeropoulos, Elias; Riemann, Tobias; Trzcionka, Magdalene; Hirschberg, Verena; Jastroch, Martin (2008-07-01). "An ancient look at UCP1". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 15th European Bioenergetics Conference 2008 1777 (7): 637–641. ISSN 0005-2728. PMID 18396149. doi:10.1016/j.bbabio.2008.03.006.
- ↑ Gaudry, Michael J.; Jastroch, Martin; Treberg, Jason R.; Hofreiter, Michael; Paijmans, Johanna L.A.; Starrett, James; Wales, Nathan; Signore, Anthony V.; Springer, Mark S.; Campbell, Kevin L. (2017-07-12). "Inactivation of thermogenic UCP1 as a historical contingency in multiple placental mammal clades". Science Advances 3 (7): e16028781. Bibcode:2017SciA....3E2878G. PMC 5507634. PMID 28706989. doi:10.1126/sciadv.1602878.
- ↑ Saito, Shigeru; Saito, Claire Tanaka; Shingai, Ryuzo (2008-01-31). "Adaptive evolution of the uncoupling protein 1 gene contributed to the acquisition of novel nonshivering thermogenesis in ancestral eutherian mammals". Gene 408 (1): 37–44. ISSN 0378-1119. PMID 18023297. doi:10.1016/j.gene.2007.10.018.
- ↑ Robinson, Alan J.; Overy, Catherine; Kunji, Edmund R. S. (2008-11-18). "The mechanism of transport by mitochondrial carriers based on analysis of symmetry". Proceedings of the National Academy of Sciences (en inglés) 105 (46): 17766–17771. Bibcode:2008PNAS..10517766R. ISSN 0027-8424. PMC 2582046. PMID 19001266. doi:10.1073/pnas.0809580105.
- ↑ Ricquier, Daniel (2017-03-01). "UCP1, the mitochondrial uncoupling protein of brown adipocyte: A personal contribution and a historical perspective". Biochimie. UCP1: 40 years and beyond 134: 3–8. ISSN 0300-9084. PMID 27916641. doi:10.1016/j.biochi.2016.10.018.
- ↑ Nicholls DG, Bernson VS, Heaton GM (1978). "The Identification of the Component in the Inner Membrane of Brown Adipose Tissue Mitochondria Responsible for Regulating Energy Dissipation". Effectors of Thermogenesis. Experientia Supplementum 32. pp. 89–93. ISBN 978-3-0348-5561-7. PMID 348493. doi:10.1007/978-3-0348-5559-4_9. Erro no estilo Vancouver: wikilink (Axuda)
- ↑ Kozak LP, Britton JH, Kozak UC, Wells JM (setembro de 1988). "The mitochondrial uncoupling protein gene. Correlation of exon structure to transmembrane domains". The Journal of Biological Chemistry 263 (25): 12274–7. PMID 3410843. doi:10.1016/S0021-9258(18)37751-2. Arquivado dende o orixinal o 14 de marzo de 2022. Consultado o 21 de outubro de 2023.
- ↑ Bouillaud F, Raimbault S, Ricquier D (decembro de 1988). "The gene for rat uncoupling protein: complete sequence, structure of primary transcript and evolutionary relationship between exons". Biochemical and Biophysical Research Communications 157 (2): 783–92. PMID 3202878. doi:10.1016/S0006-291X(88)80318-8.
- ↑ Kozak LP, Anunciado-Koza R (decembro de 2008). "UCP1: its involvement and utility in obesity". International Journal of Obesity 32 (Suppl 7): S32–8. PMC 2746324. PMID 19136989. doi:10.1038/ijo.2008.236.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
- 2,4-Dinitrofenol (Unha pequena molécula sintética que traslada protóns con efectos similares)
Bibliografía[editar | editar a fonte]
- Macher, Gabriel; Koehler, Melanie; Rupprecht, Anne; Kreiter, Jürgen; Hinterdorfer, Peter; Pohl, Elena E. (marzo de 2018). "Inhibition of mitochondrial UCP1 and UCP3 by purine nucleotides and phosphate". Biochimica et Biophysica Acta (BBA) - Biomembranes 1860 (3): 664–672. PMC 6118327. PMID 29212043. doi:10.1016/j.bbamem.2017.12.001.
- Urbánková, Eva; Voltchenko, Anna; Pohl, Peter; Ježek, Petr; Pohl, Elena E. (29 de agosto de 2003). "Transport Kinetics of Uncoupling Proteins". Journal of Biological Chemistry 278 (35): 32497–32500. PMID 12826670. doi:10.1074/jbc.M303721200.
- Ricquier D, Bouillaud F (Jan 2000). "The uncoupling protein homologues: UCP1, UCP2, UCP3, StUCP and AtUCP". The Biochemical Journal. 345 Pt 2 (2): 161–79. PMC 1220743. PMID 10620491. doi:10.1042/0264-6021:3450161.
- Muzzin P (Apr 2002). "The uncoupling proteins". Annales d'Endocrinologie 63 (2 Pt 1): 106–10. PMID 11994670.
- Del Mar Gonzalez-Barroso M, Ricquier D, Cassard-Doulcier AM (Oct 2000). "The human uncoupling protein-1 gene (UCP1): present status and perspectives in obesity research". Obesity Reviews 1 (2): 61–72. PMID 12119988. doi:10.1046/j.1467-789x.2000.00009.x.
- Cassard AM, Bouillaud F, Mattei MG, Hentz E, Raimbault S, Thomas M, Ricquier D (Jul 1990). "Human uncoupling protein gene: structure, comparison with rat gene, and assignment to the long arm of chromosome 4". Journal of Cellular Biochemistry 43 (3): 255–64. PMID 2380264. doi:10.1002/jcb.240430306.
- Bouillaud F, Villarroya F, Hentz E, Raimbault S, Cassard AM, Ricquier D (Jul 1988). "Detection of brown adipose tissue uncoupling protein mRNA in adult patients by a human genomic probe". Clinical Science 75 (1): 21–7. PMID 3165741. doi:10.1042/cs0750021.
- Oppert JM, Vohl MC, Chagnon M, Dionne FT, Cassard-Doulcier AM, Ricquier D, Pérusse L, Bouchard C (Aug 1994). "DNA polymorphism in the uncoupling protein (UCP) gene and human body fat". International Journal of Obesity and Related Metabolic Disorders 18 (8): 526–31. PMID 7951471.
- Clément K, Ruiz J, Cassard-Doulcier AM, Bouillaud F, Ricquier D, Basdevant A, Guy-Grand B, Froguel P (Dec 1996). "Additive effect of A-->G (-3826) variant of the uncoupling protein gene and the Trp64Arg mutation of the beta 3-adrenergic receptor gene on weight gain in morbid obesity". International Journal of Obesity and Related Metabolic Disorders 20 (12): 1062–6. PMID 8968850.
- Schleiff E, Shore GC, Goping IS (Mar 1997). "Human mitochondrial import receptor, Tom20p. Use of glutathione to reveal specific interactions between Tom20-glutathione S-transferase and mitochondrial precursor proteins". FEBS Letters 404 (2–3): 314–8. PMID 9119086. doi:10.1016/S0014-5793(97)00145-2.
- Urhammer SA, Fridberg M, Sørensen TI, Echwald SM, Andersen T, Tybjaerg-Hansen A, Clausen JO, Pedersen O (Dec 1997). "Studies of genetic variability of the uncoupling protein 1 gene in Caucasian subjects with juvenile-onset obesity". The Journal of Clinical Endocrinology and Metabolism 82 (12): 4069–74. PMID 9398715. doi:10.1210/jcem.82.12.4414.
- Jezek P, Urbánková E (Jan 2000). "Specific sequence of motifs of mitochondrial uncoupling proteins". IUBMB Life 49 (1): 63–70. PMID 10772343. doi:10.1080/713803586.
- Mori H, Okazawa H, Iwamoto K, Maeda E, Hashiramoto M, Kasuga M (Mar 2001). "A polymorphism in the 5' untranslated region and a Met229-->Leu variant in exon 5 of the human UCP1 gene are associated with susceptibility to type II diabetes mellitus". Diabetologia 44 (3): 373–6. PMID 11317671. doi:10.1007/s001250051629.
- Nibbelink M, Moulin K, Arnaud E, Duval C, Pénicaud L, Casteilla L (Dec 2001). "Brown fat UCP1 is specifically expressed in uterine longitudinal smooth muscle cells". The Journal of Biological Chemistry 276 (50): 47291–5. PMID 11572862. doi:10.1074/jbc.M105658200.
- Echtay KS, Roussel D, St-Pierre J, Jekabsons MB, Cadenas S, Stuart JA, Harper JA, Roebuck SJ, Morrison A, Pickering S, Clapham JC, Brand MD (Jan 2002). "Superoxide activates mitochondrial uncoupling proteins". Nature 415 (6867): 96–9. Bibcode:2002Natur.415...96E. PMID 11780125. doi:10.1038/415096a.
- Rousset S, del Mar Gonzalez-Barroso M, Gelly C, Pecqueur C, Bouillaud F, Ricquier D, Cassard-Doulcier AM (maio de 2002). "A new polymorphic site located in the human UCP1 gene controls the in vitro binding of CREB-like factor". International Journal of Obesity and Related Metabolic Disorders 26 (5): 735–8. PMID 12032762. doi:10.1038/sj.ijo.0801973.
- Rim JS, Kozak LP (Sep 2002). "Regulatory motifs for CREB-binding protein and Nfe2l2 transcription factors in the upstream enhancer of the mitochondrial uncoupling protein 1 gene". The Journal of Biological Chemistry 277 (37): 34589–600. PMID 12084707. doi:10.1074/jbc.M108866200.
- Kieć-Wilk B, Wybrańska I, Malczewska-Malec M, Leszczyńska-Gołabek L, Partyka L, Niedbał S, Jabrocka A, Dembińska-Kieć A (Sep 2002). "Correlation of the -3826A >G polymorphism in the promoter of the uncoupling protein 1 gene with obesity and metabolic disorders in obese families from southern Poland". Journal of Physiology and Pharmacology 53 (3): 477–90. PMID 12375583.
Ligazóns externas[editar | editar a fonte]
- Seaweed anti-obesity tablet hope (BBC - Menciónase a termoxenina como parte do proceso)
- thermogenin Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
