Concanavalina A
| Concanavalina A | |
|---|---|
| |
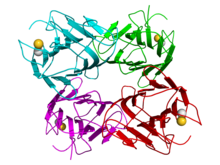
| Estrutura cristalográfica dun tetrámero de concanavalina A da planta Canavalia ensiformis (os monómeros foron coloreados de ciano, verde, vermello e maxenta). Os ións calcio e magnesio están representados como esferas douradas e grises, respectivamente.[1] | |
| Identificadores | |
| Organismo | |
| Símbolo | ConA |
| PDB | 3CNA Máis estruturas |
| UniProt | P81461 |
| Outros datos | |
A concanavalina A (ConA) é unha proteína lectina que se une a determinados carbohidratos, que foi extraída orixinalmente da planta Canavalia ensiformis. Forma parte da familia proteica das lectinas de legumes. Únese especificamente a certas estruturas que se encontran en diversos azucres, glicoproteínas, e glicolípidos, principalmente a grupos α-D-manosil e α-D-glicosil internos ou terminais non redutores.[2][3] A ConA é un mitóxeno de plantas, e ten a capacidade de estimular certos grupos de células T de rato, dando lugar a catro poboacións de células T funcionalmente distintas, entre as que están as precursoras das células T supresoras;[4] e un conxunto das propias células T supresoras humanas, que son tamén sensibles á ConA.[4] A ConA foi a primeira lectina da que se puido dispoñer comercialmente, e utilízase amplamente en bioloxía e bioquímica para caracterizar glicoproteínas e outras moléculas que conteñan azucres na superficie de diversas células.[5] Tamén se usa para purificar macromoléculas glicosiladas na cromatografía de afinidade de lectinas,[6] e para o estudo da regulación inmunitaria feita por varios tipos de células inmunitarias.[4]
Estrutura e propiedades[editar | editar a fonte]
Como a maioría das lectinas, a ConA é un homotetrámero: cada subunidade (de 26,5 kDa, de 235 aminoácidos, moi glicosilada) únese a un átomo metálico (xeralmente Mn2+ e Ca2+). Ten unha simetría D2.[1] A súa estrutura terciaria xa foi determinada,[7] e as bases moleculares da súa interacción cos metais e a súa afinidade polos azucres manosa e glicosa[8] coñécense ben.
A ConA únese especificamente a residuos α-D-manosil e α-D-glicosil, dúas hexosas que difiren só polo grupo alcohol do carbono 2 en posición terminal nas estruturas ramificadas de B-glicanos (en α-manosa, ou complexos de glicanos biantenarios e híbridos). Ten catro sitios de unión, correspondentes ás catro subunidades.[3] O seu peso molecular total é de 104-112 kDa e o seu punto isoeléctrico (pI) está entre 4,5 e 5,5.
A concanavalina A ten un número de onda de baixa frecuencia de 20 cm−1 no seu espectro Raman.[9] Esta emisión foille asignada polo movemento palpitante da súa estrutura en barril beta, que consta de 14 cadeas beta.[10]
A ConA pode tamén facer iniciar a división celular (mitoxénese), e principalmente actúa sobre os linfocitos T ao estimular o metabolismo enerxético dos timocitos despois de poucos segundos de exposición.[11]
- Véxase tamén: Biosensores de glicosa fluorescentes.
Actividade biolóxica[editar | editar a fonte]
A concanavalina A interacciona con diversos receptores que conteñen carbohidratos con manosa, especialmente coa rodopsina, biomarcadores dos grupos sanguíneos, receptores da insulina,[12] inmunoglobulinas e o antíxeno carcino-embrionario (CEA). Tamén interacciona con lipoproteínas.[13]
A ConA aglutina fortemente os eritrocitos independentemente do seu grupo sanguíneo, e varios tipos de células cancerosas.[14][15][16] Demostrouse que as células transformadas e as células normais tratadas con tripsina non se aglutinan a 4 °C, o que suxire que pode haber un paso sensible á temperatura na aglutinación mediada por ConA.[17][18]
Tamén se informou da aglutinación mediada por ConA doutros tipos celulares como células musculares (miocitos),[19] linfocitos B (por medio das inmunoglobulinas da súa superficie),[20] fibroblastos,[21] timocitos de rata,[22] células epiteliais intestinais humanas fetais (pero non adultas),[23] e adipocitos.[24] A ConA é tamén un mitóxeno para os linfocitos.
A ConA interacciona cos residuos superficiais de manosa de moitos microbios, como as bacterias E. coli,[25] e Bacillus subtilis[26] e o protista Dictyostelium discoideum.[27]
Tamén se observou que é un estimulador de varias metaloproteinases de matriz (MMPs).[28]
A ConA é moi útil en aplicacións que requiran a inmobilización en fase sólida de glicoencimas, especialmente daqueles encimas que son difíciles de inmobilizar polo acoplamento covalente tradicional. Utilizando matrices con ConA, eses encimas poden ser inmobilizados en grandes cantidades sen unha perda de actividade nin de estabilidade. Estes acoplamentos non covalentes ConA-glicoencima poden ser revertidos de forma relativamente doada por competición con azucres ou a pH ácido. Se for necesario para certas aplicacións, estes acoplamentos poden converterse en enlaces covalentes por manipulación química.[29]
Un informe de 2009 realizado en Taiwán demostrou que se produce un potente efecto terapéutico da ConA contra o hepatoma experimental (cancro de fígado) en ratos;[30] a ConA era secuestrada con máis intensidade polas células hepáticas tumorais en comparación coas células hepáticas que as rodeaban. Neste estudo, a internalización da ConA tiña lugar preferentemente nas mitocondrias despois de unirse primeiro ás glicoproteínas da membrana plasmática, o cal causaba unha morte celular autofáxica. A ConA inhibía parcialmente o crecemento do nódulo tumoral independentemente da súa activación dos linfocitos; a erradicación do tumor no modelo de hepatoma murino in situ utilizado neste estudo foi atribuída adicionalmente á acción mitoxénica/linfoproliferativa da ConA, que puido activar a resposta inmune no fígado mediada por células T CD8+, e células NK e NKT.[30]
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 PDB 3CNA; Hardman KD, Ainsworth CF (1972). "Structure of concanavalin A at 2.4-A resolution". Biochemistry 11 (26): 4910–9. PMID 4638345. doi:10.1021/bi00776a006.
- ↑ Goldstein IJ, Poretz RD (1986). "Isolation, physicochemical characterization, and carbohydrate-binding specificity of lectins". En Goldstein IJ, Liener IE, Sharon N. The Lectins Properties, Functions and Applications in Biology and Medicine. San Diego: Academic. pp. 233–247. ISBN 0-12-449945-7.
- ↑ 3,0 3,1 Sumner JB, Gralën N, Eriksson-Quensel IB (1938). "The molecular weights of canavalin, concanavalin A, and Concanavalin B". The Journal of Biological Chemistry 125 (1): 45–48.; Sumner, J. B.; Gralen, N.; Eriksson-Quensel, I.-B. (1938). "The Molecular Weights of Urease, Canavalin, Concanavalin a and Concanavalin B". Science 87 (2261): 395–396. Bibcode:1938Sci....87..395S. PMID 17746464. doi:10.1126/science.87.2261.395.
- ↑ 4,0 4,1 4,2 Dwyer JM, Johnson C (1981). "The use of concanavalin A to study the immunoregulation of human T cells". Clin Exp Immunol 46 (2): 237–49. PMC 1536405. PMID 6461456.
- ↑ Schiefer HG, Krauss H, Brunner H, Gerhardt U (1975). "Ultrastructural visualization of surface carbohydrate structures on mycoplasma membranes by concanavalin A". J Bacteriol 124 (3): 1598–600. PMC 236075. PMID 1104592.
- ↑ "GE Healthcare Life Sciences, Immobilized lectin". Arquivado dende o orixinal o 03 de marzo de 2012. Consultado o 10 de novembro de 2013.
- ↑ Min W, Dunn AJ, Jones DH (1992). "Non-glycosylated recombinant pro-concanavalin A is active without polypeptide cleavage". EMBO J. 11 (4): 1303–7. PMC 556578. PMID 1563347.
- ↑ Loris R, Hamelryck T, Bouckaert J, Wyns L (1998). "Legume lectin structure". Biochim. Biophys. Acta 1383 (1): 9–36. PMID 9546043. doi:10.1016/S0167-4838(97)00182-9.
- ↑ Painter PC, Mosher LE, Rhoads C (1982). "Low-frequency modes in the Raman spectra of proteins". Biopolymers 21 (7): 1469–72. PMID 7115900. doi:10.1002/bip.360210715.
- ↑ Chou KC (1985). "Low-frequency motions in protein molecules. Beta-sheet and beta-barrel". Biophys. J. 48 (2): 289–97. Bibcode:1985BpJ....48..289C. PMC 1329320. PMID 4052563. doi:10.1016/S0006-3495(85)83782-6.
- ↑ Krauss S, Buttgereit F, Brand MD (1999). "Effects of the mitogen concanavalin A on pathways of thymocyte energy metabolism". Biochim Biophys Acta 1412 (2): 129–38. PMID 10393256. doi:10.1016/S0005-2728(99)00058-4.
- ↑ http://www.pnas.org/content/70/2/485.short
- ↑ J A Harmony and E H Cordes (1975); The Journal of Biological Chemistry, N.250. No.22, Issue 01, pp. 8614-8617. 1975; "Native human plasma low density lipoprotein (LDL) interacts with concanavalin A but not with ricin"
- ↑ Betton GR (1976). "Agglutination reactions of spontaneous canine tumour cells, induced by concanavalin a, demonstrated by an isotopic assay". Int J Cancer 18 (5): 687–696. PMID 992901. doi:10.1002/ijc.2910180518.
- ↑ Kakizoe T, Komatsu H, Niijima J, Kawachi T, Sugimura T (1980). "Increased agglutinability of bladder cells by concanavalin A after administration of carcinogens". Cancer Res 40 (6): 2006–2009. PMID 7371036.
- ↑ Becker FF, Shurgin A (1975). "Concanavalin A Agglutination of Cells from Primary Hepatocellular Carcinomas and Hepatic Nodules Induced by N-2-Fluorenylacetamide" (PDF). Cancer Res 35 (10): 2879. PMID 168971.
- ↑ INBAR M, BEN-BASSAT H, SACHS K (1971). "A specific membrane activity on the surface membrane in malignant cell transformation". Proc. Natl. Acad. Sci. U.S.A. 68 (11): 2748. Bibcode:1971PNAS...68.2748I. PMC 389516. PMID 4330939. doi:10.1073/pnas.68.11.2748.
- ↑ SELA B, Lis H, SHARON N, SACHS L (1971). "Quantitation of N-acetyl-D-galactosamine sites on the surface membrane of normal and transformed cells". Biochim . Biophys. Acta 249: 564.
- ↑ Gartner TK, Podleski TR (1975). "Evidence that a membrane bound lectin mediates fusion of L6 myoblasts". Biochem Biophys Res Commun 67 (3): 972–8. PMID 1201086. doi:10.1016/0006-291X(75)90770-6.
- ↑ de Petris S (1975). "Concanavalin A receptors, immunoglobulins, and theta antigen of the lymphocyte surface. Interactions with concanavalin A and with Cytoplasmic structures". J Cell Biol 65 (1): 123–146. PMC 2111157. PMID 1092699. doi:10.1083/jcb.65.1.123.
- ↑ Noonan KD, Burger MM (1973). "THE RELATIONSHIP OF CONCANAVALIN A BINDING TO LECTIN-INITIATED CELL AGGLUTINATION". J Cell Biol 59 (1): 134–142. PMC 2110924. PMID 4201706. doi:10.1083/jcb.59.1.134.
- ↑ Capo C, Garrouste F, Benoliel AM, Bongrand P, Ryter A, Bell GI (1982). "Concanavalin-A-mediated thymocyte agglutination: a model for a quantitative study of cell adhesion". J Cell Sci 56: 21–48. PMID 7166565.
- ↑ Weiser MM (1972). "Concanavalin A agglutination of intestinal cells from the human fetus". Science 177 (4048): 525–6. Bibcode:1972Sci...177..525W. PMID 5050484. doi:10.1126/science.177.4048.525.
- ↑ Cuatrecasas P (1973). "Interaction of wheat germ agglutinin and concanavalin A with isolated fat cells". Biochemistry 12 (7): 1312–1323. PMID 4696755. doi:10.1021/bi00731a011.
- ↑ OFEK I, MIRELMAN D, SHARON N (1977). "Adherence of Escherichia coli to human mucosal cells mediated by mannose receptors". Nature 265 (5595): 623–625. Bibcode:1977Natur.265..623O. PMID 323718. doi:10.1038/265623a0.
- ↑ Doyle RJ, Birdsell DC (1972). "Interaction of concanavalin A with the cell wall of Bacillus subtilis". J Bacteriol 109 (2): 652–8. PMC 285189. PMID 4621684.
- ↑ West CM, McMahon D (1977). "Identification of concanavalin A receptors and galactose-binding proteins in purified plasma membranes of Dictyostelium discoideum". J Cell Biol 74 (1): 264–273. PMC 2109878. PMID 559679. doi:10.1083/jcb.74.1.264.
- ↑ Yu M, Sato H, Seiki M, Thompson EW (1995). "Complex regulation of membrane-type matrix metalloproteinase expression and matrix metalloproteinase-2 activation by concanavalin A in MDA-MB-231 human breast cancer cells". Cancer Res. 55 (15): 3272–7. PMID 7614461.
- ↑ Saleemuddin M, Husain Q (1991). "Concanavalin A: A useful ligand for glycoenzyme immobilization--A review". Enzyme and Microbial Technology 13 (4): 290–295. PMID 1367163. doi:10.1016/0141-0229(91)90146-2.
- ↑ 30,0 30,1 Lei HY, Chang CP (2009). "Lectin of Concanavalin A as an anti-hepatoma therapeutic agent". J Biomed Sci 16 (1): 10. PMC 2644972. PMID 19272170. doi:10.1186/1423-0127-16-10.
Véxase tamén[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- MeshName Concanavalin+A
- MeshName Concanavalin+A+Receptors
- Estrutura da concanavalina A Arquivado 20 de agosto de 2008 en Wayback Machine.
- World of Lectin, Gateway to lectins
- Proteopedia 1bxh A ConA en complexo co metil alfa1-2 manobiósido
