Isomería
A isomería é unha propiedade de certos compostos químicos que teñen igual fórmula molecular (fórmula química non desenvolvida), é dicir, iguais proporcións relativas dos átomos que conforman a súa molécula, pero presentan estruturas moleculares distintas e, por tanto, diferentes propiedades. Ditos compostos reciben o nome de isómeros. Por tanto, os isómeros son compostos que teñen a mesma fórmula molecular pero diferente fórmula estrutural e propiedades. Por exemplo, o alcohol etílico ou etanol e o éter dimetílico son isómeros, ambos os dous coa fórmula C2H6O.

Aínda que este fenómeno é moi frecuente en química orgánica, non é exclusivo desta porque tamén a presentan algúns compostos inorgánicos, como os compostos dos metais de transición.
Isomería en Química orgánica
[editar | editar a fonte]Hai dous tipos básicos de isomería: plana e espacial.[1]
Isomería constitucional ou estrutural
[editar | editar a fonte]- Artigo principal: Isomería estrutural.
Forma de isomería na que moléculas coa mesma fórmula molecular teñen unha diferente distribución dos enlaces entre os seus átomos, ao contrario do que ocorre na estereoisomería.
Debido a isto poden presentarse tres diferentes modos de isomería:
• Isomería de cadea ou esqueleto.- Os isómeros deste tipo teñen compoñentes da cadea acomodados en diferentes lugares, é dicir as cadeas carbonadas son diferentes, presentan distinto esqueleto ou estrutura.
Un exemplo é o pentano, do cal, existen moitos isómeros, pero os máis coñecidos son o isopentano e o neopentano.
• Isomería de posición.- É a daqueles compostos nos que os seus grupos funcionais ou os seus grupos substituíntes están unidos en diferentes posicións.
Un exemplo simple deste tipo de isomería é a do pentanol, na que existen tres isómeros de posición: pentan-1-ol, pentan-2-ol e pentan-3-ol.
• Isomería de grupo funcional.- Aquí, a diferente conectividade dos átomos, pode xerar diferentes grupos funcionais na cadea. Un exemplo é o ciclohexano e o 1-hexeno, que teñen a mesma fórmula molecular (C6H12), mais o ciclohexano é un alcano cíclico ou cicloalcano e o 1-hexeno é un alqueno. Hai varios exemplos de isomería como a de ionización, coordinación, enlace, xeometría e óptica.
Isomería de cadea ou ordenación
[editar | editar a fonte]Varía a disposición dos átomos de C na cadea ou esqueleto carbonado, é dicir, a estrutura deste, que pode ser liñal ou ter distintas ramificacións.
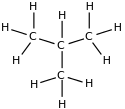
Por exemplo o C4H10 corresponde tanto ao butano como ao metilpropano (isobutano ou terc-butano):

|
|
|---|---|
| Butano n-butano |
Metilpropano iso-butano ou terc-butano. |
Para a fórmula C5H12, temos tres posibles isómeros de cadea: pentano, metilbutano (isopentano) e dimetilpropano (neopentano). O número de isómeros de cadea crece rapidamente ao aumentar o número de átomos de carbono.
Isomería de posición
[editar | editar a fonte]Preséntana aqueles compostos que posúen o mesmo esqueleto carbonado pero nos que o grupo funcional ou o substituínte ocupa diferente posición.
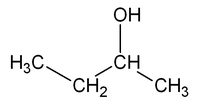
Por exemplo, a fómula molecular C4H10O pode corresponder a dúas substancias isómeras que se diferencian na posición do grupo OH: o 1-butanol e o 2-butanol.
| CH3-CH2-CH2-CH2OH | CH3-CH2-CHOH-CH3 |
|---|---|
| 1-butanol, Butan-1-ol ou n-butanol | 2-butanol, Butan-2-ol ou sec-butanol |

|
|
Este tipo de isomería prodúcese debido á posibilidade de colocar grupos funcionais, cadeas laterais ou átomos substituíntes en posicións estruturalmente non equivalentes. Supoñamos que substituímos un dos átomos de hidróxeno do butano, CH3-CH2-CH2-CH3, por un grupo hidroxilo. Numerando os carbonos da cadea do butano e realizando esta substitución no carbono extremo (C1), obtemos un alcohol chamado butan-1-ol (1-butanol). Se substituímos un hidróxeno do C2 polo grupo OH, obtemos o alcohol isómero butan-2-ol (2-butanol), que difire na posición do grupo hidroxilo. Porén, nótese que en caso de realizarmos a substitución no C3, non se obtería un terceiro isómero, senón de novo o 2-butanol. As dúas representacións que se indican para o 2-butanol son estruturalmente idénticas, como se pode ver xirando a súa estrutura 180º arredor dun eixe.
Isomería de compensación ou por compensación
[editar | editar a fonte]Ás veces chámase isomería de compensación ou metamería a que presentan aqueles compostos nos cales unha función corta a cadea carbonada en porcións de lonxitudes diferentes.[2]
Por exemplo tres metámeros de fórmula molecular C402H8 son:
| HCOO-CH2-CH2-CH3 | CH3-COO-CH2-CH3 | CH3-CH2-COO-CH3 |
|---|---|---|
| Metanoato de propilo | Etanoato de etilo | Propanoato de metilo |
Este tipo de isomería era máis usado no pasado do que na actualidade. Aplicábase mesmo a aldehidos-cetonas,[3] que hoxe adoitan considerarse isómeros de función.
Isomería de función
[editar | editar a fonte]Varía o grupo funcional, conservando o esqueleto carbonado.
Por exemplo o C3H6O pode corresponder á molécula de propanal (función aldehido) ou á propanona (función cetona).
| CH3-CH2-CH0 | CH3-CO-CH3. |
|---|---|
| Propanal (función aldehido) | Propanona (función cetona) |
Esta isomería preséntana certos grupos de compostos relacionados como: os alcohois e éteres, os ácidos e ésteres, e tamén os aldehidos e cetonas.
Tautomería
[editar | editar a fonte]- Artigo principal: Tautómero.
É un tipo especial de isomería na que existe transposición dun átomo entre as dúas estruturas, xeralmente hidróxeno, e existe ademais un doado equilibrio entre ambas as formas tautómeras.[4]
Un exemplo desta isomería é a tautomería ceto-enólica na que existe equilibrio entre un composto con grupo OH unido a un dos átomos de carbono dun dobre enlace C=C, e un composto co grupo carbonilo intermedio, C=O típico das cetonas, con transposición dun átomo de hidróxeno.

|
|---|
| Tautomería ceto-enólica. |
Isomería espacial ou estereoisomería
[editar | editar a fonte]- Artigo principal: Estereoisomería.
Presentan estereoisomería aqueles compostos que teñen fórmulas moleculares idénticas e os seus átomos presentan a mesma distribución (a mesma forma da cadea; os mesmos grupos funcionais e substituíntes; situados na mesma posición), mais a súa disposición no espazo é distinta, polo que difiren na orientación espacial dos seus átomos.
Os isómeros teñen igual forma no plano. Cómpre representarlos no espazo para visualizar as diferenzas. Pode ser de dous tipos: isomería conformacional e isomería configuracional, segundo que os isómeros se poidan converter un noutro por simple rotación de enlaces simples, ou non.
Outra clasificación divídeos en enantiómeros (son imaxes especulares) e diastereoisómeros (non son imaxes especulares). Entre os diastereoisómeros atópanse os isómeros cis-trans (antes coñecidos como isómeros xeométricos), os confórmeros ou isómeros conformacionais e, nas moléculas con varios centros quirais, os isómeros que pertencen a distintas parellas de enantiómeros. Os diastereoisómeros que difiren na configuración dun só carbono asimétrico reciben o nome de epímeros, como por exemplo a D-glicosa e a D-manosa, que son epímeros no carbono 2.
Isomería conformacional
[editar | editar a fonte]- Artigo principal: Isomería conformacional.
Neste tipo de isómeros conformacionais [5] ou confórmeros, a conversión dunha forma noutra é posible porque a rotación arredor do eixe do enlace formado polos átomos de carbono é máis ou menos libre (ver animación á dereita). Por iso tamén reciben o nome de rotámeros. Se os grupos son voluminosos podería haber impedimento estérico e non ser tan doada a interconversión entre rotámeros.
Os isómeros conformacionais xeralmente non son separables ou illables, debido á facilidade de interconversión aínda a temperaturas relativamente baixas. A rama da estereoquímica que estuda os isómeros conformacionais que si poden ser illables (a maioría son derivados do bifenilo) chámase atropisomería.
Estas formas recoñécense ben se utilizamos a proxección de Newman, como se aprecia nos debuxos da esquerda. Reciben nomes como sinclinal (ás veces, gauche), anticlinal (anti ou trans), sinperiplanar e antiperiplanar.[5]
Outro tipo de isómeros conformacionais dáse en compostos con ciclos hexagonais,como o ciclohexano, onde son factibles a conformación en forma de cadeira e a conformación en forma de bote.
Isomería configuracional
[editar | editar a fonte]Nesta isomería non abonda cunha simple rotación para converter unha forma noutra e aínda que a disposición espacial é a mesma, os isómeros non son interconvertibles. Divídese en: isomería xeométrica ou cis-trans, e isomería óptica. Os isómeros configuracionais son illables, xa que cómpre unha gran cantidade de enerxía para interconvertelos (requírese enerxía para a rotura de enlaces),
Isomería xeométrica ou cis-trans
[editar | editar a fonte]- Artigo principal: Isomería cis-trans.
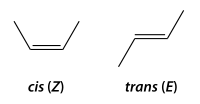
Prodúcese cando hai dous carbonos unidos con dobre enlace que teñen as outras valencias cos mesmos substituíntes (dous pares) ou con dous iguais e un distinto [6].
É característica dos enlaces dobres e non se presenta isomería xeométrica ligada aos enlaces triplos ou sinxelos.
As dúas posibilidades denomínanse:
- forma cis (ou forma Z), cos dous substituíntes máis voluminosos do mesmo lado, e
- forma trans (ou forma E), cos dous substituíntes máis voluminosos en posicións opostas.
Estas dúas formas non se poden interconverter entre si dun xeito espontáneo, xa que o dobre enlace impide a rotación, aínda que si poden converterse ás veces, en reaccións catalizadas.
| Isómeros do But-2-eno | Ácido maleico (Cis) e ácido fumárico (trans) |
Formas trans (E) e cis (Z) do 1,2-dibromoeteno. |
|---|---|---|

|
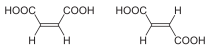
|

|
A isomería xeométrica tamén se presenta en compostos con dobre enlace N=N, ou en compostos cíclicos nos que tamén se impide a rotación arredor dun eixe.
| 1,2-dimetilciclopentano (formas cis e trans) |
cis-1,2-diclorociclohexano | trans-1,2-diclorociclohexano | Formas cis e trans do difluorodiazeno |
|---|---|---|---|

|

|

|

|
Isomería óptica ou enantiomería
[editar | editar a fonte]- Artigo principal: Enantiómero.

Cando un composto ten polo menos un átomo de carbono asimétrico ou quiral, é dicir, un átomo de carbono con catro substituíntes diferentes, poden formarse dúas variedades distintas chamadas estereoisómeros ópticos, enantiómeros, formas enantiomórficas ou formas quirais, aínda que todos os átomos están na mesma posición e enlazados de igual maneira. Isto coñécese como regra de Level e Van't Hoff.[1]
Os isómeros ópticos non se poden superpoñer e un é como a imaxe especular do outro, como ocorre coas mans dereita e esquerda. Presentan as mesmas propiedades físicas e químicas pero diferécianse en que desvían o plano da luz polarizada en diferente dirección:
- un isómero desvía a luz polarizada cara á dereita (no sentido das agullas do reloxo) e represéntase co signo (+): é o isómero dextroxiro ou forma dextro;
- o outro isómero óptico desvíaa cara á esquerda (no sentido contrario ás agullas do reloxo) e represéntase co signo (-) (isómero levoxiro ou forma levo).[7]
Outra forma de nomear estes compostos é por medio do convenio ou nomenclatura D-L, normalmente empregando a proxección de Fischer. Esta nomenclatura é absoluta pero non necesariamente a forma (D) coincide co isómero dextroxiro ou forma (+) [8] ; por exemplo, a D-frutosa ou a D-desoxirribosa son levoxiras [9].

Se unha molécula ten n átomos de carbono asimétricos, terá un total de 2n isómeros ópticos.
Tamén poden representarse estes isómeros coas letras (R) e (S). Esta nomenclatura R-S, que segue as regras de Cahn-Ingold-Prelog, tamén se utiliza para determinar a configuración absoluta dos carbonos quirais.
Por tanto, hai tres sistemas para nomear estes compostos:
- segundo a dirección de desviación do plano da luz polarizada, distinguimos as formas dextro (+) e levo (-);
- segundo a nomenclatura D-L (formas D e L), que é inequívoca para isómeros cun só carbono asimétrico,[10] e
- segundo a configuración absoluta R-S (formas R e S),[11] máis axeitada para moléculas con varios centros asimétricos.
Diastereoisómeros
[editar | editar a fonte]- Artigo principal: Diastereoisómero.
Cando un composto ten máis dun carbono asimétrico podemos encontrar formas enantiómeras (que son imaxe especular unha da outra) e outras formas que non son exactamente copias especulares, por non teren todos os seus carbonos invertidos. A estas formas chámaselles diastereoisómeros. Por exemplo, o 3-bromo-butan-2-ol posúe dous carbonos asimétricos polo que ten 4 formas posibles. Delas, algunhas son enantiomorfas (formas especulares), como (2S,3S)-3-bromo-butan-2-ol e (2R,3R)-3-bromo-butan-2-ol. Polo contrario, o (2R,3S)-3-bromo-butan-2-ol é un diastereoisómero dos dous anteriores.
Mestura racémica e formas meso
[editar | editar a fonte]
Unha mestura racémica é a mestura equimolecular dos isómeros dextro e levo. Esta fórmula é opticamente inactiva (non desvía o plano da luz polarizada). A mestura de ácido D-láctico e L-láctico forma unha mestura racémica, opticamente inactiva.
Se un composto posúe dous carbonos asimétricos, pode ter un dextroxiro e outro levoxiro, mais se ten un plano de simetría, en conxunto compórtase como opticamente inactivo e recibe o nome de forma meso. É o caso do ácido tartárico ou 2,3-dihidroxibutanodioico, no cal un dos seus isómeros é unha forma meso.
Poder rotatorio específico
[editar | editar a fonte]É a desviación que sofre o plano de polarización ao atravesar a luz polarizada unha disolución cunha concentración de 1 gramo de substancia por cm3 nun recipiente de 1 dm de largo. É o mesmo para ambos os enantiómeros, aínda que de signo contrario. Mídese co polarímetro.[12]
Isomería en Química inorgánica
[editar | editar a fonte]Hai varios tipos de isomería nos compostos inorgánicos, sobre todo en complexos de coordinación,[13] pero este fenómeno non é tan importante como en química orgánica:
- Isomería estrutural ou topolóxica: Os átomos únense de modo diferente, como no S2F2, no que existe unha molécula en forma de cadea e outra en forma de pirámide triangular. Un caso especial é a tautomería, na que un átomo de hidróxeno cambia de posición.
- Isomería conformacional: É igual á xa comentada para compostos orgánicos. Preséntase en compostos con enlace sinxelo como P2H4 ou o ión ditionito, S2O42-, onde existen formas eclipsadas, en chanzos e sinclinal (gauche).
- Isomería cis-trans (xeométrica): Aparece en compostos como o ácido nitroso, HNO2, ou en complexos de coordinación plano-cadrados como [PtCl2(NH3)2].
- Isomería de posición, como nalgúns heterociclos de xofre e nitróxeno. No composto S6(NH)2 mantense o anel octogonal do xofre pero dous átomos de xofre foron substituídos por grupos NH, que poden estar en posición 1,2; 1,3; 1,4 e 1,5.
- Isomería óptica: tamén aparece en compostos de coordinación de estrutura tetraédrica con substituíntes diferentes.
- Isomería de ionización: Intercámbianse un ligando do catión cun dos anións que o neutralizan, como ocorre entre o [CrSO4(NH3)5]Cl e o [CrCl(NH3)5]SO4
- Isomería de coordinación: Se ambos os ións son complexos, podemos intercambiar os seus ligandos e obteremos isómeros diferentes, como ocorre entre o [Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6].

Isomería de enlace nun complexo de cobalto - Isomería de enlace: Algúns ligandos poden unirse de modo diferente ao ión central, como ocorre en [CoCl(NO2)(NH3)4]+ [CoCl(ONO)(NH3)4]+[14]
- Isomería de polimerización: É o caso de NO2 e N2O4, dous óxidos de nitróxeno gasosos.
Historia
[editar | editar a fonte]A existencia do isomerismo descubriuse en 1827 cando Friedrich Wöhler preparou ácido ciánico e decatouse de que aínda que a súa composición elemental era idéntica á do ácido fulmínico (preparado por Justus von Liebig un ano antes), as súas propiedades eran bastante diferentes. Este descubrimento puxo en cuestión as ideas químicas que prevalecían naquela época, que sostiñan que os compostos químicos podían ser diferentes só cando tiñan composicións elementais distintas. Despois doutros descubrimentos similares, como o feito por Wöhler en 1828 sobre a composición atómica idéntica da urea e o cianato de amonio, que teñen propiedades diferentes, Jöns Jacob Berzelius introduciu o termo isomerismo en 1830 para describir este fenómeno.[15][16]
En 1848, Louis Pasteur separou diminutos cristais de ácido tartárico nas súas dúas formas que eran imaxes especulares.[17][18] As moléculas deste ácido podían ser estereoisómeros ópticos dextroxiros ou levoxiros, e as solucións formadas con elas facían rotar o plano da luz polarizada o mesmo número de graos, pero en direccións opostas, a dereita ou esquerda.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Química: Teoría y problemas. José Antonio García Pérez e outros. Ed. Tébar Flores. Albacete, 1996. ISBN 8473601559. Páxinas 253 e ss.
- ↑ Química general. M. Garric. Editorial Reverté, 1979. ISBN 8429171770. Páxina 170
- ↑ Curso de química biológica. Venancio Deulofeu, Agustín Domingo Marenzi. Editorial El Ateneo, 1946. Páxina 34
- ↑ Química orgánica. Robert Thornton Morrison, Robert Neilson Boyd. 5ª ed., Editorial Pearson Educación, 1998. ISBN 9684443404. Páxina 421
- ↑ 5,0 5,1 Título: Fundamentos de química orgánica. Carl David Gutsche. Editorial Reverté, 1979. ISBN 8429174753. Páxina 67
- ↑ IUPAC Gold Book cis trans. Definición da IUPAC de cis trans
- ↑ Química general; 8ª edición; Petrucci, Harwood e Herring; Prentice Hall; ISBN 0-13-014329-4
- ↑ http://books.google.es/books?id=VmdvQfFbq9UC&pg=PA166 Configuración absoluta. En: Diccionario de química. Inmaculada Julián. Editorial Complutense, 1999. ISBN 8489784728. Páxina 166
- ↑ J. M. Macarulla, F. M. Goñi. Biomoléculas. Reverté S.A. Páxina 32. ISBN 84-291-7328-5
- ↑ Nomenclatura D-L. En: Curso de biomoléculas. Juan Manuel González Mañas. Universidade do País Vasco.
- ↑ Configuración absoluta de los centros quirales: cómo determinarla y designarla. En: Química orgánica. Stephen J Weininger, Frank R. Stermitz. Editorial Reverté, 1988. ISBN 842917527X. Páxina 132
- ↑ Química orgánica básica y aplicada: de la molécula a la industria, Volume 1. Eduardo Primo Yúfera. Editorial Reverté, 1996. ISBN 8429179534, Páxinas 52 e ss.
- ↑ Química inorgánica estructural. A.F. Wells. Editorial Reverté, 1978. ISBN 8429175245. Páxinas 48 e ss.
- ↑ http://www.textoscientificos.com/quimica/inorganica/metales-transicion/isomeria Isomería en TextosCientíficos.com
- ↑ Esteban, Soledad. (2008). "Liebig–Wöhler Controversy and the Concept of Isomerism". J. Chem. Educ. 85 (9): 1201. doi:10.1021/ed085p1201.
- ↑ J. J: Berzelius. “Om sammansättningen af vinsyra och drufsyra (John’s säure aus den Voghesen), om blyoxidens atomvigt, samt allmänna anmärkningar om sådana kroppar som hafva lika sammansättning, men skiljaktiga egenskaper” (Sobre a composición do ácido tartárico e ácido racémico (acido de Xoan dos Vosgos), sobre o peso molecular do óxido de chumbo, xunto con observacións xerais sobre os corpos que teñen a mesma composición pero diferentes propiedades) Kongliga Svenska Vetenskaps Academiens Handling (Actas da Real Academia Sueca de Ciencia), vol. 49, páxinas 49–80; especialmente na páxina 70. Reimpreso en francés en 1831: J.J. Berzelius (1831) “Composition de l’acide tartarique et de l’acide racémique (traubensäure); poids atomique de l’oxide de plomb, et remarques générals sur les corps qui ont la même composition, et possèdent des proprietés différentes,” Annales de Chimie et de Physique, vol. 46, pages 113–147; especialmente na páxina 136.
- ↑ L. Pasteur (1848) "Mémoire sur la relation qui peut exister entre la forme cristalline et la composition chimique, et sur la cause de la polarisation rotatoire", Comptes rendus de l'Académie des sciences (Paris), vol. 26, pages 535–538.
- ↑ L. Pasteur (1848) "Sur les relations qui peuvent exister entre la forme cristalline, la composition chimique et le sens de la polarisation rotatoire", Annales de Chimie et de Physique, 3rd series, vol. 24, no. 6, pages 442–459.
[[Categoría:]]== Véxase tamén ==
Ligazóns externas
[editar | editar a fonte]- Isomería Arquivado 23 de marzo de 2012 en Wayback Machine. Páxina en Averroes (en castelán)
- Isomería:tipos. Universidade de Huelva (en castelán)