Estereoisomería
En química, a estereoisomería é un tipo de isomería. Os estereoisómeros son isómeros que teñen a mesma fórmula molecular e a mesma secuencia de átomos enlazados, cos mesmos enlaces entre os seus átomos, pero que difiren soamente na orientación tridimensional dos seus átomos no espazo.[1] Diferéncianse, por tanto, do outro gran tipo de isómeros, os isómeros estruturais, nos cales os átomos están enlazados nunha orde diferente dentro da molécula.[2]
Clasificación
[editar | editar a fonte]Distínguense os seguintes tipos:
- Isómeros conformacionais, confórmeros ou rotámeros. Son doadamente interconvertibles entre si pola rotación en torno a enlaces.[3]
Pódese presentar en compostos con cadeas abertas, e en aneis. - Isómeros configuracionais. Só son interconvertibles entre si por medio da rotura de enlaces.
- Estes, á súa vez, poden clasificarse en:
- Estereoisómeros quirais: Non se poden superpoñer coa súa imaxe especular. Poden ser enantiómeros e diastereoisómeros.[4]
- Enantiómeros. Son imaxes especulares non superpoñibles entre si. Se unha molécula ten un isómero especular non superpoñible dise que é unha molécula quiral, que posúe quiralidade ou que é opticamente activa.
- Diastereoisómeros ou diastereómeros, que son os demais estereoisómeros, os que non son enantiómeros, ou sexa, non son imaxes especulares entre si.
- Un composto pode ter como máximo un enantiómero, pero pode ter varios diastereoisómeros.

- Estereoisómeros non quirais. Son superpoñibles coa súa imaxe especular. Difiren na súa maior parte na ordenación dos átomos no plano. Poden ser formas meso, isómeros cis-trans, isómeros sin-anti, isómeros E-Z, isómeros endo-exo, e isómeros in-out.[4]
Os isómeros configuracionais son illables, xa que cómpre unha gran cantidade de enerxía para interconvertelos (enerxía necesaria para a rotura de enlaces), mentres que os isómeros conformacionais xeralmente non son illables, debido á facilidade de interconversión aínda a temperaturas relativamente baixas. A rama da estereoquímica que estuda os isómeros conformacionais que son illables (a maioría derivados do bifenilo) chámase atropoisomería.
Isómeros conformacionais ou confórmeros
[editar | editar a fonte]- Artigo principal: Isomería conformacional.

A isomería conformacional é unha forma de isomería que describe o fenómeno das moléculas coa mesma fórmula estrutural que teñen formas diferentes debido ás rotacións sobre un ou máis enlaces. As conformacións diferentes poden ter diferentes enerxías, en xeral poden converterse internamente con facilidade, e moi raramente se poden illar. Por exemplo, o ciclohexano pode existir nunha variedade de conformacións diferentes, incluíndo unha conformación en cadeira e unha en bote, mais para o ciclohexano, estes isómeros nunca poden ser separados. A conformación en bote presenta un máximo de enerxía (e non é un estado de transición) no itinerario de transformación entre as dúas formas en cadeira equivalentes.
Hai algunhas moléculas que poden illarse en varias conformacións, debido ás grandes barreiras de enerxía entre as diferentes conformacións. Os 2,6,2',6'-bifenilos tetrasubstituídos poden situarse nesta última categoría.
Isómeros configuracionais
[editar | editar a fonte]Un estereoisómero configuracional é un estereoisómero dunha molécula de referencia que ten configuración oposta nun estereocentro (por exemplo, R con respecto a S ou E con respecto a Z). Isto significa que os isómeros configuracionais só poden interconverterse por medio da rotura de enlaces covalentes do estereocentro; por exemplo, invertendo as configuracións dalgúns ou de todos os estereocentros dun composto.
O número de estereoisómeros dun composto depende do número de centros quirais que posúe. A (+)-glicosa posúe cinco carbonos asimétricos e posúe, por tanto, 25 = 32 estereoisómeros. Un deles, a α-D-glicosa é a unidade estrutural do amidón; a β-D-glicosa, outro estereoisómero, é a unidade estrutural da celulosa. Poden ser de dous tipos segundo sexan ou non sexan imaxes especulares entre si: enantiómeros e diastereoisómeros.
Enantiómeros
[editar | editar a fonte]- Artigo principal: Enantiómero.

Os enantiómeros son estereoisómeros que se relacionan entre si por unha reflexión: son imaxes especulares entre si, e non son superpoñibles. As mans humanas son un exemplo macroscópico de estereoisomería. Todos os centros estereoxénicos ou estereocentros nun isómero teñen a configuración oposta no outro. Dous compostos que son enantiómeros entre si teñen as mesmas propiedades físicas, a excepción da dirección en que desvían a luz polarizada. Tamén teñen as mesmas propiedades químicas, agás o modo en que interaccionan con diferentes isómeros ópticos doutros compostos. Por esta razón, os enantiómeros puros presentan actividade óptica e poden ser separados só co uso dun axente quiral. Na natureza, só está presente un dos dous enantiómeros da maioría dos compostos biolóxicos quirais, tales como os aminoácidos (excepto a glicina, que é aquiral).
Como resultado, os diferentes enantiómeros dun composto poden ter efectos biolóxicos moi diferentes.[5] Por exemplo, un estereoisómero da cloromicetina é un antibiótico, pero o outro non mostra esa propiedade.


O ácido tartárico posúe dous carbonos asimétricos que actúan como estereocentros. Cada un deles pode ter configuración R ou S, segundo as regras de Cahn-Ingold-Prelog. O ácido (R,R)-tartárico (ou ácido L(+)-tartárico) é imaxe especular do ácido (S,S)-tartárico (ou ácido D(-)-tartárico) e, por tanto, son enantiómeros entre si. Cando o ácido tartárico se forma como produto ou subproduto entre substancias de orixe biolóxica, só obtemos a forma dextro.
Diastereoisómeros ou diastereómeros
[editar | editar a fonte]- Artigo principal: diastereoisómero.
Os diastereoisómeros ou diastereómeros son estereoisómeros que non están relacionados por medio dunha operación de reflexión. Ou sexa, non son imaxes especulares un do outro. Entre eles inclúense os compostos meso, os isómeros cis-trans (E-Z), e os isómeros ópticos non enantioméricos. Os diastereoisómeros dun composto rara vez teñen as mesmas propiedades físicas, a diferenza dos enantiómeros que teñen as mesmas propiedades en calquera ambiente non quiral (en ausencia de luz polarizada). As súas propiedades químicas son semellantes mais non iguais.[6] Cando dous diastereoisómeros se diferencian entre si nun só estereocentro dise que son epímeros.
Formas meso
[editar | editar a fonte]- Artigo principal: Composto meso.
As estruturas meso, compostos meso ou formas meso son compostos superpoñibles á súa imaxe especular, a pesar de que posúen centros quirais. No exemplo que se mostra a continuación, a forma meso do ácido tartárico forma un par de diastereoisómeros tanto coa forma levo coma coa forma dextro do ácido tartárico; estas últimas forman un par de enantiómeros entre si. As dúas estruturas meso representadas, en realidade, son superpoñibles e forman unha soa e única estrutura.
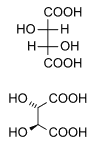
|

| |
|
ácido tartárico (natural) |
ácido D-(-)-tartárico |
ácido mesotartárico |
|
Mestura (1:1) |
||
Debe terse en conta aquí que as etiquetas D- e L- presentes nos isómeros de arriba (que indican a posición de substituíntes) non significan o mesmo ca as etiquetas d- e l-, utilizadas nos nomes de compostos con moita frecuencia (que indican a desviación do plano da luz polarizada). Como é doado confundirse a IUPAC recomenda usar os signos (+) e (-) en vez de d- e l-.[7] O isómero d- (ou +) desviaría a luz polarizada á dereita, e o l- (ou -) á esquerda. Pero un isómero D- non ten por que necesariamente desviar a luz polarizada á dereita, senón que simplemente ten determinados substituíntes á dereita.
Isomería cis-trans
[editar | editar a fonte]- Artigo principal: isomería cis-trans.

A estereoisomería cis-trans está habitualmente ligada á presenza de dobres enlaces C=C porque a rotación arredor do dobre enlace está restrinxida, mantendo os substituíntes posicións fixas respecto aos outros. Se os substituíntes nun carbono do dobre enlace son os mesmos, entón non existirá este tipo de isomería.
Tradicionalmente, os estereoisómeros ligados ao dobre enlace nótanse como cis (en latín, "deste lado") ou trans (do latín, "cruzado" en lados opostos), en referencia á posición relativa dos substituíntes a cada lado dun dobre enlace. Os exemplos máis simples de isomería cis-trans son os etenos 1,2-disubstituídos, como o 1,2-dicloroeteno (C2H2Cl2), cuxos isómeros se mostran á dereita.
Isomería E-Z
[editar | editar a fonte]
A molécula I é o cis-1,2-dicloroeteno e a molécula II é o trans-1,2-dicloroeteno. Debido a que ocasionalmente pode darse ambigüidade, a IUPAC adoptou un sistema máis rigoroso no que aos substituíntes de cada extremo do dobre enlace se lles asigna unha prioridade en función do seu número atómico. Se os substituíntes de alta prioridade están no mesmo lado do dobre enlace, ao composto se lle asigna a letra Z (do alemán, zusammen, "xuntos"). Se están en lados opostos do enlace, se lles asigna a letra E (do alemán, entgegen, "enfrontados"). No exemplo anterior, o cloro ten un número atómico maior ca o hidróxeno, e por iso é o grupo de maior prioridade. Utilizando esta notación para nomear as moléculas anteriores, a molécula I é o (Z)-1,2-dicloroeteno e a molécula II é o (E)-1,2-dicloroeteno. Non sempre Z e cis (ou ben, E e trans) son intercambiables. Vexamos a molécula seguinte de fluorometilpenteno:

O nome correcto desta molécula é, ou ben, trans-2-fluoro-3-metilpent-2-eno, porque os grupos alquilo que forman a cadea carbonada principal (é dicir, os grupos metilo e etilo) están en lados opostos do dobre enlace, ou ben, (Z)-2-fluoro-3-tilpent-2-eno, porque os grupos de maior prioridade que hai a cada lado do dobre enlace están no mesmo lado do dobre enlace. O átomo de flúor é o grupo de maior prioridade no lado esquerdo do dobre enlace, e o grupo etilo é o de maior prioridade no lado dereito da molécula.
Os termos cis e trans úsanse tamén para describir a posición relativa de dous substituíntes dun anel: cis, se están do mesmo lado; trans, se están en lados diferentes.

Isomería sin-anti
[editar | editar a fonte]É unha isomería similar á isomería xeométrica cis-trans, pero en vez de afectar a un dobre enlace C=C, faino a outros dobres enlaces diferentes, como C=N; N=N ou N=S.[8]
É típica de iminas, oximas, azocompostos. Denomínase sin ao isómero que ten os seus grupos de maior prioridade xuntos, e anti no caso de que ditos grupos de maior prioridade estean opostos.
Isomería endo-exo
[editar | editar a fonte]
Os isómeros endo-exo preséntanse en compostos bicíclicos como o 2-norborneol. A ponte actúa como un dos grupos. Se deixamos a ponte nunha posición fixa e nos fixamos na posición do outro substituínte, pódense presentar dúas situacións: que o outro substituínte estea do mesmo lado ca a ponte (isómero exo, que sería similar a cis), ou que estea do lado oposto (isómero endo, similar a trans).
Isomería in-out
[editar | editar a fonte]Os isómeros in-out tamén se presentan en aneis cando unha cadea actúa como grupo substituínte a ambos os lados. Por exemplo en sales de diaminas tricíclicas co átomo de nitróxeno como cabeza de ponte a ambos os lados e cadeas longas actuando como ponte, nas que o enlace N-H pode estar situado cara a dentro ou fóra da molécula.[9]
Notas
[editar | editar a fonte]- ↑ IUPAC Gold Book, Compendium of Chemical Terminology, 2ª ed. ("Gold Book") (1997). Versión en liña corrixida: (2006-) título = stereoisomerism | ficheiro = S05983
- ↑ Química orgánica. Norman L. Allinger. Editorial Reverté, 1979. ISBN 8429170154. Páx. 151
- ↑ Química orgánica. Robert Thornton Morrison, Robert Neilson Boyd. Editorial Pearson Educación, 1998. ISBN 9684443404. Páx. 78
- ↑ 4,0 4,1 Estereoquimica. Pedro Antonio García Ruiz. EDITUM. Universidade de Murcia. Páx. 12
- ↑ Stereochemistry: an introduction. Arquivado 05 de setembro de 2012 en Wayback Machine. Grazia Piizzi, Steve Hardinger
- ↑ Distereómeros.. En: Química orgánica. Robert Thornton Morrison, Robert Neilson Boyd. Editorial Pearson Educación, 1998. ISBN 9684443404. Páx. 143
- ↑ G.P. Moss: Basic terminology of stereochemistry ( Recommendations 1996); Pure Appl. Chem., 1996, Vol. 68, No. 12, p. 2205; doi|10.1351/pac199668122193
- ↑ Isomería sin-anti. En: Estereoquimica. Pedro Antonio García Ruiz. EDITUM. Universidade de Murcia. Páx. 24
- ↑ Isomería in-out. En: Estereoquimica. Pedro Antonio García Ruiz. EDITUM. Universidade de Murcia. Páx. 24
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Estereoisomería |

