Hemoglobina fetal
| Hemoglobina fetal | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (4 subunidades, α2γ2) | ||||||||||||||||
 | ||||||||||||||||
| Tipo de proteína | metaloproteína, globulina | |||||||||||||||
| Función | transorte de oxíxeno | |||||||||||||||
| Cofactor(es) | hemo (4) | |||||||||||||||
| ||||||||||||||||
A hemoglobina fetal ou hemoglobina F (HbF ou α2γ2) é a principal proteína transportadora de oxíxeno do feto humano. A hemoglobina F encóntrase nos glóbulos vermellos fetais e está implicada no transporte de oxíxeno desde o torrente sanguíneo materno que chega á placenta aos tecidos do feto. Empeza a producirse arredor das 6 semanas de embarazo [1] e os seus niveis permanecen altos no neno despois do nacemento ata que o meniño ten 2–4 meses de idade.[2] A hemoglobina F ten unha composición diferente á das formas de hemoglobina do adulto, o que lle permite unirse ao oxíxeno máis fortemente; isto á súa vez facilita que o feto en desenvolvemento recolla oxíxeno do sangue materno, o cal ocorre na placenta que comunica o feto co útero materno.[3]
No neonato, os niveis de hemoglobina F diminúen gradualmente e chegan aos niveis do adulto (de menos do 1% da hemoglobina total) xeralmente no primeiro ano de vida, xa que se empezan a producir as formas adultas da hemoglobina.[4] Enfermidades como a beta-talasemia, que afectan a compoñentes da hemoglobina adulta, poden atrasar este proceso e causar que os niveis de hemoglobina F sexan máis altos do normal.[5] Na anemia falciforme, o incremento da produción de hemoglobina F utilizouse como tratamento para aliviar algúns dos síntomas.[6]
Estrutura e xenética
[editar | editar a fonte]A hemoglobina F, igual que a hemoglobina adulta (hemoglobina A e hemoglobina A2), consta de catro subunidades ou cadeas. Cada subunidade contén un grupo hemo cun ión ferro que é clave para a unión e liberación do oxíxeno. A hemoglobina F pode adoptar dous estados: oxihemoglobina (unida ao oxíxeno) e desoxihemoglobina (sen oxíxeno). Como a hemoglobina F ten en total 4 grupos hemo, pode unirse a 1, 2, 3 ou 4 moléculas de oxíxeno.[7] Está composta por dúas subunidades α (alfa) e dúas γ (gamma), mentres que a hemoglobina A (97% do total da hemoglobina en adultos) está composta por dúas subunidades α e dúas β (beta).
Nos humanos a subunidade α está codificada no cromosoma 16 e a subunidade γ no 11. Existen dous xenes moi similares que codifican a subunidade α: HBA1 e HBA2. A proteína que producen é idéntica, pero difiren nas rexións regulatorias do xene que determinan cando e canta proteína hai que producir. Isto fai que HBA1 e HBA2 contribúan co 40% e 60%, respectivamente, do total das subunidades α producidas. Como consecuencia, as mutacións do xene HBA2 é de esperar que teñan un efecto máis forte que as mutacións no xene HBA1.[8] Hai tamén dúas copias de versións similares do xene que codifica a subunidade γ, HBG1 e HBG2, pero a proteína producida é lixeiramente diferente, xa que varía nun só aminoácido: HBG1 codifica a forma da proteína que ten alanina na posición 136, mentres que HBG2 codifica no seu lugar a glicina (ver [1] Arquivado 2020-07-31 en Wayback Machine.). BCL11A e ZBTB7A son proteinas represoras da produción de hemoglobina F, que funcionan uníndose ao xene codificante da subunidade γ na súa rexión promotora.[9] Isto ocorre naturalmente conforme o meniño neonato empeza a cambiar desde a produción de hemoglobina F á produción de hemoglobina A. Algunhas doenzas xenéticas poden producirse debido a mutacións dos xenes que codifican os compoñentes da hemoglobina F. As mutacións nos xenes HBA1 e HBA2 poden causar alfa-talasemia[10] e as mutacións nas rexións promotoras de HBG1 e HBG2 poden facer que a hemoglobina F siga producíndose despois do momento en que o cambio á produción de hemoglobina A debería de ter ocorrido, o cal se denomina persistencia hereditaria da hemoglobina fetal.[9]
Produción
[editar | editar a fonte]
Durante os primeiros tres meses de embarazo, a principal forma de hemoglobina no embrión/feto é a hemoglobina embrionaria, que ten 3 variantes dependendo dos tipos de subunidades que contén. A produción de hemoglobina F empeza a partir da 6ª semana, pero só a partir do 3º mes en adiante convértese no principal tipo de hemoglobina atopada nos glóbulos vermellos fetais.[4] O cambio para producir as formas adultas de hemoglobina (esencialmente hemoglobina A) comeza arredor da 40ª semana de xestación, que está preto do momento esperado de dar a luz.[1] No nacemento a hemoglobina F supón o 50-95% d hemoglobina do meniño e aproximadamente no 6º mes despois do nacemento a hemoglobina A pasa a ser o tipo predominante. Cando o meniño ten 1 ano de idade, as proporcións de diferentes tipos de hemoglobina espérase que se aproximen aos niveis adultos, coa hemoglobina F reducida a niveis moi baixos.[4] A pequena proporción de glóbulos vermellos que conteñen hemoglobina F denomínanse células F, que non só conteñen esta hemoglobina senón tamén outros tipos de hemoglobina.
En adultos sans a composición da hemoglobina é a seguinte: hemoglobina A (~97%), hemoglobina A2 (2,2 - 3,5%) e hemoglobina F (<1%).[11]
Certas anormalidades xenéticas poden causar que falle o cambio á síntese de hemoglobina adulta, o que orixina unha condición coñecida como persistencia hereditaria da hemoglobina fetal.
Unión do oxíxeno
[editar | editar a fonte]Factores que afectan á afinidade polo oxíxeno
[editar | editar a fonte]Os catro grupos hemo, que son as partes ás que se une o oxíxeno na hemoglobina, son similares na hemoglobina F e noutros tipos de hemoglobina, incluíndo a hemoglobina A. Así, a característica clave que permite que a hemoglobina F se una máis fortemente ao oxíxeno é ter subunidades γ (en vez das β, por exemplo). De feito, algunhas moléculas naturais do noso corpo poden unirse a hemoglobina e cambiar a súa afinidade de unión ao oxíxeno. Unha desas moléculas é 2,3-bisfosfoglicerato (2,3-BPG), que aumenta a capacidade da hemoglobina para liberar o oxíxeno.[12] O 2,3-BPG interacciona moito máis coa hemoglobina A que coa hemoglobina F. Isto débese a que a subunidade β do adulto ten máis cargas positivas que a subunidade fetal γ, que atrae as cargas negativas do 2,3-BPG. Debido á preferencia do 2,3-BPG pola hemoglobina A, a hemoglobina F únese ao oxíxeno con máis afinidade como media.[13]
Unha afinidade polo oxíxeno aínda maior: a hemoglobina de Barts (catro subunidades γ)
[editar | editar a fonte]A hemoglobina de Barts é unha forma anormal de hemoglobina producida na síndrome da hemoglobina de Barts ou alfa-talasemia maior, a forma máis grave de alfa-talasemia. A alfa-talasemia é un trastorno sanguíneo xenético e unha das enfermidades relacionadas coa hemoglobina máis comúns, que afecta á podución das subunidades α da hemoglobina.[14] Dependendo de cantos dos xenes que codifican a subunidade α son afectados (entre un e catro), os pacientes con esta doenza poden ter reducida ata a non produción a expresión xenética da subunidade α da hemoglobina. Como consecuencia, está dispoñible menos hemoglobina e isto afecta a subministración de oxíxeno aos tecidos. A hemoglobina da síndrome de Barts maniféstase cando todos os catro xenes que codifican a subunidade α sufriron deleción. Isto adoita ser mortal para o feto que teña este trastorno, xa que en ausencia de subunidades α, prodúcese unha forma de hemoglobina con catro subunidades γ, chamada hemoglobina de Barts. Esta forma da hemoglobina non é axeitada para o intercambio de oxíxeno precisamente debido á súa moi alta afinidade polo oxíxeno. Aínda que a hemoglobina de Barts é moi eficiente para unirse ao oxíxeno, reteno con tanta forza que non libera o oxíxeno aos órganos e tecidos.[15] A enfermidade é mortal para o feto ou neonato a non ser que se realice unha diagnose e intervención temperáns durante o embarazo e, aínda así, o neno será dependente das transfusións de sangue durante toda a súa vida.
Cuantificación da unión do oxíxeno
[editar | editar a fonte]Para cuantificar a fortaleza coa que se une ao oxíxeno cada tipo de hemoglobina, é dicir, a súa afinidade polo oxíxeno, adoita usarse o parámetro chamado P50. Nunha situación determinada, o P50 pode entenderse como a presión parcial de oxíxeno á cal a hemoglobina está saturada ao 50%.[16] Por exemplo, a hemoglobina F ten un P50 menor que a hemoglobina A. Isto significa que se temos a mesma cantidade de hemoglobina F e hemoglobina A no sangue e engadímoslle oxíxeno, a metade da hemoglobina F se unirá ao oxíxeno antes de que a hemoglobina A consiga facelo. Por tanto, un P50 máis baixo significa unha unión máis forte ou maior afinidade polo oxíxeno.
Como referencia, a P50 da hemoglobina fetal é de aproximadamente do 19 mmHg (unha medida de presión), mentres que a da hemoglobina adulta é de aproximadamente 26,8 mmHg (ver presión parcial dun gas en sangue).[17]
Intecambio de oxíxeno no útero
[editar | editar a fonte]Durante o embarazo o sistema circulatoria da nai envía oxíxeno e nutrientes ao feto e retira o sangue cargado de dióxido de carbono e outros residuos. As circulacións sanguíneas materna e fetal están separadas e o intercambio de moléculas ocorre a través da placenta, nunha rexión chamada espazo interviloso.[3]
Centrándonos no intercambio de oxíxeno, hai tres importantes aspectos que permiten que o oxíxeno pase da circulación materna á fetal. Primeiramente, a presenza de hemoglobina F no feto fai que a unión do oxíxeno a esta molécula sexa máis forte que á hemoglobina A materna (ver #Factores que afectan a afinidade do oxíxeno). En segundo lugar, o torrente sanguíneo da nai é máis rico en oxíxeno que o do feto, así que o oxíxeno de forma natural flúe cara á circulación fetal por difusión.[18] O factor final está relacionado cos efectos do pH na hemoglobina materna e fetal. Como o sangue materno adquire máis dióxido de carbono, faise máis ácido e isto favorece a liberación do oxíxeno pola hemoglobina materna. Ao mesmo tempo, a diminución de dióxido de carbono no sangue fetal faino máis alcalino e favorece a captación de oxíxeno. Isto denomínase efecto Bohr ou efecto Haldane, o cal tamén ocorre no intercambio de aire nos pulmóns.[19] Estes tres factores están presentes simultaneamente e cooperan para mellorar o acceso do feto ao oxíxeno do sangue da nai.
Células F
[editar | editar a fonte]As células F son unha subpoboación de glóbulos vermellos sanguíneos que conteñen hemoglobina F, á vez que outros tipos de hemoglobina. Aínda que son comúns no feto, nos adultos normais só un 3-7% dos glóbulos vermellos conteñen hemoglobina F.[20] A baixa porcentaxe de células F dos adultos débese a dous factores: hai un nivel moi baixo de hemoglobina F e ten unha tendencia a producirse só nun subconxunto de células en vez de distribuírse uniformemente entre todos os glóbulos vermellos. De feito, hai unha correlación positiva entre os niveis de hemoglobina F e o número de células F, de modo que os pacientes con maiores porcentaxes de hemoglobina F teñen tamén unha maior proporción de células F.[21] Malia as correlacións entre os niveis de hemoglobina F e o número de células F, xeralmente determínanse ambos por medición directa. Aínda que a cantidade de hemoglobina F se calcula usando lisados de células, que son fluídos con contidos de células que romperon, o número de células F obtense contando glóbulos vermellos intactos.[20]
Debido á correlación entre a cantidade de hemoglobina F e de células F, o número de células F é maior nalgúns trastornos hereditarios da hemoglobina, como a beta-talasemia, anemia falciforme e persistencia hereditaria da hemoglobina fetal. Adicionalmente, algunhas condicións adquiridas poden tamén ter cantidades maiores de células F, como o estrés eritropoético agudo (resposta a unha mala oxixenación na que se produce unha síntese moi rápida de novos góbulos vermellos) [22] e o embarazo.[20] As células F teñen unha masa de hemoglobina por célula similar comparados cos glóbulos vermellos sen hemoglobina F, a cal se mide polos valores de hemoglobina corpuscular media.[23]
Condicións cunha alta hemoglobina F
[editar | editar a fonte]Durante o embarazo
[editar | editar a fonte]Hai un incremento significativo nos niveis de hemoglobina F durante as primeiras etapas do embarazo. Porén, non está claro se estes niveis son estables ou diminúen a medida que avanza o embarazo, xa que diferentes fontes informan de distintos resultados.[24][25] O incremento de hemoglobina F induce un incremento de 3 a 7 veces máis no número de células F na muller preñada, o cal se observa entre as semanas 23ª á 31ª de xestación.[26] Porén, non parece ser unha proba concluínte da razón do incremento dos niveis de hemoglobina F en mulleres preñadas. Aínda que un estudo inicial suxeriu que os glóbulos vermellos maternos cambian á produción de hemoglobina F durante o embarazo,[26] a literatura máis recente suxire que o incremento da hemoglobina F podería ser, polo menos en parte, debido a que se transfiren glóbulos vermellos fetais á circulación materna.[27][20]
A presenza de altos niveis de hemoglobina F en mulleres embarazadas pode ter un impacto no crecemento do feto, xa que os glóbulos vermellos fetais loitan por competir polo oxíxeno do ssngue materno. Isto débese a que en vez de competir coa hemoglobina A, que ten unha afinidade máis débil polo oxíxeno que a hemoglobina F, a pugna convértese nunha competición entre as hemoglobinas F materna e fetal, que teñen afinidades similares polo oxíxeno. Como resultado, as mulleres con hemoglobina F que supoña >70% do total de hemoglobina é moito máis probable que teñan fetos máis pequenos en relación coa súa idade xestacional (100% dos casos) comparados cos de mulleres con <70% de hemoglobina F (8% dos casos).[28]
Persistencia hereditaria da hemoglobina fetal
[editar | editar a fonte]A persistencia hereditaria da hemoglobina fetal é unha rara doenza xenética benigna na que a produción de hemoglobina F persiste despois dos 12 meses de vida (cando adoita desaparecer) e durante a vida adulta. Como resultado, a hemoglobina F está presente nun maior número de glóbulos vermellos do adulto do que é normal.[29] Non presenta síntomas e descóbrese xeralmente cando se están facendo análises para outras enfermidades realcionadas co sangue. Nesta condición os xenes que codifican a subunidade γ (HBG1 e HBG2) non son suprimidos pouco despois do nacemento. Isto pode acontecer cando aparece unha mutación na rexión promotora de HBG1 e HBG2, impedindo a unión das proteínas BCL11A e ZBTB7A. Estas proteínas uniríanse normalmente ao xene e suprimirían a produción de subunidades γ e como non se poden unir debido á mutación, as subunidades γ seguen producíndose.[9] Hai dous tipos de pacientes desta doenza: cunha copia normal do xene e outra defectuosa (heterocigotos) ou con dúas copias defectuosas (homocigotos). Mentres que os adultos normais teñen menos do 1% de hemoglobina F, os pacientes con só un xene defectuoso teñen un 5-30%. Os pacientes con dúas copias defectuosas poden ter hemoglobina F no 100% dos glóbulos vermellos.[30] Como outras enfermidades como a anemia falciforme poden tamén causar un maior nivel de hemoglobina F, ás veces isto causa malos diagnósticos.[31]
Delta beta-talasemia
[editar | editar a fonte]A delta beta-talasemia é un raro trastorno xenético sanguíneo no cal a produción das subunidades δ e β está reducida ou ausente. Nestres casos, a produción da subunidade γ increméntase para compensar a perda das subunidades δ e β, o que ten como resultado a presenza dunha maior cantidade de hemoglobina F no sangue. Normalmente, a xente ten dous conxuntos de xenes para producir as subunidades δ e β. As persoas que teñen unha copia dos xenes funcional non sofren síntomas e raramente se atopan casos de persoas coas dúas copias afectadas, os cales presentan síntomas leves.[32]
Importancia clínica
[editar | editar a fonte]Tratamento da anemia falciforme
[editar | editar a fonte]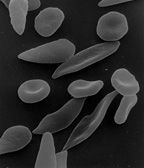
O descubrimento de que a hemoglobina F aliviaba os síntomas da anemia falciforme fíxose en 1948. Janet Watson observou que os glóbulos vermellos dos meniños con esta enfermidade tardaban máis en tomar forma de lúa crecente e non se deformaban moito comparados cos glóbulos das nais que portaban esta característica. Posteriormente, observouse que os pacientes que tiñan anemia falciforme e á vez persistencia hereditaria da hemoglobina F non tiñan síntomas.[33] Ademais, nos pacientes de anemia falciforme, as células F tiñan unha vida máis longa que as non F, xa que contiñan hemoglobina F.
Cando a produción de hemoglobina fetal se detén despois do nacemento, os nenos normais empezan a producir hemoglobina adulta (HbA). Os nenos con anemia falciforme empezan a producir unha forma defectuosa de hemoglobina chamada hemoglobina S, que forma cadeas que se agrupan causando que os glóbulos vermellos cambien a súa forma de redonda a de lúa crecente.[34] Estes glóbulos vermellos anormais teñen unha vida moito máis curta do normal (10–20 días comparados con ata 120 días nos glóbulos normais).[35] Tamén teñen unha gran tendencia a aglomerarse e bloquear os vasos sanguíneos pequenos, impedindo que o sangue forneza oxíxeno aos tecidos. Isto orixina a denominada crise vaso-oclusiva, que é unha marca distintiva desta doenza.[36] Se a hemoglobina fetal permanece relativamente alta despois do nacemento, o número de episodios de dor diminúe nos pacientes de anemia falciforme e teñen un mellor prognóstico.[37] O papel da hemoglobina fetal na redución da gravidade da enfermidade procede da súa capacidade de alterar a formación de cadeas de hemoglobina S dentro dos glóbulos vermellos.[38] Un dato interesante é que mentres que uns maiores niveis de hemoglobina F foron asociados coa mellora dalgúns síntomas, incluíndo a frecuencia de episodios de dor, úlceras nas pernas e gravidade xeral da doenza, estes non teñen correlación con outros. Algúns exemplos son o priapismo, accidente cerebrovascular e presión arterial sistémica alta.[33] Como a hemoglobina F só a producen algúns glóbulos vermellos, e en diferentes cantidades, só unha subpoboación de células están protexidas contra a deformación falciforme. Podería ser que os síntomas que non prevén a hemoglobina F alta son bastante sensibles á rotura das células non F falciformes.[33]
A hidroxiurea é un composto químico que promove a produción de hemoglobina fetal e reduce a rotura prematura dos glóbulos vermellos.[6][39] A terapia de combinación con hidroxiurea e eritropoetina recombinante (en vez do tratamento con hidroxiurea soa) eleva máis os niveis de hemoglobina F e promove o desenvolvemento das células F que conteñen hemoglobina F.[40]
A hemoglobina F como marcador para os cancros
[editar | editar a fonte]Algúns estudos avaliaron a posibilidade de usar a hemoglobina F como indicador da prognose do cancro. Suxeriurse que as concentracións elevadas de hemoglobina F poden atoparse nos tipos principais de tumores sólidos e nos cancros sanguíneos.[41] Exemplos son a leucemia linfoblástica aguda e a leucemia mieloide en nenos, nos que concentracións máis altas de hemoglobina F foron asociadas cun peor resultado da enfermidade, incluíndo un maior risco de recaída ou morte.[42] Outros tipos de cancro nos que se observaron niveis maiores de hemoglobina F son o cancro de células transicionais,[43] o carcinoma colorrectal[44] e varios tipos de blastomas.[45] De feito, en varios tipos de blastomas, incluíndo o neuroblastoma e o retinoblastoma (que afectan a células nerviosas e aos ollos, respectivamente), atopáronse células F en vasos sanguíneos neoformados e nos espazos entre as células tumorais. Grupos de células F tamén están presentes na medula ósea dalgúns destes pacientes.[45] Cómpre facer notar que a hemoglobina F non a producen directamente as células tumorais, senón que a súa produción parece ser inducida polo ambiente biolóxico xerado polo cancro nas células sanguíneas veciñas. Unha razón que se suxeriu para este incremento de hemoglobina F é que pode favorecer o crecemento do cancro ao proporcionar unha mellor subministración de oxíxeno ás células cancerosas en desenvolvemento.[43] En adultos, pénsase que o incremento da produción de hemoglobina F é causada por factores que levan á activación do xene que codifica a subunidade γ, como a desmetilación do ADN (que pode activar xenes normalmente silenciosos e é unha marca característica do cancro).[46]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Linch, David (1998). Encyclopedia of Immunology (2ª ed.). Elsevier. ISBN 978-0-12-226765-9.
- ↑ Schechter AN (novembro de 2008). "Hemoglobin research and the origins of molecular medicine". Blood 112 (10): 3927–38. PMC 2581994. PMID 18988877. doi:10.1182/blood-2008-04-078188.
- ↑ 3,0 3,1 Wang Y, Zhao S (2010). "Capítulo 2: Placental Blood Circulation". Vascular Biology of the Placenta. Morgan & Claypool Life Sciences.
- ↑ 4,0 4,1 4,2 Wild, Barbara (2017). Dacie and Lewis Practical Haematology (12ª ed.). Elsevier. ISBN 978-0-7020-6696-2.
- ↑ Sripichai O, Fucharoen S (decembro de 2016). "Fetal hemoglobin regulation in β-thalassemia: heterogeneity, modifiers and therapeutic approaches". Expert Review of Hematology 9 (12): 1129–1137. PMID 27801605. doi:10.1080/17474086.2016.1255142.
- ↑ 6,0 6,1 Lanzkron S, Strouse JJ, Wilson R, Beach MC, Haywood C, Park H, et al. (xuño 2008). "Systematic review: Hydroxyurea for the treatment of adults with sickle cell disease". Annals of Internal Medicine 148 (12): 939–55. PMC 3256736. PMID 18458272. doi:10.7326/0003-4819-148-12-200806170-00221.
- ↑ Costanzo, Linda S. (2007). Physiology. Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0781773119.
- ↑ Farashi S, Harteveld CL (maio de 2018). "Molecular basis of α-thalassemia". Blood Cells, Molecules & Diseases 70: 43–53. PMID 29032940. doi:10.1016/j.bcmd.2017.09.004.
- ↑ 9,0 9,1 9,2 Martyn GE, Wienert B, Yang L, Shah M, Norton LJ, Burdach J, et al. (abril de 2018). "Natural regulatory mutations elevate the fetal globin gene via disruption of BCL11A or ZBTB7A binding". Nature Genetics 50 (4): 498–503. PMID 29610478. doi:10.1038/s41588-018-0085-0.
- ↑ Karakaş Z, Koç B, Temurhan S, Elgün T, Karaman S, Asker G, et al. (decembro de 2015). "Evaluation of Alpha-Thalassemia Mutations in Cases with Hypochromic Microcytic Anemia: The İstanbul Perspective". Turkish Journal of Haematology 32 (4): 344–50. PMC 4805326. PMID 26377141. doi:10.4274/tjh.2014.0204.
- ↑ Thomas C, Lumb AB (2012). "Physiology of haemoglobin". Continuing Education in Anaesthesia, Critical Care & Pain 12 (5): 251–256. doi:10.1093/bjaceaccp/mks025.
- ↑ Litwack G (2018). "Chapter 8 – Glycolysis and Gluconeogenesis". Human Biochemistry. Academic press. ISBN 978-0-12-383864-3.
- ↑ Sears, Duane (2016). "Comparing the molecular structure differences between HbF and HbA that affect BPG binding". Biosci Portal. Consultado o 11 de marzo de 2020.
- ↑ Galanello R, Cao A (febreiro de 2011). "Gene test review. Alpha-thalassemia". Genetics in Medicine 13 (2): 83–8. PMID 21381239. doi:10.1097/GIM.0b013e3181fcb468.
- ↑ Forget BG, Bunn HF (febreiro de 2013). "Classification of the disorders of hemoglobin". Cold Spring Harbor Perspectives in Medicine 3 (2): a011684. PMC 3552344. PMID 23378597. doi:10.1101/cshperspect.a011684.
- ↑ Awasthi V, Goins E, Phillips W (2006). "Capítulo 43 – Liposome-encapsulated hemoglobin: history, preparation and evaluation". Blood Substitutes. Academic press. ISBN 978-0-12-759760-7.
- ↑ Yacov R, Derek K, Namasivayam A (2017). "Chapter 10 – Blood gases: technical aspects and interpretation". Assisted Ventilation of the Neonate (6ª ed.). Elsevier. ISBN 978-0-323-39006-4.
- ↑ Metcalfe J, Bartels H, Moll W (outubro de 1967). "Gas exchange in the pregnant uterus". Physiological Reviews 47 (4): 782–838. PMID 4964061. doi:10.1152/physrev.1967.47.4.782.
- ↑ Griffiths S, Campbell J (2015). "Placental structure, function and drug transfer". Continuing Education in Anaesthesia, Critical Care & Pain 15 (2): 84–89. doi:10.1093/bjaceaccp/mku013.
- ↑ 20,0 20,1 20,2 20,3 Italia KY, Colah R, Mohanty D (decembro de 2007). "Evaluation of F cells in sickle cell disorders by flow cytometry -- comparison with the Kleihauer-Betke's slide method". International Journal of Laboratory Hematology 29 (6): 409–14. PMID 17988294. doi:10.1111/j.1365-2257.2006.00884.x.
- ↑ Wood WG, Stamatoyannopoulos G, Lim G, Nute PE (novembro de 1975). "F-cells in the adult: normal values and levels in individuals with hereditary and acquired elevations of Hb F". Blood 46 (5): 671–82. PMID 1100141. doi:10.1182/blood.V46.5.671.bloodjournal465671.
- ↑ Kim TS, Hanak M, Trampont PC, Braciale TJ (outubro de 2015). "Stress-associated erythropoiesis initiation is regulated by type 1 conventional dendritic cells". The Journal of Clinical Investigation 125 (10): 3965–80. PMC 4607133. PMID 26389678. doi:10.1172/JCI81919.
- ↑ Dover GJ, Boyer SH (April 1987). "Fetal hemoglobin-containing cells have the same mean corpuscular hemoglobin as cells without fetal hemoglobin: a reciprocal relationship between gamma- and beta-globin gene expression in normal subjects and in those with high fetal hemoglobin production". Blood 69 (4): 1109–13. PMID 2435342. doi:10.1182/blood.V69.4.1109.bloodjournal6941109.
- ↑ Ibrahim M, Qari MH, Sait W, Abulela M (2009). "Pattern of HB F level rise during normal pregnancies". Hemoglobin 33 (6): 534–8. PMID 19958203. doi:10.3109/03630260903332981.
- ↑ Yamada T, Morikawa M, Yamada T, Nishida R, Takeda M, Kawaguchi S, Minakami H (xaneiro de 2013). "Changes in hemoglobin F levels in pregnant women unaffected by clinical fetomaternal hemorrhage". Clinica Chimica Acta; International Journal of Clinical Chemistry 415: 124–7. PMID 23073220. doi:10.1016/j.cca.2012.10.002. hdl:2115/53256.
- ↑ 26,0 26,1 Boyer SH, Belding TK, Margolte L, Noyes AN, Burke PJ, Bell WR (setembro de 1975). "Variations in the frequency of fetal hemoglobin-bearing erythrocytes (F-cells) in well adults, pregnant women, and adult leukemics". The Johns Hopkins Medical Journal 137 (3): 105–15. PMID 810611.
- ↑ Dana M, Fibach E (marzo de 2018). "Fetal Hemoglobin in the Maternal Circulation - Contribution of Fetal Red Blood Cells". Hemoglobin 42 (2): 138–140. PMID 29745271. doi:10.1080/03630269.2018.1466712.
- ↑ Murji A, Sobel ML, Hasan L, McLeod A, Waye JS, Sermer M, Berger H (febreiro de 2012). "Pregnancy outcomes in women with elevated levels of fetal hemoglobin". The Journal of Maternal-Fetal & Neonatal Medicine 25 (2): 125–9. PMID 21473677. doi:10.3109/14767058.2011.564241.
- ↑ Hemosh, Ada (9 de setembro de 2014). "FETAL HEMOGLOBIN QUANTITATIVE TRAIT LOCUS 1; HBFQTL1". OMIM. Johns Hopkins University. Consultado o 15 de marzo de 2020.
- ↑ Thein SL, Craig JE (1998). "Genetics of Hb F/F cell variance in adults and heterocellular hereditary persistence of fetal hemoglobin". Hemoglobin 22 (5–6): 401–14. PMID 9859924. doi:10.3109/03630269809071538.
- ↑ Shaukat I, Pudal A, Yassin S, Höti N, Mustafa S (2018). "Blessing in disguise; a case of Hereditary Persistence of Fetal Hemoglobin". Journal of Community Hospital Internal Medicine Perspectives 8 (6): 380–381. PMC 6292363. PMID 30559951. doi:10.1080/20009666.2018.1536241.
- ↑ Wahed A, Dasgupta A (2015). "Chapter 4 – Hemoglobinopathes and Thalassemias". Hematology and Coagulation. Elsevier. ISBN 978-0-12-800241-4.
- ↑ 33,0 33,1 33,2 Akinsheye I, Alsultan A, Solovieff N, Ngo D, Baldwin CT, Sebastiani P, et al. (xullo de 2011). "Fetal hemoglobin in sickle cell anemia". Blood 118 (1): 19–27. PMC 3139383. PMID 21490337. doi:10.1182/blood-2011-03-325258.
- ↑ "Sickle cell disease". U.S. National Library of Medicine. NIH. 2020-03-15. Consultado o 2020-03-15.
- ↑ "Sickle Cell Disease". Johns Hopkins Medicine. The Johns Hopkins University, The Johns Hopkins Hospital, and Johns Hopkins Health System. 2020. Consultado o 16 de abril de 2020.
- ↑ Manwani D, Frenette PS (December 2013). "Vaso-occlusion in sickle cell disease: pathophysiology and novel targeted therapies". Blood 122 (24): 3892–8. PMC 3854110. PMID 24052549. doi:10.1182/blood-2013-05-498311.
- ↑ Akinsheye I, Solovieff N, Ngo D, Malek A, Sebastiani P, Steinberg MH, Chui DH (febreiro de 2012). "Fetal hemoglobin in sickle cell anemia: molecular characterization of the unusually high fetal hemoglobin phenotype in African Americans". American Journal of Hematology 87 (2): 217–9. PMC 3302931. PMID 22139998. doi:10.1002/ajh.22221.
- ↑ Ma Q, Wyszynski DF, Farrell JJ, Kutlar A, Farrer LA, Baldwin CT, Steinberg MH (decembro de 2007). "Fetal hemoglobin in sickle cell anemia: genetic determinants of response to hydroxyurea". The Pharmacogenomics Journal 7 (6): 386–94. PMID 17299377. doi:10.1038/sj.tpj.6500433.
- ↑ Charache S, Terrin ML, Moore RD, Dover GJ, Barton FB, Eckert SV, et al. (maio de 1995). "Effect of hydroxyurea on the frequency of painful crises in sickle cell anemia. Investigators of the Multicenter Study of Hydroxyurea in Sickle Cell Anemia". The New England Journal of Medicine 332 (20): 1317–22. PMID 7715639. doi:10.1056/NEJM199505183322001.
- ↑ Rodgers GP, Dover GJ, Uyesaka N, Noguchi CT, Schechter AN, Nienhuis AW (xaneiro de 1993). "Augmentation by erythropoietin of the fetal-hemoglobin response to hydroxyurea in sickle cell disease". The New England Journal of Medicine 328 (2): 73–80. PMID 7677965. doi:10.1056/NEJM199301143280201.
- ↑ Wolk M, Newland AC, De La Salle B (1999). "Refinement of plasma fetal hemoglobin (HbF) measurements, as related to whole blood HbF, in cancer patients". Journal of Tumor.
- ↑ Rautonen J, Siimes MA (July 1990). "Initial blood fetal hemoglobin concentration is elevated and is associated with prognosis in children with acute lymphoid or myeloid leukemia". Blut 61 (1): 17–20. PMID 1696840. doi:10.1007/BF01739428.
- ↑ 43,0 43,1 Wolk M, Martin JE (xullo de 2012). "Fetal haemopoiesis marking low-grade urinary bladder cancer". British Journal of Cancer 107 (3): 477–81. PMC 3405209. PMID 22735903. doi:10.1038/bjc.2012.268.
- ↑ Wolk M, Martin JE, Reinus C (xuño de 2006). "Development of fetal haemoglobin-blood cells (F cells) within colorectal tumour tissues". Journal of Clinical Pathology 59 (6): 598–602. PMC 1860403. PMID 16469830. doi:10.1136/jcp.2005.029934.
- ↑ 45,0 45,1 Wolk M, Martin JE, Nowicki M (agosto de 2007). "Foetal haemoglobin-blood cells (F-cells) as a feature of embryonic tumours (blastomas)". British Journal of Cancer 97 (3): 412–9. PMC 2360326. PMID 17595660. doi:10.1038/sj.bjc.6603867.
- ↑ Cheishvili D, Boureau L, Szyf M (xuño de 2015). "DNA demethylation and invasive cancer: implications for therapeutics". British Journal of Pharmacology 172 (11): 2705–15. PMC 4439869. PMID 25134627. doi:10.1111/bph.12885.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Hemoglobinopatías
- Transporte a través da placenta
- SCDAA: Break The Sickle Cycle
- Síntese da hemoglobina
- Hemoglobina, estrutura e función (arquivado o 3 de febreiro de 2002
- Hemoglobina F folla de datos (arquivado o 29 de outubro de 2009)
- Hemoglobina fetal (arquivo doc; arquivado o 30 de marzo de 2003)
- Hydroxiurea na anemia falciforme (arquivado o 28 de decembro de 2014 en [2])
- Capítulo 26 Fetal Hemoglobin Induction; Management of Sickle-Cell Disease 4ª edición 2002 (NIH Publication No. 02-2117)
