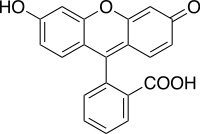
Fluoresceína
| Fluoresceína | |
|---|---|
 | |
 | |
 | |
3′,6′-dihidroxispiro[isobenzofuran-1(3H),9′-[9H]xanten]-3-ona | |
Outros nomes Fluoresceína, resorcinolftaleína, C.I. 45350, solvente amarelo 94, amarelo D & C no. 7, angiofluor, amarelo do Xapón 201, amarelo de xabón | |
| Identificadores | |
| Número CAS | 2321-07-5 |
| PubChem | 16850 |
| ChemSpider | 15968 |
| UNII | TPY09G7XIR |
| Número CE | 219-031-8 |
| DrugBank | DB00693 |
| KEGG | D01261 |
| MeSH | Fluorescein |
| ChEBI | CHEBI:31624 |
| ChEMBL | CHEMBL177756 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C20H12O5 |
| Masa molar | 332,31 g mol−1 |
| Densidade | 1,602 g/mL |
| Punto de fusión | 314–316 °C; 597–601 °F; 587–589 K |
| Solubilidade en auga | Lixeira |
| Perigosidade | |
| Pictogramas GHS | 
|
| Palabra sinal GHS | Advertencia |
| declaración de perigosidade GHS | 319 |
| declaración de precaución GHS | 305, 351, 338 |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
A fluoresceína é un composto orgánico e unha tinguidura. Está dispoñible en forma de po de cor laranxa escura/vermella lixeiramente soluble en auga e alcohol. Utilízase amplamente como rastreador fluorescente en moitas aplicacións.[1]
A fluoresceína é un fluoróforo utilizado comunmente en microscopía, nun tipo de láser de colorante como medio láser activo, en ciencias forenses e seroloxía para detectar manchas de sangue ocultas, e en trazado de tinguiduras. Os principais derivados son o isotiocianato de fluoresceína (FITC) e, en síntese de oligonucleótidos, o 6-FAM fosforamidito.
A cor da súa solución acuosa varía de verde a laranxa en función do modo en que é observada: por reflexión ou por transmisión, como se pode ver en medidores de nivelación con burbulla, por exemplo, nos cales a fluoresceína se engade como colorante para o alcohol que enche o tubo para incrementar a visibilidade das burbullas de aire contidas no seu interior (o que mellora a precisión do instrumento). As solucións máis concentradas de fluoresceína mesmo poden parecer vermellas.
Este composto figura na Lista de medicinas esenciais da Organización Mundial da Saúde, que inclúe os medicamentos máis importantes necesarios para un sistema sanitario básico.[2]
Usos
[editar | editar a fonte]Investigación bioquímica
[editar | editar a fonte]En bioloxía celular, o derivado isotiocianato da fluoresceína é a miúdo utilizado para etiquetar e rastrear células en aplicacións de microscopía de fluorescencia (por exemplo, citometría de fluxo). Outras moléculas bioloxicamente activas (como anticorpos) poden tamén ser unidas á fluoresceína, o que permite dirixir o fluoróforo a proteínas específicas ou estruturas do interior das células. Esta aplicación é común na técnica da yeast display.
A fluoresceína pode tamén ser conxugada a nucleósidos trifosfato e incorporada encimaticamente a sondas para a hibridación in situ. O uso de fluoresceína amidito permite sintetizar oligonucleótidos etiquetados para o mesmo propósito. Outra técnica denominada baliza molecular usa oligonucleótidos etiquetados con fluoresceína sintética. As sondas etiquetadas con fluoresceína poden servir para obter unha imaxe usando hibridación in situ fluorescente (FISH), ou son a diana de anticorpos en inmunohistoquímica. Isto último é unha alternativa común ao uso de digoxixenina, e ambas son usadas conxuntamente para etiquetar dous xenes nunha soa mostra.[3]
Uso médico
[editar | editar a fonte]
A fluoresceína de sodio, que é o sal sódico de fluoresceína, utilízase moito como ferramenta de diagnóstico nos eidos da oftalmoloxía e optometría, nos que se utiliza a fluoresceína tópica no diagnóstico da abrasión corneal, úlcera corneal e infección corneal herpética. Tamén se utiliza nas lentes de contacto ríxidas permeables aos gases para avaliar a capa de bágoas baixo a lente. Está dispoñible en forma de bolsiñas de uso único estériles que conteñen aplicadores de papel sen penuxe bañados en fluoresceína de sodio.[4]
A fluoresceína intravenosa ou oral utilízase na anxiografía de floresceína en investigación e para diagnosticar e categorizar trastornos vasculares como as enfermidades retinais dexeneración macular, retinopatía diabética, condicións intraoculares inflamatorias e tumores intraoculares. Tamén ten un uso crecente durante a cirurxía de tumores cerebrais.
A tinguidura de fluoresceína diluída foi utilizada para localizar defectos do septo ventricular múltiples durante a cirurxía a corazón aberto e confirmar a presenza de calquera defecto residual.[5]

Ciencias da Terra
[editar | editar a fonte]A fluoresceína utilízase como un trazador de fluxo bastante conservador en probas hidrolóxicas para intentar comprender como son os fluxos de auga superficiais e baixo a superficie. Pode engadirse a tinguidura á auga de chuvia en probas de simulación ambientais para axudar a localizar e analizar as filtracions de auga, e en Australia e Nova Zelandia como unha tinguidura para o alcohol desnaturalizado.
Como as solucións de fluoresceína cambian de cor dependendo da súa concentración,[6] foi utilizada como trazador en experimentos de evaporación.
Un dos seus usos máis curiosos foi para tinguir de verde as augas do río Chicago durante a celebración do día de San Patricio en 1962. Non obstante, en 1966, as protestas dos conservacionistas da natureza fixeron que a fluoresceína fose substituída para este uso por tinguiduras de orixe vexetal inocuas, para protexer así a vida silvestre local.[7]
Ciencias botánicas
[editar | editar a fonte]A fluoresceína foi usada con frecuencia para rastrear o movemento da auga subterránea para estudar o fluxo de auga e observar áreas de contaminación ou obstrución neses sistemas. A fluorescencia que xera fai que as áreas problemáticas sexan máis visibles e doadamente identificadas. Un concepto similar pode aplicarse ás plantas porque con esta tinguidura poden visualizarse mellor os problemas nas plantas vasculares. En botánica, a fluoresceína, e outras tinguiduras fluorescentes, foron utilizadas para monitorizar e estudar o tecido vascular das plantas, especialmente o xilema, que é a principal vía de transporte de auga nas plantas. Isto débese a que a fluoresceína é móbil dentro do xilema pero incapaz de cruzar a membrana plasmática, polo que é especialmente útil para trazar o movemento da auga polo xilema.[8] A fluoresceína pode introducirse nos tecidos vasculares da planta polas raíces ou por un talo cortado. Absórbese polas raíces xunto coa auga e móvese ata a parte superior da planta debido ao pulo creado pola transpiración.[9] A fluoresceína absorbida pola planta pode ser visualizada con microscopio de fluorescencia.
Aplicación en campos petrolíferos
[editar | editar a fonte]As solucións de fluoresceína, normalmente activas ao 15%, son utilizadas comunmente para axudar á detección durante probas hidrostáticas de oleodutos e gasodutos submarinos e outras infraestruturas submarinas. Deste modo, uns mergulladores que leven luces ultravioleta poden detectar as filtracións.
Cosmética
[editar | editar a fonte]A fluoresceína é tamén coñecida como un aditivo colorante en produtos cosméticos, como no Amarelo D&C número 7 (ou D&C Yellow no. 7). O sal disódico da fluoresceína denomínase uranina ou Amarelo D&C número 8 (ou D&C Yellow no. 8).
Seguridade
[editar | editar a fonte]O uso tópico, oral e intravenoso da fluoresceín pode causar reaccións adversas, como náuseas, vómitos, urticarias, hipotensión aguda, anafilaxe e reaccións anfilactoides relacionadas,[10][11] causando parada cardíaca[12] e morte súbita debido ao choque anafiláctico.[13][14]
A reacción adversa máis común é a náusea, debido en parte a unha diferenza no pH do corpo e o pH da fluoresceína de sodio. A náusea é xeralmente transitoria e diminúe rapidamente. Os proídos poden ser desde unha molestia menor a bastante graves, e unha soa dose de antihistamina pode proporcionar un completo alivio. O shock anafiláctico e a subseguinte parada cardíaca e morte súbita son moi raros, pero como ocoren en cuestión de minutos, debería estar preparada unha clínica que use fluoresceína para realizar unha reanimación de emerxencia.
O uso intravenoso é o que produce reaccións máis adversas, incluíndo a morte súbita, mais isto pode reflectir un uso en maior cantidade máis que un risco maior. Os usos oral e tópico poden orixinar anafilaxe.[15][16] e informouse dun caso de anafilaxe con parada cardíaca (que foi reanimado) despois do seu uso tópico en forma de pingas oculares.[12] As taxas de reaccións adversas varían desde o 1% ao 6%.[17][18][19][20] As taxas maiores poden reflectir que as poboacións estudadas teñen unha alta porcentaxe de persoas con reaccións adversas anteriores. O risco dunha reacción adversa é 25 veces maior se a persoa tivo anteriormente unha reacción adversa.[19] O risco pode reducirse cun uso profiláctico previo de antihistamínicos[21] e unha rápida atención de emerxencia de calquera síntoma de anafilaxe.[22] Unha proba simple cunha picada pode servir para identificar as persoas que teñen maior risco de sufrir reaccións adversas.[20]
Derivados
[editar | editar a fonte]
Coñécense moitos derivados da fluoresceína. Exemplos son:
- Isotiocianato de fluoresceína 1, que se adoita abreviar como FITC, que leva un grupo substituínte isotiocianato (−N=C=S). O FITC reacciona cos grupos amina de moitos compostos biolóxicos relevantes incluíndo proteínas intracelulares para formar un enlace de tiuourea.
- Fluoresceína modificada con éster succinimidilo ou NHS-fluoresceína, que é outro derivado reactivo ao amino común, que rende adutos amida que son máis estables que as devanditas tioureas.
- Outros: a carboxifluoresceína, o éster succinimidilo de carboxifluoresceína, os ésteres pentafluorofenil (PFP) e os ésteres tetrafluorofenil (TFP) son outros reactivos útiles.
Na síntese de oligonucleótidos, varios reactivos fosforamidito que conteñen fluoresceína protexida, por exemplo o 6-FAM fosforamidito 2,[23] utilízanse para a preparación de oligonucleótidos etiquetdos con fluoresceína.
Outras tinguiduras verdes son Oregon Green, Tokyo Green, SNAFL e carboxinaftofluoresceína. Estas tinguiduras, xunto con novos fluoróforos como Alexa 488, FluoProbes 488 e DyLight 488, foron adaptados para o seu uso en varias aplicacións químicas e biolóxicas, onde cómpre unha maior fotoestabilidade, diferentes características espectrais ou presenza de distintos grupos unidos.
A proporción en que o dilaurato de fluoresceína é degradado rendendo ácido láurico pode ser detectada para medir a actividade da esterase pancreática.
Síntese
[editar | editar a fonte]A fluoresceína foi sintetizada por primeira vez por Adolf von Baeyer en 1871.[24] Pode prepararse a partir de anhídrido ftálico e resorcinol en presenza de cloruro de zinc por medio da reacción de Friedel-Crafts.

Un segundo método para preparar fluoresceína utiliza ácido metanosulfónico como ácido de Brønsted catalizador. Esta ruta ten un alto rendemento en condicións máis suaves.[25][26]
Notas
[editar | editar a fonte]- ↑ Gessner, Thomas; Mayer, Udo (2000). "Triarylmethane and Diarylmethane Dyes". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a27_179.
- ↑ "WHO Model List of Essential Medicines (19th List)" (PDF). World Health Organization. April 2015. Arquivado dende o orixinal (PDF) o 13 December 2016. Consultado o 8 December 2016.
- ↑ Noga E. J., Udomkusonsri, P. (2002). "Fluorescein: A Rapid, Sensitive, Nonlethal Method for Detecting Skin Ulceration in Fish" (PDF). Vet Pathol 39 (6): 726–731(6). PMID 12450204. doi:10.1354/vp.39-6-726. Arquivado dende o orixinal (PDF) o 28 de setembro de 2007. Consultado o 2007-07-16.
- ↑ "New Drugs". Can Med Assoc J 80 (12): 997–998. 1959. PMC 1831125. PMID 20325960.
- ↑ Mathew, Thomas (2014). "Use of Fluorescein Dye to Identify Residual Defects". Ann Thorac Surg 97 (1): e27–8. ISSN 0003-4975. PMID 24384220. doi:10.1016/j.athoracsur.2013.10.059.
- ↑ Käss, W. Tracing Technique in Geohydrology. Rotterdam: Balkema.
- ↑ The Story Behind Dyeing the River Green. Greenchicagoriver.com. Retrieved on 2014-08-28.
- ↑ Salih, Anya; Tjoelker, Mark G.; Renard, Justine; Pfautsch, Sebastian (2015-03-01). "Phloem as Capacitor: Radial Transfer of Water into Xylem of Tree Stems Occurs via Symplastic Transport in Ray Parenchyma". Plant Physiology 167 (3): 963–971. ISSN 0032-0889. PMC 4348778. PMID 25588734. doi:10.1104/pp.114.254581.
- ↑ Duran-Nebreda S, Bassel G (July 2017). "Fluorescein Transport Assay to Assess Bulk Flow of Molecules Through the Hypocotyl in Arabidopsis thaliana". Bio-Protocol 8 (7): e2791. doi:10.21769/bioprotoc.2791.
- ↑ "The diagnosis and management of anaphylaxis. Joint Task Force on Practice Parameters, American Academy of Allergy, Asthma and Immunology, American College of Allergy, Asthma and Immunology, and the Joint Council of Allergy, Asthma and Immunology" (PDF). The Journal of Allergy and Clinical Immunology 101 (6 Pt 2): S465–528. 1998. PMID 9673591. doi:10.1016/S0091-6749(18)30566-9. Arquivado dende o orixinal (PDF) o 2015-07-24.
- ↑ The diagnosis and management of anaphylaxis: an updated practice parameter. Arquivado 05 de agosto de 2007 en Wayback Machine. National Guideline Clearinghouse.
- ↑ 12,0 12,1 El Harrar, N; Idali, B; Moutaouakkil, S; El Belhadji, M; Zaghloul, K; Amraoui, A; Benaguida, M (1996). "Anaphylactic shock caused by application of fluorescein on the ocular conjunctiva". Presse Médicale 25 (32): 1546–7. PMID 8952662.
- ↑ Fineschi V, Monasterolo G, Rosi R, Turillazzi E (1999). "Fatal anaphylactic shock during a fluorescein angiography". Forensic Sci. Int. 100 (1–2): 137–42. PMID 10356782. doi:10.1016/S0379-0738(98)00205-9.
- ↑ Hitosugi M, Omura K, Yokoyama T, Kawato H, Motozawa Y, Nagai T, Tokudome S (2004). "An autopsy case of fatal anaphylactic shock following fluorescein angiography: a case report". Med Sci Law 44 (3): 264–5. PMID 15296251. doi:10.1258/rsmmsl.44.3.264.
- ↑ Kinsella FP, Mooney DJ (1988). "Anaphylaxis following oral fluorescein angiography". Am. J. Ophthalmol. 106 (6): 745–6. PMID 3195657. doi:10.1016/0002-9394(88)90716-7.
- ↑ Gómez-Ulla F, Gutiérrez C, Seoane I (1991). "Severe anaphylactic reaction to orally administered fluorescein". Am. J. Ophthalmol. 112 (1): 94. PMID 1882930. doi:10.1016/s0002-9394(14)76222-1.
- ↑ Kwan AS, Barry C, McAllister IL, Constable I (2006). "Fluorescein angiography and adverse drug reactions revisited: the Lions Eye experience". Clin. Experiment. Ophthalmol. 34 (1): 33–8. PMID 16451256. doi:10.1111/j.1442-9071.2006.01136.x.
- ↑ Jennings BJ, Mathews DE (1994). "Adverse reactions during retinal fluorescein angiography". J Am Optom Assoc 65 (7): 465–71. PMID 7930354.
- ↑ 19,0 19,1 Kwiterovich KA, Maguire MG, Murphy RP, Schachat AP, Bressler NM, Bressler SB, Fine SL (1991). "Frequency of adverse systemic reactions after fluorescein angiography. Results of a prospective study". Ophthalmology 98 (7): 1139–42. PMID 1891225. doi:10.1016/s0161-6420(91)32165-1.
- ↑ 20,0 20,1 Matsuura M, Ando F, Fukumoto K, Kyogane I, Torii Y, Matsuura M (1996). "[Usefulness of the prick test for anaphylactoid reaction in intravenous fluorescein administration]". Nippon Ganka Gakkai Zasshi (en Japanese) 100 (4): 313–7. PMID 8644545.
- ↑ Ellis PP, Schoenberger M, Rendi MA (1980). "Antihistamines as prophylaxis against side reactions to intravenous fluorescein". Trans Am Ophthalmol Soc 78: 190–205. PMC 1312139. PMID 7257056.
- ↑ Yang CS, Sung CS, Lee FL, Hsu WM (2007). "Management of anaphylactic shock during intravenous fluorescein angiography at an outpatient clinic". J Chin Med Assoc 70 (8): 348–9. PMID 17698436. doi:10.1016/S1726-4901(08)70017-0.
- ↑ Brush, C. K. "Fluorescein Labelled Phosphoramidites". US Patent 5583236. Priority date July 19, 1991.
- ↑ Baeyer, Adolf (1871) "Uber ein neue Klasse von Farbstoffen" Arquivado 2016-06-29 en Wayback Machine. (On a new class of dyes), Berichte der Deutschen chemischen Gesellschaft zu Berlin, 4 : 555-558 ; see p. 558.
- ↑ Sun, W. C.; Gee, K. R.; Klaubert, D. H.; Haugland, R. P. (1997). "Synthesis of Fluorinated Fluoresceins". The Journal of Organic Chemistry 62 (19): 6469–6475. doi:10.1021/jo9706178.
- ↑ Burgess, Kevin; Ueno, Yuichiro; Jiao, Guan-Sheng (2004). "Preparation of 5- and 6-Carboxyfluorescein". Synthesis 2004 (15): 2591–2593. doi:10.1055/s-2004-829194.
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Fluoresceína |
Outros artigos
[editar | editar a fonte]- Derivados químicos da fluoresceína:
- Eosina
- Calceína
- Fluoresceína amidito (FAM)
- Merbromina
- Eritrosina
- Rosa bengala
- DyLight Fluor, unha liña de produtos de tinguiduras fluorescentes
- hidrolise de diacetato de fluoresceína, unha proba bioquímica de laboratorio
- Outras tinguiduras:
