Hélice alfa
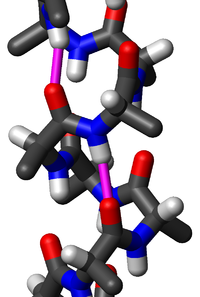

A hélice alfa (hélice α) é unha estrutura secundaria das proteínas moi común e é unha conformación en espiral dextroxira (enroscada cara á dereita) ou hélice na cal cada grupo N-H pertencente ao N do enlace peptídico doa un enlace de hidróxeno a un grupo C=O do C do enlace peptídico doutro residuo de aminoácido situado catro residuos antes (enlace de hidróxeno ). Como cada aminoácido ten un grupo N-H e un grupo C=O, todos os aminoácidos da hélice establecen dúas pontes de hidróxeno, unha co cuarto aminoácido superior na hélice e outro co cuarto aminoácido inferior, os cales estabilizan a forma da hélice. As cadeas laterais dos aminoácidos están na parte externa da hélice. Esta estrutura secundaria tamén se denomina ás veces hélice alfa de Pauling–Corey–Branson clásica (véxase máis abaixo). Tamén se usa para ela o nome hélice 3,613, que indica o número de residuos por xiro de hélice (paso de rosca), que son 3,6, e que están implicados 13 átomos no anel formado pola ponte de hidróxeno. Entre os tipos de estruturas locais das proteínas, a hélice α é a máis regular e a máis predicible a partir da secuencia de aminoácidos, e tamén a máis frecuente.
Descubrimento
[editar | editar a fonte]A inicios da década de 1930, William Astbury mostou que se producían cambios drásticos na difracción de raios X de fibras de la húmida ou de pelos estirados significativamente. Os datos suxerían que as fibras non estiradas tiñan unha estrutura molecular enrolada cunhas repeticións características cada ~51 Å (5,1 nm). Astbury propuxo inicialmente para estas fibras unha estrutura de cadea enroscada. Despois uniuse a outros investigadores (principalmente ao químico norteamericano Maurice Huggins) para propoñer que:
- as moléculas de proteínas non estiradas forman unha hélice, á cal chamaron forma α.
- o estiramento causaba que a hélice se desenroscara, pasando a un estado máis estendido, que chamaron forma β.
Aínda que os modelos de Atsbury eran incorrectos nos seus detalles, as formas que propoñía eran esencialmente correctas e correspóndense cos tipos de estrutura secundaria que se consideran modernamente, a hélice α e a folla β (mantívose a nomenclatura de Astbury), que foron desenvolvidas por Linus Pauling, Robert Corey e Herman Branson en 1951 (véxase máis abaixo); naquel artigo inicial mostrábanse tanto hélices dextroxiras coma levoxiras, aínda que en 1960 a obtención da estrutura cristalina da mioglobina[1] mostrou que a forma dextroxira é a común. Hans Neurath foi o primeiro que demostrou que os modelos de Astbury non podían ser correctos en detalle, porque implicaban choques de átomos.[2] Os artigos de Neurath e os datos de Astbury inspiraron a H. S. Taylor,[3] Maurice Huggins[4] e Bragg e colaboradores[5] a propoñer os modelos da queratina que lembran algo á moderna hélice α.
Dous desenvolvementos clave na modelización da moderna hélice α foron: (1) a correcta xeometría dos enlaces, grazas a determinacións da estrutura cristalina de aminoácidos e péptidos e á predición de Pauling dos enlaces peptídicos planares; e (2) o abandono da idea de que había un número enteiro de residuos por volta de hélice. O momento fundamental chegou en 1948, cando Pauling estaba en cama curándose dun arrefriado, e ao estar aburrido debuxou unha cadea polipeptídica de aproximadamente as dimensións correctas nunha tira de papel e pregouna formando unha hélice, tendo coidado de manter os enlaces peptídicos planares. Despois duns poucos intentos, obtivo un modelo con enlaces de hidróxeno fisicamente aceptables. Pauling traballou despois con Corey e Branson para confirmar o seu modelo antes de publicalo.[6] En 1954, Pauling foi galardoado co primeiro Premio Nobel "polas súas investigacións sobre a natureza dun enlace químico e a súa apicación á elucidación da estrutura de substancias complexas"[2] (como as proteínas), incluída especialmente a estrutura da hélice α.

Estrutura
[editar | editar a fonte]Xeometría e enlaces de hidróxeno
[editar | editar a fonte]Os aminoácidos dunha hélice α están dispostos formando unha estrutura helicoidal que xira á dereita (dextroxira) na que cada residuo de aminoácido corresponde a un xiro de 100° na hélice (o que implica que a hélice ten 3,6 residuos por volta), e unha traslación de 15 Å (1,5 nm) ao longo do eixe da hélice. Dunitz[7] indicou que o primeiro artigo de Pauling sobre este tema mostra, de feito, unha hélice levoxira (que xira á esquerda), o enantiómero da verdadeira estrutura. Algunhas veces aparecen partes curtas con hélice levoxira en zonas con gran contido do aminoácido aquiral glicina, pero non están favorecidas cos outros L-aminoácidos normais biolóxicos. A pendente da hélice alfa (determinada pola distancia vertical entre unha volta consecutiva da hélice) é de 54 Å (5,4 nm), o cal é o produto de 1,5 e 3,6. O máis importante é que o grupo N-H dun aminoácido forma un enlace de hidróxeno co grupo C=O do cuarto residuo de aminoácido situado antes na hélice; este enlace de hidróxeno repetido é a característica máis salientable da hélice α. A nomenclatura internacional oficial[8] [3] especifica dous modos de definir as hélices α, a regra 6.2 en termos de ángulos de torsión φ,ψ repetidos (véxase máis abaixo), e a regra 6.3 en termos do patrón combinado de pendente e enlaces de hidróxeno. As hélices alfa poden identificarse na estrutura das proteínas utilizando varios métodos computacionais, un dos cales é DSSP (Dictionary of Protein Secondary Structure, Dicionario da Estrutura Secundaria de Proteínas).[9]

Estruturas similares son a hélice 310 (con enlaces de hidróxeno ) e a hélice π (con enlaces de hidróxeno ). A hélice α pode describirse como unha hélice 3,613, xa que o espazado i + 4 engade 3 átomos máis ao bucle enlazado ao H en comparación coa hélice máis apertada de tipo 310, e como media, nun anel de hélice α están implicados 3,6 aminoácidos. O subíndice refírese ao número de átomos (incluíndo o hidróxeno) no bucle pechado formado polo enlace de hidróxeno.[10]

Os residuos nas hélices α adoptan normalmente ángulos diedros (φ, ψ) no esqueleto da molécula de -60° e -45°, como se mostra na imaxe da dereita. En termos máis xerais, adoptan ángulos diedros tales que a suma do ángulo diedro ψ dun residuo e o ángulo diedro φ do seguinte residuo suman aproximadamente -105°. Como consecuencia, os ángulos diedros da hélice alfa, en xeral, forman unha banda diagonal no diagrama de Ramachandran (de pendente -1), que vai de (-90°, -15°) a (-35°, -70°). Como comparación, a suma de ángulos diedros dunha hélice 310 é de aproximadamente -75°, mentres que nunha hélice π é de aproximadamente -130°. A fórmula xeral para o ánguilo de rotación Ω por residuo de calquera hélice polipeptídica con isómeros trans é a dada pola ecuación[12]
A hélice α está moi estreitamente empaquetada; case non hai espazo libre na hélice. As cadeas laterais dos aminoácidos están fóra da hélice, e apuntan algo "cara abaixo" (é dicir, cara ao extremo N-terminal), como as pólas de certos abetos (efecto de árbore de Nadal). Esta direccionalidade utilízase ás veces en mapas de densidade electrónicas de baixa resolución preliminares para determinar a dirección do esqueleto da molécula proteica.[13]

Diagramas bidimensionais para representar hélices α
[editar | editar a fonte]
Utilízanse tres estilos de diagramas bidimensionais (2D) para representar diferentes aspectos da relación de secuencia e estrutura que lle confiren propiedades de interacción e físicas específicas a cada hélices α. Dúas destas enfatizan o lugar circular arredor dunha sección cilíndrica: O primeiro diagrama desenvolvido deste tipo é o chamado "roda helicoidal",[14] e unha versión máis recente chámase "diagrama wenxiang".[15] O último nome procede do feito de que o diagrama semella unha espiral de incenso como as usadas na China para repeler os mosquitos, que en chinés se pronuncia wenxiang (蚊香[Ligazón morta]).
A roda helicoidal representa unha hélice por medio dunha proxección da estrutura do esqueleto de Cα da proteína ao longo do eixe da hélice, mentres que o diagrama wenxiang represéntao de forma máis abstracta como unha espiral enrolada no plano da páxina. Ambos os diagramas indican a secuencia co código de aminoácidos dunha letra (ver aminoácido) en cada posición Cα, utilizando diferentes cores ou símbolos para codificar as propiedades dos aminoácidos. Sempre se distinguen os aminoácidos hidrofóbicos dos hidrofílicos, como a propiedade máis importante que goberna as interaccións na hélice. Ás veces tamén se distinguen os aminoácidos hidrofílicos cargados negativamente dos cargados positivamente, e tamén se poden indicar os aminoácidos ambiguos como a glicina (G). Hai varias convencións para as codificacións por cores. A roda helicoidal non cambia a representación ao longo da hélice, mentres que o diagrama wenxiang pode mostrar as localizacións relativas dos aminoácidos na hélice α independentemente do longa que sexa.
Tanto o estilo circular coma o diagrama poden proporcionar unha intuitiva e doadamente visualizable imaxe en 2D que caracteriza a disposición dos residuos hidrofóbicos e hidrofílicos nas hélices α,[14][15] e pode usarse para estudar as interaccións hélice-hélice,[16] interaccións hélice-membrana cuantificadas polo momento hidrofóbico da hélice,[17] ou interaccións proteína-proteína.[18] [19] Disponse de varios servizos e sitios web que xeran rodas helicoidais, como a páxina de Kael Fischer [4]. Recentemente, apareceu un servidor web chamado "Wenxiang" [5] para debuxar os diagramas wenxiang de calquera secuencia de hélice α.[20]
O terceiro estilo de diagrama bidimensional (2D) denomínase "rede helicoidal". Xérase ao abrir a superficie cilíndrica de cada hélice ao longo dunha liña paralela ao eixe e dispoñer o resultado verticalmente. A rede helicoidal non é axeitada para o estudo de interaccións de empaquetado hélice-hélice, pero converteuse no medio dominante para representar a disposición da secuencia de proteínas integrais de membrana, porque mostra importantes relacións da secuencia helicoidal coa posición vertical dentro da membrana, mesmo sen que se coñeza como está disposta tridimensionalmente (3D) a hélice.
Estabilidade
[editar | editar a fonte]As hélices observadas en proteínas poden variar en lonxitude de catro a uns corenta residuos de aminoácidos, pero unha hélice típica contén uns dez aminoácidos (arredor de tres xiros da hélice). En xeral, os polipéptidos curtos non mostran moita estrutura en hélice alfa en solución, xa que o custo entrópico asociado co pregamento da cadea polipeptídica non se compensa por unha cantidade suficiente de interaccións estabilizantes. En xeral, os enlaces de hidróxeno do esqueleto da molécula das hélices α considéranse lixeiramente máis febles que os que se encontran nas follas β, e poden ser atacados rapidamente polas moléculas de auga do ambiente. Porén, en ambientes máis hidrofóbicos como a membrana plasmática, ou en presenza de cosolventes como o trifluoroetanol (TFE), ou se son illados do solvente en fase de gas,[21] os oligopéptidos adoptan rapidamente estruturas estables en hélice α. Ademais, poden incorpoararse enlaces cruzados nos péptidos que estabilicen conformacionalmente os pregamentos en hélice. Os enlaces cruzados estabilizan o estado helicoidal ao desestabilizaren entropicamente o estado non pregado e ao removeren os pregamentos "reclamo" estabilizados entalpicamente que compiten co estado completamente helicoidal.[22]

Determinación experimental
[editar | editar a fonte]Como a hélice α se define polos seus enlaces de hidróxeno e a conformación do esqueleto da molécula, as probas experimentais máis detalladas da estrutura da hélice α proceden da cristalografía de raios X de resolución atómica, como a do exemplo da dereita. Está claro que todos os oxíxenos carbonílicos do esqueleto da proteína apuntan cara a abaixo (cara ao extremo C-terminal) pero se separan lixeiramente, e os enlaces de hidróxeno son aproximadamente paralelos ao eixe da hélice. As estruturas das proteínas obtidas por espectroscopía RMN tamén mostran perfectamente as hélices, con observacións características dos acoplamentos por efecto Overhauser nuclear entre átomos en xiros da hélice adxacentes. Nalgúns casos, un determinado enlace de hidróxeno individual pode observarse directamente como un pequeno acoplamento escalar na resonancia magnética nuclear (RMN).
Hai varios métodos de baixa resolución para asignar unha estrutura en hélice xeral. Os desprazamentos químicos de RMN (en especial de átomos , e ) e os acoplamentos dipolares residuais son a miúdo característicos das hélices. O espectro de dicroísmo circular do ultravioleta remoto (de 170-250 nm) das hélices é tamén idiosincrático, e mostra un mínimo dobre pronunciado a ~208 nm e ~222 nm. A espectroscopia infravermella raramente se usa, xa que o espectro das hélices α lembra o do enrolamento aleatorio (aínda que isto pode discernirse por, por exemplo, intercambio hidróxeno-deuterio). Finalmente, a microscopia crioelectrónica ten agora capacidade de discernir hélices α individuais nunha proteína, aínda que a súa asignación a residuos é aínda unha área activa de investigación.
Os longos homopolímeros de aminoácidos forman con frecuencia hélices en disolución. Ditas hélices illadas longas poden tamén detectarse por outros métodos, como a relaxación dieléctrica, birrefrinxencia de fluxo, e medidas da constante de difusión. En termos máis estritos, estes métodos detectan só as formas características prolatas (como de cigarro) hidrodinámicas dunha hélice, ou o seu gran momento dipolar.
Propensión dos aminoácidos a formar a hélice alfa
[editar | editar a fonte]Diferentes secuencias de aminoácidos teñen distintas propensións a formar a estrutura en hélice α. A metionina, alanina, leucina, o glutamato non cargado, e a lisina ("MALEK" no código dunha letra para representar os aminoácidos) teñen unha tendencia especialmente alta de formar hélices, mentres que a prolina e a glicina teñen unha baixa tendencia a formalas.[23] A prolina mesmo rompe ou retorce a hélice, porque non pode doar un enlace de hidróxeno amida (ao non ter o hidróxeno da amida), e tamén porque a súa cadea lateral interfire estericamente co esqueleto da proteína do xiro anterior (dentro da hélice isto forza unha curvatura duns 30° no eixe da hélice).[10] Porén, a prolina aparece a miúdo como primeiro residuo da hélice, e pénsase que isto se debe á súa rixidez estrutural (é o único aminoácido proteico no que a cadea lateral está unida ao grupo amino). No outro extremo, a glicina tamén tende a distorsionar as hélices debido a que a súa alta flexibilidade conformacional fai que sexa entropicamente caro que adopte a estrutra relativamente constrinxida da hélice α.
Táboa de propensións a formar hélice alfa dos aminoácidos estándar
[editar | editar a fonte]As diferenzas estimadas na enerxía libre, , estimadas en kcal/mol por residuo na configuración en hélice alfa, en relación coa alanina (establecida arbitrariamente como cero). As cifras máis altas (enerxías libres máis positivas) son os menos favorables. Son posibles desviacións significativas destas cifras medias, dependendo das identidades dos residuos veciños.
| Aminoácido | 3 letras | 1 letra | Propensión helicoidal (Kcal/mol)[24] |
|---|---|---|---|
| Alanina | Ala | A | 0 |
| Arxinina | Arg | R | 0,21 |
| Asparaxina | Asn | N | 0,65 |
| Ácido aspártico | Asp | D | 0,69 |
| Cisteína | Cys | C | 0,68 |
| Ácido glutámico | Glu | E | 0,40 |
| Glutamina | Gln | Q | 0,39 |
| Glicina | Gly | G | 1,00 |
| Histidina | His | H | 0,61 |
| Isoleucina | Ile | I | 0,41 |
| Leucina | Leu | L | 0,21 |
| Lisina | Lys | K | 0,26 |
| Metionina | Met | M | 0,24 |
| Fenilalanina | Phe | F | 0,54 |
| Prolina | Pro | P | 3,16 |
| Serina | Ser | S | 0,50 |
| Treonina | Thr | T | 0,66 |
| Triptófano | Trp | W | 0,49 |
| Tirosina | Tyr | Y | 0,53 |
| Valina | Val | V | 0,61 |
Momento dipolar
[editar | editar a fonte]Unha hélice ten un momento dipolar global debido ao efecto agregado dos microdipolos individuais dos grupos carbonilo dos enlaces peptídicos que hai ao longo da hélice.[25] Os efectos deste macrodipolo suscitan certo debate. As hélices alfa con frecuencia teñen o extremo N-terminal unido a un grupo cargado negativamente, ás veces unha cadea lateral dun aminoácido como o glutamato ou o aspartato, ou ás veces un ión fosfato. Algúns consideran que o macrodipolo da hélice interacciona electrostaticamente con ditos grupos. Outros pensan que iso é unha idea errada e é máis realista dicir que o potencial de enlaces de hidróxeno dos grupos NH libres no extremo N-terminal dunha hélice alfa pode ser satisfeito polos enlaces de hidróxeno; isto pode tamén considerarse como un conxunto de interaccións entre macrodipolos locais como C=O····H-N.[26][27]
Hélice superenrolada
[editar | editar a fonte]As hélices α superenroladas (coiled-coil) son formas moi estables nas cales dúas ou máis hélices se enrolan unha arredor da outra nunha estrutura "superenrolada". As hélices superenroladas conteñen un motivo de secuencia moi característico chamado héptada repetitiva, na cal o motivo se repite cada sete residuos ao longo da secuencia. Os residuos primeiro e cuarto, especialmente este último, que normalmente é a leucina, (os das chamadas posicións a e d) son case sempre hidrofóbicos e empaquétanse xuntos no interior do feixe de hélices. En xeral, os residuos quinto e sétimo (nas posicións e e g) teñen cargas opostas e forman unha ponte salina estabilizada por interaccións electrostáticas. As proteínas fibrosas como a queratina ou os "talos" da miosina ou cinesina adoptan con frecuencia estruturas en hélice superenrolada, como tamén o fan varias proteínas dimerizantes. Un motivo estrutural moi común nas proteínas é un par de hélices superenroladas (un feixe de catro hélices). Por exemplo, aparece na hormona do crecemento humana e en varias variedades de citocromo. A proteína Rop, que promove a replicación de plásmidos en bacterias, é un caso interesante no cal un só polipéptido forma unha ensamblaxe de hélice superenrolada e dous monómeros para formar un feixe de catro hélices.
Os aminoácidos que forman unha determinada hélice poden ser representados nunha roda helicoidal, unha representación que ilustra as orientacións dos aminoácidos constituíntes. A miúdo en proteínas globulares, e en estruturas especializadas como as hélices supenroladas e as cremalleiras de leucina, unha hélice alfa mostra dúas "caras": unha que contén aminoácidos predominantemente hidrofóbicos orientada cara ao interior da proteína, na súa parte central hidrofóbica, e outra que contén aminoácidos predominantemente polares orientada cara á superficie da proteína exposta ao solvente.
Ensamblaxes a grande escala
[editar | editar a fonte]
A mioglobina e a hemoglobina, as dúas primeiras proteínas cuxas estruturas foron resoltas por cristalografía de raios X, teñen pregamentos moi similares constituídos por un 70% de tramos en hélice α, e o resto da molécula son rexións non repetitivas, ou "bucles" que conectan os tramos en hélice. Na clasificación de proteínas polo seu pregamento dominante, a base de datos Structural classification of Proteins (Clasificación Estrutural de Proteínas, SCOP) contén unha ampla categoría na que se clasifican todas as proteínas todo-α.
A hemoglobina ten ademais unha estrutura cuaternaria a maior escala, na cal está constituída por catro subunidades para a unión co oxíxeno. A mioglobina está formada por unha soa cadea polipeptídica.
Papel funcional
[editar | editar a fonte]

Unión ao ADN
[editar | editar a fonte]As hélices α teñen un significado especial nos motivos que serven para unirse ao ADN, como son os motivos hélice-xiro-hélice, cremalleira de leucina e dedo de cinc. Isto débese ao conveniente feito estrutural de que o diámetro dunha hélice α é de aproximadamente 12Å (1,2 nm) incluíndo un conxunto medio de cadeas laterais, o que aproximadamente é o mesmo que o largo do suco maior da forma B do ADN, e tamén a que os dímeros de hélices de hélice superenrolada (ou de cremalleira de leucina) poden facilmente situar un par de superficies de interacción para contactar co tipo de repetición simétrica común na dobre hélice do ADN.[28] Un exemplo de ambos os aspectos é o factor de transcrición Max (ver imaxe á esquerda), que utiliza unha hélice superenrolada helicoidal na súa zona dimerizada, e sitúa outro par de hélices para a interacción en dous xiros sucesivos do suco maior do ADN.
Proteínas transmembrana
[editar | editar a fonte]As hélices α son tamén o elemento estrutural proteínico máis común que cruza as membranas biolóxicas (ver proteína transmembrana)[29] e crese que isto se debe a que a estrutura heicoidal pode establecer todos os enlaces de hidróxeno do esqueleto da molécula na parte interna da molécula, deixando que os grupos non polares queden expostos á membrana se as cadeas laterais son hidrofóbicas. As proteínas están ás veces ancoradas na membrana por medio dunha soa hélice que atravesa toda a membrana, e outras veces por dúas, e ás veces por un feixe de hélices, a maioría dos cales constan de sete hélices dispostas cruzando de arriba a abaixo nun anel como o das rodopsinas (ver imaxe á dereita) ou dos receptores acoplados á proteína G (GPCRs).
Propiedades mecánicas
[editar | editar a fonte]As hélices α baixo deformación tensional axial, que é unha condición de carga característica que se dá en moitos filamentos ricos en hélices alfa e moitos tecidos, presentan un característico comportamento en tres fases de módulo de tanxente ríxido-brando-ríxido.[30] A fase I corresponde ao réxime de pequena deformación durante o cal a hélice se estira homoxeneamente, e vai seguida dunha fase II, na cal rompen os xiros da hélice alfa debido á rotura de grupos de enlaces de hidróxeno. A fase III está tipicamente asociada cun estiramento de enlace covalente de gran deformación.
Características dinámicas
[editar | editar a fonte]
As hélices alfa das proteínas poden ter un movemento de acordeón de baixa frecuencia como se observa con espectroscopia Raman[31] e se analiza por medio do modelo case continuo.[32][33] As hélices non estabilizadas por interaccións terciarias mostran un comportamento dinámico, que pode ser atribuído principalmente ao esfiañado da hélice desde os extremos.[34]
Transición hélice-enrolamento
[editar | editar a fonte]Os homopolímeros dos aminoácidos (como a poli-lisina) poden adoptar unha estrutura en hélice alfa a baixa temperatura, que é "fundida" ("melted out") a alta temperatura. Esta transición hélice-enrolamento (irregular en nobelo) pensábase antes que era análoga á desnaturalización das proteínas. A mecánica estatística desta transición pode ser modelada utilizando un método de matriz de transferencia elegante, caracterizado por dous parámetros: a propensión a iniciar a hélice e a propensión a estender a hélice.
A hélice α na arte
[editar | editar a fonte]Polo menos cinco artistas utilizaron explicitamente a hélice alfa das proteínas nalgunhas das súas obras de arte: Julie Newdoll en pintura e Julian Voss-Andreae, Bathsheba Grossman, Byron Rubin, e Mike Tyka en escultura.[10][35][36][37][38][39]
Notas
[editar | editar a fonte]- ↑ Kendrew, JC; Dickerson, RE; Strandberg, BE; Hart, RG; Davies, DR; Phillips, DC; Shore, VC (1960). "Structure of myoglobin: A three-dimensional Fourier synthesis at 2 Å resolution". Nature 185 (4711): 422–427. PMID 18990802. doi:10.1038/185422a0.
- ↑ Neurath, H (1940). "Intramolecular folding of polypeptide chains in relation to protein structure". Journal of Physical Chemistry 44 (3): 296–305. doi:10.1021/j150399a003.
- ↑ Taylor, HS (1942). "Large molecules through atomic spectacles". Proceedings of the American Philosophical Society 85: 1–12.
- ↑ Huggins, M (1943). "The structure of fibrous proteins". Chemical Reviews 32 (2): 195–218. doi:10.1021/cr60102a002.
- ↑ Bragg, WL; Kendrew JC, Perutz MF (1950). "Polypeptide chain configurations in crystalline proteins". Proceedings of the Royal Society A 203 (1074): 321–?. doi:10.1098/rspa.1950.0142.
- ↑ Pauling, L; Corey RB, Branson HR (1951). "The Structure of Proteins: Two Hydrogen-Bonded Helical Configurations of the Polypeptide Chain". Proceedings of the National Academy of Sciences of the United States of America 37 (4): 205–211. PMC 1063337. PMID 14816373. doi:10.1073/pnas.37.4.205.
- ↑ Dunitz, J (2001). "Pauling's Left-Handed α-Helix". Angewandte Chemie International Edition 40 (22): 4167–4173. doi:10.1002/1521-3773(20011119)40:22<4167::AID-ANIE4167>3.0.CO;2-Q.
- ↑ IUPAC-IUB Commission on Biochemical Nomenclature (1970). "Abbreviations and symbols for the description of the conformation of polypeptide chains". Journal of Biological Chemistry 245: 6489–6497.
- ↑ Kabsch, K; Sander C (1983). "Dictionary of protein secondary structure: pattern recognition of hydrogen-bonded and geometrical features". Biopolymers 22 (12): 2577–2637. PMID 6667333. doi:10.1002/bip.360221211.
- ↑ 10,0 10,1 10,2 Richardson, JS (1981). "The Anatomy and Taxonomy of Proteins". Advances in Protein Chemistry 34: 167–339 [1]. PMID 7020376. doi:10.1016/S0065-3233(08)60520-3.
- ↑ Lovell SC; et al. (2003). "Structure validation by Cα geometry: φ,ψ and Cβ deviation". Proteins 50 (3): 437–450. PMID 12557186. doi:10.1002/prot.10286.
- ↑ Dickerson, RE; Irving Geis (1969). Structure and Action of Proteins. Nova York: Harper.
- ↑ Terwilliger TC. "Rapid model-building of α-helices in electron density maps". Acta Crystallographica D66: 268–275. PMC 2827347. PMID 20179338. doi:10.1107/S0907444910000314.
- ↑ 14,0 14,1 Schiffer M, Edmundson AB (March 1967). "Use of helical wheels to represent the structures of proteins and to identify segments with helical potential". Biophys. J. 7 (2): 121–35. Bibcode:1967BpJ.....7..121S. PMC 1368002. PMID 6048867. doi:10.1016/S0006-3495(67)86579-2.
- ↑ 15,0 15,1 Chou KC, Zhang CT, Maggiora GM (May 1997). "Disposition of amphiphilic helices in heteropolar environments". Proteins 28 (1): 99–108. PMID 9144795. doi:10.1002/(SICI)1097-0134(199705)28:1<99::AID-PROT10>3.0.CO;2-C.
- ↑ Kurochkina N (May 2010). "Helix-helix interactions and their impact on protein motifs and assemblies". J. Theor. Biol. 264 (2): 585–92. PMID 20202472. doi:10.1016/j.jtbi.2010.02.026.
- ↑ Eisenberg D, Weiss RM, Terwilliger TC (1982). "The helical hydrophobic moment: a measure of the amphiphilicity of a helix". Nature 299 (5881): 371–4. PMID 7110359. doi:10.1038/299371a0.
- ↑ Zhou GP (June 2011). "The disposition of the LZCC protein residues in wenxiang diagram provides new insights into the protein-protein interaction mechanism". J Theor Biol 284 (1): 142–8. PMID 21718705. doi:10.1016/j.jtbi.2011.06.006.
- ↑ Zhou, GP (2011). "The Structural Determinations of the Leucine Zipper Coiled-Coil Domains of the cGMP-Dependent Protein Kinase I alpha and its Interaction with the Myosin Binding Subunit of the Myosin Light Chains Phosphase". Protein & Peptide Letters 18 (10): 966–978. PMID 21592084. doi:10.2174/0929866511107010966.
- ↑ Chou, KC; Ling WZ; Xiai X (2011). "Wenxiang: a web-server for drawing wenxiang diagrams". Natural Science 3 (10): 862–865. doi:10.4236/ns.2011.310111.
- ↑ Hudgins, RR; Jarrold MF (1999). "Helix Formation in Unsolvated Alanine-Based Peptides: Helical Monomers and Helical Dimers". Journal of the American Chemical Society 121 (14): 3494–3501. doi:10.1021/ja983996a.
- ↑ Kutchukian, PS; Yang JS; Verdine GL; Shakhnovich EI (2009). "All-Atom Model for Stabilization of alpha-Helical Structure in Peptides by Hydrocarbon Staples". Journal of the American Chemical Society 131 (13): 4622–4627. PMC 2735086. PMID 19334772. doi:10.1021/ja805037p.
- ↑ Pace CN, Scholtz JM (July 1998). "A helix propensity scale based on experimental studies of peptides and proteins". Biophys. J. 75 (1): 422–7. Bibcode:1998BpJ....75..422N. PMC 1299714. PMID 9649402. doi:10.1016/S0006-3495(98)77529-0.
- ↑ Pace, C. Nick; Scholtz, J. Martin (1998). "A Helix Propensity Scale Based on Experimental Studies of Peptides and Proteins". Biophysical Journal 75. pp. 422–427. doi:10.1016/s0006-3495(98)77529-0.
- ↑ Hol, WGJ; van Duijnen PT (1978). "The alpha helix dipole and the properties of proteins". Nature 273: 443–446. doi:10.1038/273443a0.
- ↑ He, JJ; Quiocho FA (1993). "Dominant role of local dipoles in stabilising uncompensated charges in a sulfate sequestered in a periplasmic active transport protein". Protein Science 2: 1643–1647. doi:10.1002/pro.5560021010.
- ↑ Milner-White, EJ (1997). "The partial charge of the nitrogen atom in peptide bonds". Protein Science 6: 2477–2482. doi:10.1002/pro.5560061125.
- ↑ Tooze, John; Brändén, Carl-Ivar (1999). Introduction to protein structure. New York: Garland Pub. ISBN 0-8153-2304-2. Ver capítulo 10.
- ↑ Ver Tooze & Branden, capítulo 12.
- ↑ T. Ackbarow, X. Chen, S. Keten, M.J. Buehler (2007). "Hierarchies, multiple energy barriers and robustness govern the fracture mechanics of alpha-helical and beta-sheet protein domains". PNAS 104 (42): 16410–16415. PMC 2034213. PMID 17925444. doi:10.1073/pnas.0705759104.
- ↑ Painter PC, Mosher LE, Rhoads C (July 1982). "Low-frequency modes in the Raman spectra of proteins". Biopolymers 21 (7): 1469–72. PMID 7115900. doi:10.1002/bip.360210715.
- ↑ Chou KC (December 1983). "Identification of low-frequency modes in protein molecules". Biochem. J. 215 (3): 465–9. PMC 1152424. PMID 6362659.
- ↑ Chou KC (May 1984). "Biological functions of low-frequency vibrations (phonons). III. Helical structures and microenvironment". Biophys. J. 45 (5): 881–9. Bibcode:1984BpJ....45..881C. PMC 1434967. PMID 6428481. doi:10.1016/S0006-3495(84)84234-4.
- ↑ Fierz*, B; Reiner*, A; Kiefhaber, T (January 2009). "Local conformational dynamics in α-helices measured by fast triplet transfer". Proc. Natl. Acad. Sci. USA 106 (44): 1057–62. PMC 2633579. PMID 19131517. doi:10.1073/pnas.0808581106.
- ↑ Newdoll
- ↑ Voss-Andreae, J (2005). "Protein Sculptures: Life's Building Blocks Inspire Art". Leonardo 38: 41–45. doi:10.1162/leon.2005.38.1.41.
- ↑ Gossman
- ↑ Rubin
- ↑ Tika
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Tooze, John; Brändén, Carl-Ivar (1999). Introduction to protein structure. New York: Garland Pub. ISBN 0-8153-2304-2..
- Eisenberg D (September 2003). "The discovery of the alpha-helix and beta-sheet, the principal structural features of proteins". Proceedings of the National Academy of Sciences of the United States of America 100 (20): 11207–10. PMC 208735. PMID 12966187. doi:10.1073/pnas.2034522100.
- Astbury, WT; Woods, HJ. (1931). "The Molecular Weights of Proteins". Nature 127 (3209): 663–665. doi:10.1038/127663b0.
- Astbury, WT; Street, A. (1931). "X-ray studies of the structures of hair, wool and related fibres. I. General". Trans. R. Soc. Lond. A230: 75–101.
- Astbury, WT. (1933). "Some Problems in the X-ray Analysis of the Structure of Animal Hairs and Other Protein Fibers". Trans. Faraday Soc. 29 (140): 193–211. doi:10.1039/tf9332900193.
- Astbury, WT; Woods, HJ. (1934). "X-ray studies of the structures of hair, wool and related fibres. II. The molecular structure and elastic properties of hair keratin". Trans. R. Soc. Lond. A232: 333–394.
- Astbury, WT; Sisson, WA. (1935). "X-ray studies of the structures of hair, wool and related fibres. III. The configuration of the keratin molecule and its orientation in the biological cell". Proceedings of the Royal Society A150: 533–551.
- Bragg, L; Kendrew, JC; Perutz, MF. (1950). "Polypeptide chain configurations in crystalline proteins". Proceedings of the Royal Society A203: 321.
- Sugeta, H; Miyazawa, T. (1967). "General Method for Calculating Helical Parameters of Polymer Chains from Bond Lengths, Bond Angles, and Internal-Rotation Angles". Biopolymers 5 (7): 673–679. doi:10.1002/bip.1967.360050708.
- Wada A (1976). "The alpha-helix as an electric macro-dipole". Adv. Biophys.: 1–63. PMID 797240.
- Chothia C, Levitt M, Richardson D (October 1977). "Structure of proteins: packing of alpha-helices and pleated sheets". Proceedings of the National Academy of Sciences of the United States of America 74 (10): 4130–4. PMC 431889. PMID 270659. doi:10.1073/pnas.74.10.4130.
- Chothia C, Levitt M, Richardson D (January 1981). "Helix to helix packing in proteins". J. Mol. Biol. 145 (1): 215–50. PMID 7265198. doi:10.1016/0022-2836(81)90341-7.
- Hol WG (1985). "The role of the alpha-helix dipole in protein function and structure". Prog. Biophys. Mol. Biol. 45 (3): 149–95. PMID 3892583. doi:10.1016/0079-6107(85)90001-X.
- Barlow DJ, Thornton JM (June 1988). "Helix geometry in proteins". J. Mol. Biol. 201 (3): 601–19. PMID 3418712. doi:10.1016/0022-2836(88)90641-9.
- Murzin AG, Finkelstein AV (December 1988). "General architecture of the alpha-helical globule". J. Mol. Biol. 204 (3): 749–69. PMID 3225849. doi:10.1016/0022-2836(88)90366-X.




![{\displaystyle 3\cos \Omega =1-4\cos ^{2}\left[\left(\phi +\psi \right)/2\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/289a67463099a87877ac9fca00daf052bb2edd9a)



