Cremalleira de leucina

Unha cremalleira de leucina ou tesoira de leucina [1] é un motivo estrutural supersecundario de proteínas que crean forzas de adhesión por medio de hélices alfa dispostas en paralelo [2] . É un dominio de dimerización común en proteínas implicadas na expresión xénica, xa que forma parte do dominio de unión ao ADN de varios factores de transcrición. As cremelleiras de leucina atópanse tanto en proteínas regulatorias procariotas coma eucariotas, pero son principalmente características destas últimas.
Unha cremalleira de leucina consta de múltiples residuos de leucina situados en intervalos de aproximadamente 7 residuos, que forman unha hélice alfa anfipática cunha rexión hidrofóbica ao longo dun dos seus lados. Esta rexión hidrofóbica proporciona unha área para a dimerización, que permite que se unan os motivos como unha "cremalleira". Ademais, a rexión hidrofóbica da leucina requírese necesariamente para a unión ao ADN.
Estrutura[editar | editar a fonte]
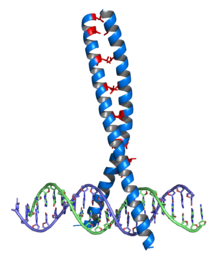
A principal característica do dominio de cremalleira de leucina é a predominancia do aminoácido leucina na posición "d" do grupo repetido de sete aminoácidos (héptada repetitiva). As cremalleiras de leucina identificáronse primeiro como aliñamentos de secuencia presentes en certos factores de transcrición nos que se identificaba un patrón común de leucinas cada sete aminoácidos. Posteriormente descubriuse que estas leucinas formaban o núcleo hidrofóbico dunha hélice superenrolada.
Cada metade da cremalleira de leucina é unha curta hélice alfa cun residuo de leucina cada sete posicións. A conformación estándar de 3,6 residuos por xiro da estrutura en hélice alfa cambia lixeiramente a 3,5 residuos por xiro de hélice. Cada leucina está en contacto coa leucina da outra hélice cada dous xiros.
A familia de factores de transcrición bZip contén unha rexión básica que interacciona co suco maior da molécula de ADN por medio de enlaces de hidróxeno, e unha rexión hidrofóbica de peche, que é a responsable da dimerización.
Bioloxía[editar | editar a fonte]
Entre as proteínas reguladoras co motivo cremalleira de leucina están c-fos e c-jun (o factor de transcrición AP1), importantes reguladores do desenvolvemento, e os membros da familia myc, como myc, max, e mdx1. Cando se producen en exceso ou mutan nunha área vital, poden xerar cancro. Estas proteínas interaccionan co ADN como dímeros (homo- ou hetero-) e denomínanse cremalleiras de leucina básicas ou bZips polas súas siglas en inglés.
Notas[editar | editar a fonte]
- ↑ David M. Glick, ed. (1997). "Leucine scissors". Glossary of Biochemistry and Molecular Biology (Revised ed.). London: Portland Press.
- ↑ Landschulz WH, Johnson PF, McKnight SL. (1988) The leucine zipper: a hypothetical structure common to a new class of DNA-binding proteins. Science 240:1759-1764. PubMed abstract PMID 3289117
Véxase tamén[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Leucine+zippers at the US National Library of Medicine Medical Subject Headings (MeSH)
