Epítopo

Un epítopo ou determinante antixénico é a porción dunha macromolécula que é recoñecida polo sistema inmunitario, e máis especificamente a secuencia da molécula á que se unen os anticorpos,[1] os receptores das células B (BCR) ou os de células T (TCR). Unha proteína pode ter varios epítopos distintos en diferentes partes da molécula. Aínda que os epítopos proveñen xeralmente de proteínas non propias, as secuencias que se obteñen do hóspede que poden ser recoñecidas inmunitariamente tamén se clasifican como epítopos. A parte dun anticorpo que recoñece o epítopo denomínase parátopo. Un epítopo pode ser linear ou conformacional.
Tipos[editar | editar a fonte]
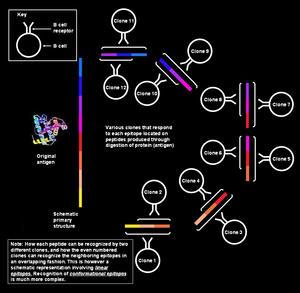

Os epítopos dos antíxenos proteicos divídense en dúas categarías: epítopos conformacionais e epítopos lineares. Esta división está baseada na súa estrutura e a interaccíón co parátopo.[3]
Un epítopo conformacional está composto por seccións que non van seguidas da secuencia de aminoácidos do antíxeno, pero que polo pregamento ou disposición da proteína están próximas orixinando un determinado relevo. Estes epítopos interaccionan co parátopo precisamente debido ao relevo superficial da estrutura tridimensional do antíxeno (estrutura terciaria).
A diferenza dos anteriores, os epítopos lineares interaccionan co parátopo segundo a súa secuencia de aminoácidos ou estrutura primaria. Un epítopo linear está formado por unha secuencia continua de aminoácidos do antíxeno. As proteínas que funcionan como antíxenos son procesadas na célula e convertidas en péptidos pequenos, que son os que son despois ""presentados" na superficie celular unidos ás moléculas MHC, polo que a secuencia dos epítopos lineares é a secuencia linear de aminoácidos destes péptidos.[2]
Bioquímica[editar | editar a fonte]
Os anticorpos, tanto os libres coma os fixados á matriz extracelular, únense a moléculas antixénicas nunha superficie de unión, para así formar complexos antíxeno-anticorpo. Esas superficies de unión sobre as macromoléculas constan de complexas secuencias específicas chamadas determinantes antixénicos ou epítopos.[4] A maioría dos epítopos recoñecidos por anticorpos ou células B poden considerarse como relevos de superficies tridimensionais dunha molécula de antíxeno; estes relevos encaixan con precisión e así se produce a unión do anticorpo. A parte dun anticorpo que recoñece o epítopo chámase parátopo.[4] A excepción son os epítopos lineares, que son determinados pola secuencia de aminoácidos (a estrutura primaria) en vez de pola forma tridimensional (estrutura terciaria) dunha proteína.
Cando se coñece a secuencia xenética dun determinado epítopo que se sabe será recoñecido por un anticorpo, é posible empregar esta para xerar unha proteína quimera por fusión do marco aberto de lectura (ORF) dun xene a facer estudos coa secuencia de dito epítopo; deste modo, o anticorpo inicial pode ser empregado para detectar a proteína quimera, o cal permite detectala e efectuar análises sobre ela.
Inmunoloxía[editar | editar a fonte]
Os epítopos recoñecidos polas células T son presentados na superficie dunha célula presentadora de antíxenos unidos a moléculas do complexo maior de histocompatibilidade (MHC). Os epítopos para as células T presentados por moléculas MHC de clase I son tipicamente péptidos de entre 8 e 15 aminoácidos de lonxitude, mentres que as moléculas MHC de clase II presentan péptidos máis longos (e as moléculas MHC non clásicas tamén presentan epítopos non peptídicos como os glicolípidos).
Os epítopos poden ser trazados usando micromatrices de proteínas, e coas técnicas ELISPOT ou ELISA.
Os epítopos teñen ás veces reactividade cruzada. Esta propiedade é explotada polo sistema inmunitario na regulación por anticorpos anti-idiotípicos (nome proposto orixinalmente polo premio Nobel Niels Kai Jerne).[5] Se un anticorpo se une a un epítopo dun antíxeno, o parátopo pode converterse no epítopo para outro anticorpo que entón se unirá a el. Se este segundo anticorpo é da clase IgM, a súa unión pode acentuar a resposta inmune; se o segundo anticorpo é de clase IgG, a súa unión pode diminuíla.
Actualmente, estánse a realizar investigacións intensivas para deseñar ferramentas fiables para predicir epítopos en proteínas.
Etiquetado de epítopos[editar | editar a fonte]
Os epítopos úsanse moito en proteómica e o estudo de produtos xénicos. Utilizando técnicas de ADN recombinante as secuencias xenéticas codificadas polos epítopos que son recoñecidas polos anticorpos comúns poden fusionarse co xene. Despois da síntese de proteínas, a etiqueta de epítopo resultante permite que o anticorpo encontre a proteína ou outro produto xénico o que é unha útil ferramenta de laboratorio para a localización, purificación, e posterior caracterización molecular. Epítopos comunmente usados para este propósito son: Myc-tag, HA-tag, FLAG-tag, GST-tag, 6xHis[6] e OLLAS.[7] Os péptidos poden unirse tamén a proteínas que forman enlaces covalentes co péptido, o que permite a súa inmobilización irreversible.[8]
Bases de datos de epítopos[editar | editar a fonte]
- MHCBN: Unha base de datos de epítopos aglutinantes MHC/TAP e células T
- Bcipep: Unha base de datos de epítopos de células B
- SYFPEITHI - Primeira base de datos en liña de epítopos de células T
- IEDB - Base de datos de epítopos de células T e B con anotacións do contexto de recoñecemento
- ANTIJEN - Base de datos de epítopos de células T e B do Jenner Institute, Reino Unido
- IMGT/3Dstructure-DB - Estruturas tridimensionais de epítopos de células B e T con anotación de IG e TR - IMGT, Montpellier, Francia
Notas[editar | editar a fonte]
- ↑ National Institutes of Health (Estados Unidos) (2008). "Epítopo" (en español). Consultado o 31 de xaneiro de 2013.
- ↑ 2,0 2,1 Goldsby, Richard; Kindt, TJ; Osborne, BA; Janis Kuby (2003). "Antigens (Chapter 3)". Immunology (Fifth edition). New York: W. H. Freeman and Company. pp. 57–75. ISBN 00716749475.
- ↑ Huang, J.; Honda, W. (2006). "CED: a conformational epitope database". BMC Immunology 7: 7. doi:10.1186/1471-2172-7-7. PMC 1513601. PMID 16603068. http://www.biomedcentral.com/1471-2172/7/7#B1. Retrieved April 8, 2010.
- ↑ 4,0 4,1 Male, David (2007). Inmunología (en español) (7 ed.). Elsevier, España. p. 68. ISBN 8480862335.
- ↑ Lefkovits, Ivan; Niels Kaj Jerne (1996). A Portrait of the Immune System: Scientific Publications of N K Jerne (en español). World Scientific. p. 598. ISBN 9810226144.
- ↑ Walker, John; Ralph Rapley (2008). Molecular biomethods handbook. Humana Press. p. 467. ISBN 1-60327-374-3.
- ↑ Novus, Biologicals. "OLLAS Epitope Tag". Novus Biologicals. Consultado o 23 November 2011.
- ↑ Zakeri, B. (2012). "Peptide tag forming a rapid covalent bond to a protein, through engineering a bacterial adhesin". Proceedings of the National Academy of Sciences 109 (12): E690–7. PMC 3311370. PMID 22366317. doi:10.1073/pnas.1115485109.
