Bradyrhizobium
| Bradyrhizobium | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
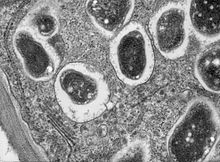 Sección transversal dun nódulo radicular de soia (Glycine max 'Essex'). Bradyrhizobium japonicum infecta as raíces e establece unha simbiose para a fixación do nitróxeno. Esta imaxe a moitos aumentos mostra parte dunha célula con bacteroides dentro dos seus simbiosomas | |||||||||||||
| Clasificación científica | |||||||||||||
| |||||||||||||
| Especie tipo | |||||||||||||
| Bradyrhizobium japonicum | |||||||||||||
| Especies | |||||||||||||
|
Ver texto | |||||||||||||
| Sinonimia | |||||||||||||
Bradyrhizobium é un xénero de bacterias do solo gramnegativas, moitas das cales fixan o nitróxeno. A fixación do nitróxeno é unha parte importante do ciclo do nitróxeno. As plantas non poden usar o nitróxeno atmosférico (N2), senón que deben usar compostos do nitróxeno como os nitratos, pero bacterias como moitos Bradyrhizobium si poden fixalo.
Características[editar | editar a fonte]
As especies de Bradyrhizobium son bacilos gramnegativos cun só flaxelo subpolar ou polar. Son microorganismos comúns que viven no solo e poden formar relacións simbióticas coas plantas leguminosas nas que fixan o nitróxeno a cambio de carbohidratos da planta. Igual que outros rizobios, moitos membros deste xénero teñen a capacidade de fixar o nitróxeno atmosférico en compostos facilmente dispoñibles para outros organismos. Os bradirrizobios son tamén un compoñente importante das comunidades microbiolóxicas dos solos forestais, pero non todas as cepas poden fixar o nitróxeno ; a maioría das cepas illadas destes solos non o poden facer nin crean nodulación.[3] Os Bradyrhizobium son especies de crecemento lento comparadas coas do xénero Rhizobium. Nun medio líquido, os Bradyrhizobium tardan de 3 a 5 días en crear unha turbidez moderada e de 6 a 8 horas en dobrar o seu tamaño de poboación. Adoitan crecer mellor con pentosas como fontes de carbono.[4] Algunhas cepas (por exemplo, USDA 6 e CPP) son capaces de oxidar aerobicamente o monóxido de carbono.[5]
Taxonomía[editar | editar a fonte]
Especies aceptadas[editar | editar a fonte]
Bradyrhizobium comprende as seguintes especies:[6]
- B. agreste Klepa et al. 2021[7]
- B. algeriense Ahnia et al. 2019
- B. americanum Ramírez-Bahena et al. 2017
- B. amphicarpaeae Bromfield et al. 2019
- B. arachidis Wang et al. 2013
- B. archetypum Helene et al. 2020
- B. australiense Helene et al. 2020
- B. betae Rivas et al. 2004
- B. cajani Araújo et al. 2017
- B. canariense Vinuesa et al. 2005
- B. centrosematis corrig. Ramírez-Bahena et al. 2017
- B. cosmicum Wasai-Hara et al. 2020
- B. cytisi Chahbourne et al. 2011
- B. daqingense Wang JY et al. 2012
- B. denitrificans (Hirsch e Müller 1986) van Berkum et al. 2011
- B. diazoefficiens Delamuta et al 2013
- B. diversitatis Serenato Klepa et al. 2021[7]
- B. elkanii Kuykendall et al. 1993
- B. embrapense Delamuta et al.2015
- B. erythrophlei Yao et al. 2015
- B. ferriligni Yao et al. 2015
- B. frederickii de Oliveira Urquiaga et al. 2019
- B. ganzhouense Lu et al. 2014
- B. glycinis Serenato Klepa et al. 2021[7]
- B. guangdongense Li et al. 2015
- B. guangxiense Li et al. 2015
- B. hipponense Rejili et al. 2020
- B. huanghuaihaiense Zhang et al. 2012
- B. icense Durán et al. 2014
- B. ingae da Silva et al. 2014
- B. iriomotense Islam et al. 2010
- B. ivorense Fossou et al. 2020
- B. japonicum (Kirchner 1896) Jordan 1982
- B. jicamae Ramírez-Bahena et al. 2009
- B. kavangense Lasse gronemeyer et al. 2015
- B. lablabi Chang et al. 2011
- B. liaoningense Xu et al. 1995
- B. lupini Peix et al. 2015
- B. manausense Silva et al. 2014
- B. mercantei Helene et al. 2017
- B. murdochi Helene et al. 2020
- B. namibiense Grönemeyer et al. 2017
- B. nanningense Li et al. 2020
- B. neotropicale Zilli et al. 2014
- B. niftali Klepa et al. 2019
- B. nitroreducens Jang et al. 2020
- B. oligotrophicum (Ohta e Hattori 1985) Ramírez-Bahena et al. 2013
- B. ottawaense Yu et al. 2014
- B. pachyrhizi Ramírez-Bahena et al. 2009
- B. paxllaeri Durán et al. 2014
- B. retamae Guerrouj et al. 2013
- B. rifense Chahboune et al. 2012
- B. ripae Bünger et al. 2018
- B. shewense Aserse et al. 2018
- B. stylosanthis Marçon Delamuta et al. 2016
- B. subterraneum Gronemeyer et al. 2015
- B. symbiodeficiens Bromfield et al. 2020
- B. tropiciagri Delamuta et al. 2015
- B. vignae Grönemeyer et al. 2016
- B. viridifuturi Helene et al. 2015
- B. yuanmingense Yao et al. 2002
Especies provisionais[editar | editar a fonte]
As seguintes especies foron publicadas pero non validadas de acordo co Código bacteriolóxico.[6]
- "B. brasilense" Martins da Costa et al. 2017
- "B. campsiandrae" Cabral Michel et al. 2021
- "B. centrolobii" Michel et al. 2017
- "B. forestalis" Martins da Costa et al. 2018
- "B. guangzhouense" Li et al. 2019
- "B. macuxiense" Michel et al. 2017
- "B. sacchari" de Matos et al. 2017
- "Photorhizobium thompsonianum" Eaglesham et al. 1990[2]
- "B. uaiense" Cabral Michel et al. 2020
- "B. valentinum" Durán et al. 2014
- "B. zhanjiangense" Li et al. 2019
Filoxenia[editar | editar a fonte]
A taxonomía actualmente aceptada está baseada na LPSN.[6] A filoxenia está baseada en análises de xenoma completo.[9]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Nodulación[editar | editar a fonte]
Formación de nódulos[editar | editar a fonte]
Os nódulos son crecementos de tecidos nas raíces de plantas leguminosas onde viven as bacterias simbióticas. As raíces da planta segregan aminoácidos e azucres á rizosfera (zona que rodea a raíz). Os rizobios móvense cara ás raíces e adhírense aos pelos radiculares. A planta entón libera flavonoides, que inducen a expresión de xenes nod na bacteria. A expresión destes xenes ten como resultado a produción de encimas chamados factores Nod que inician o enroscamento do pelo radicular. Durante este proceso, os rizobios están enrolados xunto co pelo radicular. Os rizobios penetran as células do pelo radicular cun fío de infección que crece a través do pelo radicular ata a raíz principal. Isto causa que as células infectadas se dividan e formen un nódulo. Os rizobios poden agora empezar a fixación do nitróxeno.
Xenes Nod[editar | editar a fonte]
Coñécense uns 55 xenes que están asociados coa nodulación.[10] NodD é esencial para a expresión dos outros xenes nod.[11] Hai dous xenes de tipo nodD, que son: nodD1 e nodD2. Soamente cómpre nodD1 para unha nodulación con éxito.[10]
Fixación do nitróxeno[editar | editar a fonte]
Bradyrhizobium e outros rizobios toman nitróxeno atmosférico e fíxano formando amoníaco (NH3) ou ión amonio (NH4+). As plantas non poden usar nitróxeno atmosférico e deben usar unha forma combinada ou fixada do elemento. Despois da fotosíntese, a fixación e captación do nitróxeno son os procesos máis importante para o crecemento e desenvolvemento das plantas.[12] Os niveis de nitróxeno ureido nunha planta correlaciónanse coa cantidade de nitróxeno fixado que a planta captou.[13]
Xenes[editar | editar a fonte]
Os xenes nif e fix son xenes importantes na fixación do nitróxeno dos Bradyrhizobium. Os xenes nif son moi similares en función e estrutura aos xenes atopados en Klebsiella pneumoniae, un diazótrofo de vida libre. Os xenes fix son tamén importantes para a fixación do nitróxeno simbiótica e foron descubertos primeiramente en especies de rizobios. Os xenes nif e fix están situados en polo menos dous clusters do cromosoma bacteriano. O cluster I contén a maioría dos xenes de fixación do nitróxeno. O cluster II contén tres xenes fix localizados preto dos xenes nod.[14]
Diversidade[editar | editar a fonte]
Este xénero de bacterias pode formar tanto simbioses específicas coma xerais;[4] algunhas especies de Bradyrhizobium só poden nodular unha especie de legumes, mentres que outras especies de Bradyrhizobium poden nodular varias. O ARN ribosómico está altamente conservado neste grupo de microbios, o que fai que nos Bradyrhizobium sexa extremadamente difícil de usar como indicador da diversidade de especies. A hibridación ADN–ADN utilizouse no seu lugar para mostrar maior diversidade. Porén, así a todo observáronse poucas diferenzas fenotípicas, polo que non se nomearon moitas especies.[15]
Algunhas cepas son fotosintéticas; estes Bradyrhizobium adoitan formar nódulos nos talos de legumes semiacuáticas Aeschynomene e tamén se atoparon en nódulos radiculares do arroz silvestre africano Oryza breviligulata.[16]
Importancia[editar | editar a fonte]
Os cultivos de legumes de feixóns de distintos tipos ocupan 1,5 millóns de km2 de superficie agrícola cada ano.[12] A cantidade de nitróxeno fixada anualmente é de aproximadamente 44–66 millóns de toneladas no mundo, proporcionando case a metade de todo o nitróxeno usado na agricultura.[17] Para axudar ao seu cultivo disponse comercialmente de inoculantes de Bradyrhizobium.
Os Bradyrhizobium foron tamén identificados como contaminantes nos reactivos dos kits de extracción de ADN e nos sistemas de auga ultrapura, o que pode levar á súa errada aparición en conxuntos de datos metaxenómicos de microbiota.[18] A presenza de bacterias fixadoras do nitróxeno como contaminantes pode deberse ao uso do gas nitróxeno na produción de auga ultrapura para inhibir o crecemento microbiano nos tanques de almacenamento.[19]
Especies notables[editar | editar a fonte]
- Bradyrhizobium betae foi ilado de deformacións das raíces similares a tumores da remolacha azucreira; o seu status simbiótico é descoñecido.[15]
- Bradyrhizobium elkanii, Bradyrhizobium diazoefficiens e Bradyrhizobium liaoningense establecen simbiose coa soia.[15]
- Bradyrhizobium japonicum nodula a soia, Vigna unguiculata, Vigna radiata e Macroptilium atropurpureum.[15]
- Bradyrhizobium yuanmingense nodula plantas do xénero Lespedeza.[15]
- Bradyrhizobium canariense nodula legumes xenistoides endémicas das Illas Canarias. Tamén se atopou en nódulos en Lupinus e na Ornithopus sativus en Australia occidental e o sur de África.[15]
Notas[editar | editar a fonte]
- ↑ Ramirez-Bahena, M.-H.; Chahboune, R.; Peix, A.; Velazquez, E. (2012). "Reclassification of Agromonas oligotrophica into the genus Bradyrhizobium as Bradyrhizobium oligotrophicum comb. nov". International Journal of Systematic and Evolutionary Microbiology 63 (Pt 3): 1013–6. PMID 22685107. doi:10.1099/ijs.0.041897-0.
- ↑ 2,0 2,1 Eaglesham AR, Ellis JM, Evans WR, Fleishman DE, Hungria M, Hardy KW (1990). "The first photosynthetic N2-fixing Rhizobium: Characteristics". En Gresshoff PM, Koth LE, Stacey G, Newton WE. Nitrogen Fixation: Achievements and Objectives. Boston, MA: Springer. pp. 805–811. ISBN 978-1-4684-6434-4. doi:10.1007/978-1-4684-6432-0_69.
- ↑ VanInsberghe, David; Maas, Kendra; Cardenas, Erick; Strachan, Cameron; Hallam, Steven; Mohn, William (2015). "Non-symbiotic Bradyrhizobium ecotypes dominate North American forest soils". The ISME Journal 9 (11): 2435–2441. PMC 4611507. PMID 25909973. doi:10.1038/ismej.2015.54.
- ↑ 4,0 4,1 P. Somasegaran (1994). Handbook for rhizobia: Methods in legume–rhizobium technology. New York: Springer-Verlag. pp. 1–6, 167. ISBN 978-0-387-94134-9.
- ↑ Gary, King (2003). "Molecular and culture-based analyses of aerobic carbon monoxide oxidizer diversity". Applied and Environmental Microbiology 69 (12): 7257–7265. PMC 309980. PMID 14660374. doi:10.1128/aem.69.12.7257-7265.2003.
- ↑ 6,0 6,1 6,2 "List of Prokaryotic names with Standing in Nomenclature —Bradyrhizobium". Consultado o 23 de maio de 2021.
- ↑ 7,0 7,1 7,2 Klepa MS, Ferraz Helene LC, O'Hara G, Hungria M. (2021). "Bradyrhizobium agreste sp. nov., Bradyrhizobium glycinis sp. nov. and Bradyrhizobium diversitatis sp. nov., isolated from a biodiversity hotspot of the genus Glycine in Western Australia". Int J Syst Evol Microbiol 71 (3). PMC 8375429. PMID 33709900. doi:10.1099/ijsem.0.004742.
- ↑ 8,0 8,1 Kalita, M; Małek, W (2010). "Genista tinctoria microsymbionts from Poland are new members of Bradyrhizobium japonicum bv. genistearum". Systematic and Applied Microbiology 33 (5): 252–9. PMID 20452160. doi:10.1016/j.syapm.2010.03.005.
- ↑ Hördt, Anton; López, Marina García; Meier-Kolthoff, Jan P.; Schleuning, Marcel; Weinhold, Lisa-Maria; Tindall, Brian J.; Gronow, Sabine; Kyrpides, Nikos C.; Woyke, Tanja; Göker, Markus (7 de abril de 2020). "Analysis of 1,000+ Type-Strain Genomes Substantially Improves Taxonomic Classification of Alphaproteobacteria". Frontiers in Microbiology 11: 468. PMC 7179689. PMID 32373076. doi:10.3389/fmicb.2020.00468.
- ↑ 10,0 10,1 Stacey, Gary (1995). "Bradyrhizobium japonicum nodulation genetics". FEMS Microbiology Letters 127 (1–2): 1–9. PMID 7737469. doi:10.1111/j.1574-6968.1995.tb07441.x.
- ↑ Stacey, G; Sanjuan, J.; Luka, S.; Dockendorff, T.; Carlson, R.W. (1995). "Signal exchange in the Bradyrhizobium–soybean symbiosis". Soil Biology and Biochemistry 27 (4–5): 473–483. doi:10.1016/0038-0717(95)98622-U.
- ↑ 12,0 12,1 Caetanoanolles, G (1997). "Molecular dissection and improvement of the nodule symbiosis in legumes". Field Crops Research 53 (1–3): 47–68. doi:10.1016/S0378-4290(97)00022-1.
- ↑ van Berkum, P.; Sloger, C.; Weber, D. F.; Cregan, P. B.; Keyser, H. H. (1985). "Relationship between Ureide N and N2 Fixation, Aboveground N Accumulation, Acetylene Reduction, and Nodule Mass in Greenhouse and Field Studies with Glycine max (L.) Merr". Plant Physiol. 77 (1): 53–58. PMC 1064455. PMID 16664027. doi:10.1104/pp.77.1.53.
- ↑ Hennecke, H (1990). "Nitrogen fixation genes involved in the Bradyrhizobium japonicum–soybean symbiosis". FEBS Letters 268 (2): 422–6. PMID 2200721. doi:10.1016/0014-5793(90)81297-2.
- ↑ 15,0 15,1 15,2 15,3 15,4 15,5 Rivas, Raul; Martens, Miet; De Lajudie, Philippe; Willems, Anne (2009). "Multilocus sequence analysis of the genus Bradyrhizobium". Systematic and Applied Microbiology 32 (2): 101–10. PMID 19201125. doi:10.1016/j.syapm.2008.12.005.
- ↑ Chaintreuil, Clémence; Giraud, Eric; Prin, Yves; Lorquin, Jean; Bâ, Amadou; Gillis, Monique; de Lajudie, Philippe; Dreyfus, Bernard (decembro de 2000). "Photosynthetic Bradyrhizobia Are Natural Endophytes of the African Wild Rice Oryza breviligulata". Applied and Environmental Microbiology 66 (12): 5437–5447. Bibcode:2000ApEnM..66.5437C. PMC 92479. PMID 11097925. doi:10.1128/AEM.66.12.5437-5447.2000. Consultado o 7 de maio de 2021.
- ↑ Alberton, O; Kaschuk, G; Hungria, M (2006). "Sampling effects on the assessment of genetic diversity of rhizobia associated with soybean and common bean". Soil Biology and Biochemistry 38 (6): 1298–1307. doi:10.1016/j.soilbio.2005.08.018.
- ↑ Salter, S; Cox, M; Turek, E; Calus, S; Cookson, W; Moffatt, M; Turner, P; Parkhill, J; Loman, N; Walker, A (2014). "Reagent contamination can critically impact sequence-based microbiome analyses".bioRxiv 10.1101/007187.
- ↑ Kulakov, L; McAlister, M; Ogden, K; Larkin, M; O'Hanlon, J (2002). "Analysis of Bacteria Contaminating Ultrapure Water in Industrial Systems". Applied and Environmental Microbiology 68 (4): 1548–1555. Bibcode:2002ApEnM..68.1548K. PMC 123900. PMID 11916667. doi:10.1128/AEM.68.4.1548-1555.2002.
