Virus de Epstein-Barr
| Virus de Epstein–Barr | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Dous virións de Epstein–Barr | |||||||||||||
| Clasificación científica | |||||||||||||
| |||||||||||||
| Sinónimos | |||||||||||||
| |||||||||||||
O virus de Epstein-Barr (EBV), tamén chamado herpesvirus humano 4 (HHV-4, Human herpesvirus 4), é un dos oito virus humanos da familia dos herpesvirus, e un dos virus humanos máis comúns. Recibe o seu nome polos apelidos dos seus descubridores, Michael Anthony Epstein e Yvonne Barr.
É principalmente coñecido por ser o causante da mononucleose infecciosa (febre glandular). Tamén está asociado con determinadas formas de cancro, como o linfoma de Hodgkin, linfoma de Burkitt, cancro gástrico, carcinoma nasofarínxeo, e as condicións asociadas co virus da inmunodeficiencia humana (HIV), como a leucoplaquia pilosa e os linfomas de sistema nervioso central.[1][2] Hai probas de que a infección polo EBV está asociada cun risco máis alto de ter certas doenzas autoinmunes,[3] especialmente dermatomiosite, lupus eritematoso sistémico, artrite reumatoide, síndrome de Sjögren,[4][5] e esclerose múltiple.[6] Uns 200.000 casos de cancro ao ano poden atribuírse ao EBV.[7]
A infección polo EBV ocorre por transferencia oral de saliva[8] e secrecións xenitais.
A maioría da xente acaba sendo infectada polo EBV e adquire inmunidade adaptativa. Por exemplo, hai estudos feitos nos Estados Unidos que indican que nese país a metade dos nenos de cinco anos de idade e un 90 % dos adultos teñen evidencias de infeccións previas.[9] Os nenos pequenos fanse susceptibles ao EBV en canto desaparece a súa protección polos anticorpos maternos. Moitos nenos son infectados polo EBV, e estas infeccións xeralmente non causan síntomas nin se distinguen doutras doenzas leves e breves da infancia. Cando a infección ocorre na adolescencia, causa mononucleose infecciosa no 35 a 50 % dos casos.[10]
O EBV infecta as células B do sistema inmunitario e células epiteliais. Unha vez que a infección lítica inicial polo EBV queda controlada, o EBV persiste de forma latente nas células B durante toda a vida da persoa.[8]
Papel en enfermidades
[editar | editar a fonte]EBV foi implicada en varias doenzas como a mononucleose infecciosa,[11] linfoma de Burkitt,[12] Hodgkin's lymphoma,[13] cancro gástrico,[14] carcinoma nasofarínxeo,[15] esclerose múltiple,[6] e granulomatose linfomatoide.[16]
O EBV foi tamén implicado en trastornos relacionados coa agregación da alfa-sinucleína (por exemplo, enfermidade de Parkinson, demencia con corpos de Lewy e atrofia multisistémica).[17]
Historia
[editar | editar a fonte]O virus de Epstein–Barr recibe ese nome en honor dos británicos Michael Anthony Epstein (nado en 1921) e de Yvonne Barr (nada o 1932), que o descubriron conxuntamente[18] e en 1964 publicaron o informe da existencia do virus.[19] En 1961, Epstein, un patólogo e experto en miroscopia electrónica, asistiu a unha conferencia titulada "O cancro infantil máis común en África tropical, unha síndrome non recoñecida ata agora", que daba Denis Parsons Burkitt, un cirurxián que traballaba daquela en Uganda, que era a descrición da "variante endémica" (forma perdiátrica) da doenza que hoxe leva o seu nome, o linfoma de Burkitt. En 1963, enviouse un espécime desde Uganda ao hospital de Middlesex, Inglaterra para que fose cultivado. Nas células cultivadas identificáronse partículas víricas, e os resultados foron publicados na revista The Lancet en 1964 por Epstein, Bert Achong, e Barr. As liñas celulares enviáronse a Werner e Gertrude Henle ao Hospital Infantil de Filadelfia, os cales desenvolveron marcadores serolóxicos. En 1967, un técnico do seu laboratorio contraeu a mononucleose e grazas a iso puideron comparar unha mostra sérica almacenada, e atoparon que se desenvolveran anticorpos contra o virus.[20][21][22] En 1968, descubriron que o EBV pode inmortalizar células B directamente despois da infección, imitando algunhas formas das infeccións relacionadas co EBV,[23] e confirmaron así a ligazón entre o virus e a infección da mononucleose.[24]
Viroloxía
[editar | editar a fonte]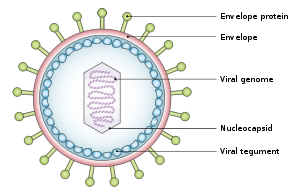
Estrutura e xenoma
[editar | editar a fonte]O virión é de aproximadamente 122 a 180 nm de diámetro e está composto por un ADN bicaenario duns 172.000 pares de bases e contén uns 85 xenes.[8] O ADN está rodeado por unha nucleocápside proteíca. Esta nucleocápside está rodeada por un tegumento feito de proteínas, que á súa vez está rodeado por unha envoltura que contén lípidos[25] e glicoproteínas que se proxectan na superfice e son esenciais para que o virus poida infectar á célula hóspede.[25]
Tropismo
[editar | editar a fonte]O termo tropismo viral refírese aos tipos de células que o EBV pode infectar. O EBV pode infectar diferentes tipos de células, como células B e células epiteliais.[26]
Os complexos glicoproeicos tripartitos virais de gHgLgp42 median a fusión coa membrana da célula B; aínda que son os complexos bipartitos de gHgL os que median a fusión coa membrana das células epiteliais. Os EBV que se replican en células B teñen un baixo número de complexos gHgLgp42, porque estes complexos tripartitos interaccionan no retículo endoplasmático con moléculas do antíxeno leucocitario humano (HLA) de clase II presentes en células B e son degradados. En contraste, os EBV que se replican nas células epiteliais son ricos en complexos tripartitos porque estas células normalmente non conteñen moléculas HLA de clase II. Como consecuencia, os EBV procedentes de células B son máis infecciosos para as células epiteliais, e os EBV procedentes de células epiteliais son máis infecciosos para as células B. Os virus que carecen da porción gp42 teñen capacidade de unirse a células B humanas mais son incapaces de infectar.[27]
Ciclo de replicación
[editar | editar a fonte]
Entrada na célula
[editar | editar a fonte]O EBV pode infectar tanto a células B coma a células epiteliais, aínda que utiliza mecanismos diferentes en cada un dos dous casos.
Para entrar nas células B, a glicoproteína viral gp350 únese ao receptor celular CD21 (tamén chamado CR2).[28] Despois, a glicoproteína viral gp42 interacciona con moléculas MHC de clase II celulares. Isto desencadea a fusión da envoltura viral coa membrana celular, o que permite que o EBV entre na célula B.[25] O CD35 humano, tamén chamado receptor do complemento 1 (CR1), é un factor de adhesión adicional para a gp350/220, e pode proporcionar unha ruta de entrada para o EBV en células CD21-negativas, incluíndo células B inmaturas. A infección polo EBV regula á baixa a expresión de CD35.[29]
Para entrar nas células epiteliais, a proteína viral BMRF-2 interacciona con integrinas β1 celulares. Despois, a proteína viral gH/gL interacciona coas integrinas αvβ6/αvβ8 celulares. Isto desencadea a fusión da envoltura viral coa membrana da célula epitelial, o que permite ao EBV entrar na célula epitelial.[25] A diferenza da entrada na célula B, a entrada nas células epiteliais é, en realidade, impedida pola glicoproteína gp42 viral.[28]
Unha vez que o EBV entra na célula, a cápside viral disólvese e o xenoma viral é transportado ao núcleo celular.
Replicación lítica
[editar | editar a fonte]O ciclo lítico, ou infección produtiva, ten como resultado a produción de novos virións infecciosos. O EBV pode realizar a replicación lítica tanto en células B coma en células epiteliais. Nas células B, a replicación lítica normalmente só ten lugar despois da reactivación tras unha latencia. En células epiteliais, a replicación lítica a miúdo segue directamente á entrada do virus na célula.[25]
Para que ocorra a replicación lítica, o xenoma viral debe ser liñal. O xenoma do EBV latente é circular, polo que debe linearizarse no proceso da reactivación lítica. Durante a replicación lítica, a ADN polimerase viral é responsable de copiar o xenoma viral. Isto contrasta coa latencia, na cal é a ADN polimerase da célula hóspede a que copia o xenoma viral.[25]
Os produtos dos xenes líticos prodúcense en tres estadios consecutivos chamados: temperán inmediato, temperán, e tardío.[25] Os produtos xénicos líticos temperáns inmediatos actúan como transactivadores, potenciando a expresión dos xenes líticos tardíos. Entre os produtos dos xenes líticos temperáns inmediatos están BZLF1 (tamén chamado Zta, EB1, asociado con ZEBRA) e BRLF1 (asociado con Rta).[25] Os produtos xénicos líticos temperáns teñen moitas máis funcións, como a replicación, metabolismo, e bloqueo do procesamento do antíxeno. Os produtos xénicos temperáns inclúen a BNLF2.[25] Finalmente, os produtos xénicos líticos tardíos adoitan ser proteínas con papeis estruturais, como o VCA, que forma a cápside viral. Outros produtos xénicos líticos tardíos, como BCRF1, axudan ao EBV a evadirse do sistema inmunitario.[25]
Fixéronse estudos utilizando o EGCG, que é un polifenol do té verde, que se demostrou que inhibe a infección lítica espontánea aos niveis do ADN, da transcrición e de proteínas de xeito dependente da dose e do tempo, así como a expresión dos xenes líticos do EBV Zta, Rta, e o complexo de antíxeno temperán EA-D (inducido por Rta), aínda que non é afectado o xene moi estable EBNA-1 que se encontra activo en todos os estados da infección.[30] Ademais, estase a estudar a activación de certos xenes para determinar como inducir a destrución inmunitaria de células B infectadas latentes utilizando o TPA ou o butirato de sodio.[30]
A diferenza da replicación lítca de moitos outros virus, a replicación lítica do EBV non leva inevitablemente á lise da célula hóspede porque os virións de Epstein-Barr saen da célula infectada por evaxinación. Entre as proteínas líticas están gp350 e gp110.[25][31]
Latencia
[editar | editar a fonte]A diferenza da replicación lítica, a latencia non dá lugar á produción de novos virións,[25] senón que o ADN circular xenómico do EBV permanece no núcleo celular en forma de episoma, e é copiado pola ADN polimerase celular.[25] Durante a latencia, só se expresa unha porción dos xenes do EBV.[8] O EBV latente expresa os seus xenes seguindo tres posibles patróns, chamados patróns de latencia. O EBV pode persistir en estado latente dentro das células B e células epiteliais, pero en ambos os tipos de células son posibles diferentes patróns de latencia.
O EBV pode mostrar os seguintes tres programas de latencia: Latencia I, Latencia II, e Latencia III. Cada programa de latencia leva á produción dun conxunto determinado e limitado de proteínas e de ARNs virais.[32][33]
| Xene Expresado | EBNA-1 | EBNA-2 | EBNA-3A | EBNA-3B | EBNA-3C | EBNA-LP | LMP-1 | LMP-2A | LMP-2B | EBER |
|---|---|---|---|---|---|---|---|---|---|---|
| Produto | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | ARNncs |
| Latencia I | + | – | – | – | – | – | – | – | – | + |
| Latencia II | + | – | – | – | – | + | + | + | + | + |
| Latencia III | + | + | + | + | + | + | + | + | + | + |
Tamén se postula que existe un programa no que a expresión de todas as proteínas virais está inactivada (Latencia 0).
Nas células B son posibles os tres tipos de programas de latencia.[8] A latencia do EBV en células B xeralmente progresa desde a Latencia III á Latencia II e á Latencia I. Cada estado de latencia inflúe de forma característica no comportamento da célula B.[8] Despois de infectar unha célula B virxe en repouso, o EBV entra na Latencia III. O conxunto de proteínas e ARNs producidos na Latencia III transforma a célula B facendo que prolifere activamente (o que se chama activación da célula B).[8][25] Posteriormente, o virus restrinxe a súa expresión xénica e entra en Latencia II. A conxunto máis limitado de proteínas e ARNs que se forma na Latencia II induce ás células B a diferenciarse en células B de memoria.[8][25] Finalmente, o EBV restrinxe a expresión xénica aínda máis e entra en Latencia I. A expresión de EBNA-1 permite que o xenoma de EBV se replique cando a célula B de memoria se divide.[8][25]
Na infección primaria, o EBV replícase en células epiteliais orofarínxeas e establece infeccións con Latencias III, II, e I nos linfocitos B. A infección latente por EBV dos linfocitos B é necesaria para que o virus persista, e para a subseguinte replicación en cálulas epiteliais, e a liberación de virus infecciosos na saliva. As infeccións con Latencias III e II de linfocitos B, e con Latencia II de células epiteliais orais, e con Latencia II de células NK ou células T pode orixinar tumores malignos, marcados pola presenza do xenoma de EBV uniforme e a expresión xénica.[34]
Reactivación
[editar | editar a fonte]O EBV latente nas células B pode ser reactivado e cambiar a un ciclo lítico de replicación. Isto ocorre in vivo, pero non se sabe que é o que o desencadea exactamente. In vitro, o EBV latente en células B pode ser reactivado ao estimular o receptor de célula B, polo que a ractivación in vivo probablemente ten lugar cando as células B infectadas de forma latente responden a infeccións non relacionadas.[25] In vitro, o EBV latente nas células B pode tamén ser reactivado tratando as células con butirato de sodio ou TPA.[35][36]
Transformación dos linfocitos B
[editar | editar a fonte]Cando o EBV infecta a células B in vitro, finalmente ocorre que as liñas celulares linfoblastoides adquiren a capacidade de proliferar indefinidamente. Esta transformación de proliferación é unha consecuencia da expresión de proteínas virais.
As proteínas EBNA-2, EBNA-3C e LMP-1 son esenciais para a transformación, mentres que EBNA-LP e as EBERs non o son.[37]
Postúlase que despois dunha infección por causas naturais polo EBV, o virus executa parte ou todo o seu repertorio de programas de expresión xénica para establecer unha infección persistente. Dada a ausencia inicial de inmunidade do hóspede, o ciclo lítico produce grandes cantidades de novos virus para infectar (presumiblemente) a outros linfocitos B do hóspede.
Os programas latentes reprograman e subverten os linfocitos B infectados para que proliferen e traian células infectadas aos sitios os que o virus pode presumiblemente persistir. Finalmente, cando se desenvolve a inmunidade do hóspede, o virus persiste inactivando a expresión da maioría ou de todos os seus xenes, que só se reactivan ocasionalmente para producir novos virións. Finalmente chégase a un equilibrio entre a reactivación viral ocasional e a vixilancia inmunitaria do hóspede que elimina as células que activan a expresión xénica viral.
O lugar onde se localiza a persistencia do EBV podería ser a medula ósea. Os pacientes EBV-positivos aos que lles substituíu a súa medula ósea por outra procedente dun doante EBV-negativo fanse EBV-negativos despois do transplante.[38]
Antíxenos latentes
[editar | editar a fonte]Todas as proteínas nuceares do EBV prodúcense por empalme alternativo dun transcrito que empeza no promotor Cp ou no Wp no extremo esquerdo do xenoma (na nomenclatura convencional). Os xenes están ordenados no xenoma así: EBNA-LP/EBNA-2/EBNA-3A/EBNA-3B/EBNA-3C/EBNA-1.
O codón de iniciación da rexión codificante de EBNA-LP créase por empalme alternativo de transcritos de proteínas nucleares. En ausencia deste codón de iniciación, a expresión de EBNA-2/EBNA-3A/EBNA-3B/EBNA-3C/EBNA-1 dependerá de cal destes xenes sexa o que sofre o empalme alternativo no transcrito.
Proteínas/xenes
[editar | editar a fonte]| Proteína/xene/antíxeno | Estadio | Descrición |
|---|---|---|
| EBNA-1 | latente+lítico | A proteína EBNA-1 únese a unha orixe de replicación (oriP) do xenoma viral e media na replicación e partición do episoma durante a división da célula hóspede. É a única proteína viral expresada durante a latencia de grupo I. |
| EBNA-2 | latente+lítico | EBNA-2 é o principal transactivador viral. |
| EBNA-3 | latente+lítico | A estes xenes tamén se une a proteína RBP-Jκ do hóspede. |
| LMP-1 | latente | LMP-1 é unha proteína transmembrana que a atravesa seis veces que é tamén esencial para a transformación de proliferación mediada polo EBV. |
| LMP-2 | latente | LMP-2A/LMP-2B son proteínas transmembrana que actúan bloqueando a sinalización da tirosina quinase. |
| EBER | latente | EBER-1/EBER-2 son ARNs nucleares pequenos que se unen a certas partículas nucleoproteicas, o que permite a unión de PKR (unha serina/treonina proteína quinase dependente de ARN bicatenario) que inhibe a súa función. As partículas EBER tamén inducen a produción de IL-10, o que potencia a proliferación e inhibe as células T citotóxicas. |
| v-snoRNA1 | latente | O snoRNA1 do virus de Epstein–Barr é unha caixa CD-snoRNA xerada polo virus durante a latencia. O v-snoRNA1 pode actuar como un precursor similar a un microARN que é procesado dando fragmentos de ARN dun tamaño de 24 nucleótidos que teñen como diana a rexión 3'UTR do ARNm da ADN polimerase viral.[39] |
| ebv-sisRNA | latente | O Ebv-sisRNA-1 é unha secuencia intrónica estable de ARN xerada durante o programa de latencia III. Despois dos EBERs este é o terceiro ARN pequeno máis abondoso producido polo virus durante este programa.[40] |
| microARNs | latente | Os microARNs do EBV están codificados en dous transcritos, un conxunto deles no xene BART e outro preto do cluster BHRF1. Os tres microARNs do BHRF1 exprésanse durante a latencia de tipo III, mentres que o gran cluster de microARNs de BART (ata 20 microARNs) exprésanse durante a latencia de tipo II. As funcións destes microARNs descoñécense polo momento. |
| EBV-EA | lítico | antíxeno temperán |
| EBV-MA | lítico | antíxeno de membrana |
| EBV-VCA | lítico | antíxeno da cápside viral |
| EBV-AN | lítico | nuclease alcalina[41][42] |
Subtipos de EBV
[editar | editar a fonte]O EBV pode dividirse en dous grandes tipos, o EBV tipo 1 e o EBV tipo 2. Estes dous subtipos teñen diferentes xenes EBNA-3. Como resultado, os dous subtipos difiren nas súas capacidades de transformación e de reactivación. O tipo 1 é o dominante na maior parte do mundo, pero os dous tipos son igual de frecuentes en África. Pode distinguirse o EBV tipo 1 do tipo 2 ao cortar o xenoma viral cun encima de restrición e comparar os patróns de dixestión resultantes por medio de electroforese en xel.[25]
Investigación
[editar | editar a fonte]Como é un virus relativamente complexo, aínda hai moitas cousas que non se comprenden do EBV. Laboratorios de todo o mundo continúan estudando este virus e desenvolvendo novos xeitos de tratar as doenzas que causa. Un modo común de estudar o EBV in vitro é utilizar cromosomas artificiais bacterianos.[43] O virus de Epstein–Barr pode ser mantido e manipulado no laboratorio en latencia continua (unha propiedade que comparte co herpesvirus asociado ao sarcoma de Kaposi, outro dos oito herpesvirus humanos). Aínda que se asume que moitos virus teñen esta propiedade durante a infección dos seus hóspedes naturais, non hai un sistema fácil para estudar esta parte do ciclo de vida viral. Os estudos xenómicos do EBV exploraron a reactivación lítica e a regulación dun episoma viral latente.[44]
Notas
[editar | editar a fonte]- ↑ Maeda E, Akahane M, Kiryu S; et al. (January 2009). "Spectrum of Epstein–Barr virus-related diseases: a pictorial review". Jpn J Radiol 27 (1): 4–19. PMID 19373526. doi:10.1007/s11604-008-0291-2.
- ↑ Cherry-Peppers, G; Daniels, CO; Meeks, V; Sanders, CF; Reznik, D (February 2003). "Oral manifestations in the era of HAART.". Journal of the National Medical Association 95 (2 Suppl 2): 21S–32S. PMC 2568277. PMID 12656429.
- ↑ Toussirot E, Roudier J (October 2008). "Epstein–Barr virus in autoimmune diseases". Best Practice & Research. Clinical Rheumatology 22 (5): 883–96. PMID 19028369. doi:10.1016/j.berh.2008.09.007.
- ↑ Dreyfus DH (December 2011). "Autoimmune disease: A role for new anti-viral therapies?". Autoimmunity Reviews 11 (2): 88–97. PMID 21871974. doi:10.1016/j.autrev.2011.08.005.
- ↑ Pender MP (2012). "CD8+ T-Cell Deficiency, Epstein–Barr Virus Infection, Vitamin D Deficiency, and Steps to Autoimmunity: A Unifying Hypothesis". Autoimmune Diseases 2012: 189096. PMC 3270541. PMID 22312480. doi:10.1155/2012/189096.
- ↑ 6,0 6,1 Ascherio A, Munger KL (September 2010). "Epstein–Barr virus infection and multiple sclerosis: a review". Journal of Neuroimmune Pharmacology 5 (3): 271–7. PMID 20369303. doi:10.1007/s11481-010-9201-3.
- ↑ http://www.cancerresearchuk.org/about-us/cancer-news/press-release/2014-03-24-developing-a-vaccine-for-the-epstein-barr-virus-could-prevent-up-to-200000-cancers-globally-say
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 8,6 8,7 8,8 Amon, Wolfgang; Farrell (November 2004). "Reactivation of Epstein–Barr virus from latency". Reviews in Medical Virology 15 (3): 149–56. PMID 15546128. doi:10.1002/rmv.456.
- ↑ About 90% of adults have antibodies that show that they have a current or past EBV infection. National Center for Infectious Diseases
- ↑ CDC. "Epstein–Barr Virus and Infectious Mononucleosis". CDC. Arquivado dende o orixinal o 27 de decembro de 2011. Consultado o 2011-12-29.
- ↑ Weiss, LM; O'Malley, D (2013). "Benign lymphadenopathies". Modern Pathology 26 (Supplement 1): S88–S96. PMID 23281438. doi:10.1038/modpathol.2012.176.
- ↑ Pannone, Giuseppe; Zamparese, Rosanna; Pace, Mirella; Pedicillo, Maria; Cagiano, Simona; Somma, Pasquale; Errico, Maria; Donofrio, Vittoria; Franco, Renato; De Chiara, Annarosaria; Aquino, Gabriella; Bucci, Paolo; Bucci, Eduardo; Santoro, Angela; Bufo, Pantaleo (2014). "The role of EBV in the pathogenesis of Burkitt’s Lymphoma: an Italian hospital based survey". Infectious Agents and Cancer 9 (1): 34. ISSN 1750-9378. doi:10.1186/1750-9378-9-34.
- ↑ Gandhi, MK (May 2004). "Epstein-Barr virus-associated Hodgkin's lymphoma". Br J Haematol. 125 (3): 267–81. PMID 15086409. doi:10.1111/j.1365-2141.2004.04902.x.
- ↑ "Developing a vaccine for the Epstein-Barr Virus could prevent up to 200,000 cancers globally say experts".
- ↑ Dogan, S; Hedberg, ML; Ferris, RL; Rath, TJ; Assaad, AM; Chiosea, SI (April 2014). "Human papillomavirus and Epstein-Barr virus in nasopharyngeal carcinoma in a low-incidence population.". Head & neck 36 (4): 511–6. PMID 23780921.
- ↑ Tagliavini, E.; Rossi, G.; Valli, R.; Zanelli, M.; Cadioli, A.; Mengoli, M. C.; Bisagni, A.; Cavazza, A.; Gardini, G. (August 2013). "Lymphomatoid granulomatosis: a practical review for pathologists dealing with this rare pulmonary lymphoproliferative process". Pathologica 105 (4): 111–116. PMID 24466760.
- ↑ Woulfe J, Hoogendoorn H, Tarnopolsky M, Muñoz DG. (Nov 14, 2000). "Monoclonal antibodies against Epstein-Barr virus cross-react with alpha-synuclein in human brain". Neurology 55 (9): 1398–401. PMID 11087792. doi:10.1212/WNL.55.9.1398.
- ↑ McGrath, Paula (6 April 2014). "Cancer virus discovery helped by delayed flight". BBC News, Health. Consultado o 4 November 2015.
- ↑ M. A. Epstein, B. G. Achong, and Y. M. Barr: Virus particles in cultured lymphoblasts from Burkitt's lymphoma. The Lancet, March 28, 1964, 1: 702–703
- ↑ Epstein, M. Anthony (2005). "1. The origins of EBV research: discovery and characterization of the virus". En Robertson, Earl S. Epstein–Barr Virus. Trowbridge: Cromwell Press. pp. 1–14. ISBN 1-904455-03-4. Consultado o September 18, 2010.
- ↑ Erle S. Robertson (2005). Epstein-Barr Virus. Horizon Scientific Press. p. 18. ISBN 978-1-904455-03-5. Consultado o 3 June 2012.
- ↑ Miller, George (December 21, 2006). "Book Review: Epstein–Barr Virus". New England Journal of Medicine 355 (25): 2708–2709. doi:10.1056/NEJMbkrev39523.
- ↑ Henle W, Henle G (1980). "Epidemiologic aspects of Epstein–Barr virus (EBV)-associated diseases". Annals of the New York Academy of Sciences 354: 326–31. PMID 6261650. doi:10.1111/j.1749-6632.1980.tb27975.x.
- ↑ Young, LS (2009). Desk Encyclopedia of Human and Medical Virology. Boston: Academic Press. pp. 532–533.
- ↑ 25,00 25,01 25,02 25,03 25,04 25,05 25,06 25,07 25,08 25,09 25,10 25,11 25,12 25,13 25,14 25,15 25,16 25,17 Odumade, O. A.; Hogquist, Balfour (January 2011). "Progress and Problems in Understanding and Managing Primary Epstein–Barr Virus Infections". American Society for Microbiology 24 (1): 193–209. PMC 3021204. PMID 21233512. doi:10.1128/CMR.00044-10. Arquivado dende o orixinal o 31 de maio de 2012. Consultado o 30 May 2012.
- ↑ Shannon-Lowe, C; Rowe, M (2014). "Epstein Barr virus entry; kissing and conjugation". Current Opinion in Virology 4: 78–84. PMID 24553068. doi:10.1016/j.coviro.2013.12.001.
- ↑ http://www.ncbi.nlm.nih.gov/pmc/articles/PMC109360/
- ↑ 28,0 28,1 "Entrez Gene: CR2 complement component (3d/Epstein Barr virus) receptor 2".
- ↑ Ogembo JG, Kannan L, Ghiran I, Nicholson-Weller A, Finberg RW, Tsokos GC, Fingeroth JD (2013). "Human complement receptor type 1/CD35 is an Epstein-Barr Virus receptor". Cell Rep. 3 (2): 371–385. PMC 3633082. PMID 23416052. doi:10.1016/j.celrep.2013.01.023.
- ↑ 30,0 30,1 http://carcin.oxfordjournals.org/content/34/3/627.full
- ↑ Lockey TD, Zhan X, Surman S, Sample CE, Hurwitz JL (2008). "Epstein–Barr virus vaccine development: a lytic and latent protein cocktail". Front. Biosci. 13 (13): 5916–27. PMID 18508632. doi:10.2741/3126. (require subscrición (?)).
- ↑ Calderwood MA, Venkatesan K, Xing L, Chase MR, Vazquez A, Holthaus AM, Ewence AE, Li N, Hirozane-Kishikawa T, Hill DE, Vidal M, Kieff E, Johannsen E (May 2007). "Epstein–Barr virus and virus human protein interaction maps". Proceedings of the National Academy of Sciences of the United States of America 104 (18): 7606–11. PMC 1863443. PMID 17446270. doi:10.1073/pnas.0702332104. A nomenclatura que se usará aquí é a de Kieff, pero outros laboratorios usan nomenclaturas diferentes.
- ↑ Hutzinger R, Feederle R, Mrazek J, Schiefermeier N, Balwierz PJ, Zavolan M, Polacek N, Delecluse H, Hüttenhofer A (August 14, 2009). Cullen, Bryan R., ed. "Expression and Processing of a Small Nucleolar RNA from the Epstein–Barr Virus Genome". PLoS Pathogens 5 (8): e1000547. PMC 2718842. PMID 19680535. doi:10.1371/journal.ppat.1000547.
- ↑ Robertson, ES (editor) (2010). Epstein–Barr Virus: Latency and Transformation. Caister Academic Press. ISBN 978-1-904455-62-2.
- ↑ Westphal EM, Blackstock W, Feng W, Israel B, Kenney SC. Activation of lytic Epstein-Barr virus (EBV) infection by radiation and sodium butyrate in vitro and in vivo: a potential method for treating EBV-positive malignancies. Cancer Res. 2000 Oct 15;60(20):5781-8. PMID 11059774
- ↑ Xiangrong Gaoa, Kazufumi Ikutaa, Masako Tajimab, Takeshi Sairenjia. 12-O-Tetradecanoylphorbol-13-acetate Induces Epstein–Barr Virus Reactivation via NF-κB and AP-1 as Regulated by Protein Kinase C and Mitogen-Activated Protein Kinase. Virology. Volume 286, Issue 1, 20 July 2001, Pages 91–99. doi 10.1006/viro.2001.0965. [1]
- ↑ Yates JL, Warren N, Sugden B (1985). "Stable replication of plasmids derived from Epstein–Barr virus in various mammalian cells". Nature 313 (6005): 812–5. PMID 2983224. doi:10.1038/313812a0.
- ↑ Gratama JW, Oosterveer MA, Zwaan FE, Lepoutre J, Klein G, Ernberg I (1988). "Eradication of Epstein–Barr virus by allogeneic bone marrow transplantation: implications for sites of viral latency". Proc. Natl. Acad. Sci. U.S.A. 85 (22): 8693–6. PMC 282526. PMID 2847171. doi:10.1073/pnas.85.22.8693.
- ↑ Hutzinger, R.; Feederle, R.; Mrazek, J.; Schiefermeier, N.; Balwierz, J.; Zavolan, M.; Polacek, N.; Delecluse, J.; Hüttenhofer, A. (Aug 2009). Cullen, Bryan R, ed. "Expression and processing of a small nucleolar RNA from the Epstein-Barr virus genome" (Free full text). PLoS Pathogens 5 (8): e1000547. ISSN 1553-7366. PMC 2718842. PMID 19680535. doi:10.1371/journal.ppat.1000547.
- ↑ Moss WN and Steitz JA (August 2013). "Genome-wide analyses of Epstein-Barr virus reveal conserved RNA structures and a novel stable intronic sequence RNA". BMC Genomics 14: 543. PMC 3751371. PMID 23937650. doi:10.1186/1471-2164-14-543.
- ↑ Buisson M, Géoui T, Flot D, Tarbouriech N, Ressing ME, Wiertz EJ, Burmeister WP (2009). "A bridge crosses the active-site canyon of the Epstein–Barr virus nuclease with DNase and RNase activities". J Mol. Biol. 319 (4): 717–28. PMID 19538972. doi:10.1016/j.jmb.2009.06.034.
- ↑ Buisson, M.; Géoui, T.; Flot, D.; Tarbouriech, N.; Ressing, M. E.; Wiertz, E. J.; Burmeister, W. P. (2009). "A Bridge Crosses the Active-Site Canyon of the Epstein–Barr Virus Nuclease with DNase and RNase Activities". Journal of Molecular Biology 391 (4): 717–728. PMID 19538972. doi:10.1016/j.jmb.2009.06.034.
- ↑ Delecluse HJ, Feederle R, Behrends U, Mautner J (December 2008). "Contribution of viral recombinants to the study of the immune response against the Epstein–Barr virus". Seminars in Cancer Biology 18 (6): 409–15. PMID 18938248. doi:10.1016/j.semcancer.2008.09.001.
- ↑ Arvey A, Tempera I, Tsai K, Chen HS, Tikhmyanova N, Klichinsky M, Leslie C, Lieberman PM (August 2012). "An atlas of the Epstein–Barr virus transcriptome and epigenome reveals host-virus regulatory interactions". Cell Host Microbe 12 (2): 233–245. PMC 3424516. PMID 22901543. doi:10.1016/j.chom.2012.06.008.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Transcritoma e epixenoma do EBV
- "Human herpesvirus 4". NCBI Taxonomy Browser. 10376.
