SNARE

Os SNARE son unha gran superfamilia de proteínas que consta de máis de 60 membros, atopados en lévedos e mamíferos. Denomínanse co acrónimo procedente da lingua inglesa SNARE, que deriva de SNAP REceptor (Receptor de SNAPs), e á súa vez SNAP deriva de Soluble NSF Attachment Protein (Proteína de unión a NSF soluble), e, finalmente, NSF significa N-ethylmaleimide Sensitive Factor ou NS fusion protein (Factor sensible á N-etilmaleimida, ou proteína de fusión sensible á N-etilmaleimida).[1] O principal papel das proteínas SNARE é mediar na fusión de vesículas, é dicir, a fusión de vesículas cos seus compartimentos diana celulares rodeados de membrana aos que van destinadas (como os lisosomas). Os SNAREs mellor estudados son os que median o atraque de vesículas sinápticas na membrana presináptica das neuronas. Estes SNAREs son as dianas de neurotoxinas bacterianas responsables do botulismo e tétano.
Tipos[editar | editar a fonte]
Os SNAREs poden dividirse en dúas categorías: "de vesícula" (v-SNAREs), que se incorporan ás membranas das vesículas de transporte durante a súa evaxinación, e "de diana"" ou target (t-SNAREs), que están localizados nas membranas dos compartimentos diana. A evidencia indica que os t-SNAREs forman subcomplexos estables que serven como guías para a unión de v-SNAREs para completar a formación do complexo SNARE.[2] Non obstante, varias proteínas SNARE están localizadas tanto en vesículas coma nas membranas dos compartimentos diana, polo que un sistema de clasificación máis recente ten en conta as características estruturais dos SNAREs, e divídeos en R-SNAREs e Q-SNAREs. A miúdo, os R-SNAREs actúan como v-SNAREs e os Q-SNAREs fano como t-SNAREs. Os R-SNAREs son proteínas que contribúen cun residuo de arxinina (R) á formación da capa iónica cero no complexo central SNARE ensamblado. Un exemplo de R-SNARE é a sinaptobrevina, que está localizada nas vesículas sinápticas. Os Q-SNAREs son proteínas que contribúen cun residuo de glutamina (Q) á formación da capa iónica cero no complexo central SNARE ensamblado. Entre os Q-SNAREs están a sintaxina e a SNAP-25. Finalmente, os Q-SNAREs poden ser clasificados nos subtipos Qa, Qb, ou Qc dependendo da súa localización no feixe de catro hélices.
Estrutura[editar | editar a fonte]
Os SNAREs son proteínas pequenas, abundantes e cunha cola ancorada, que a miúdo son inseridas postraducionalmente nas membranas por medio do seu dominio transmembrana C-terminal. Sete dos 38 SNAREs coñecidos, entre os que está SNAP-25, non teñen dominio transmembrana e insírense uníndose á membrana por medio de modificacións lipídicas como a palmitoilación.[3] As proteínas con cola ancorada poden inserirse na membrana plasmática, retículo endoplasmático, mitocondria, e peroxisomas, entre outras membranas, pero un determinado SNARE é destinado a unha única membrana. A marcaxe do destino dos SNAREs realízase alterando ou ben a composición dos residuos de aminoácidos flanqueantes C-terminais ou ben a lonxitude do dominio transmembrana. A substitución do dominio transmembrana por áncoras lipídicas orixina un estado intermedio de fusión de membranas no que só se fusionan as dúas capas en contacto das bicapas das membranas e non o fan as dúas capas distais das bicapas das dúas membranas.[4]
Aínda que os SNAREs varían considerablemente en estrutura e tamaño, todos comparten un segmento no seu dominio citosólico chamado motivo SNARE, que consta de 60 a 70 aminoácidos e contén repeticións de héptada que teñen a capacidade de formar estruturas de hélice superenrolada (coiled-coil). Os v- e t-SNAREs poden ensamblarse reversiblemente en feixes de catro hélices apertados chamados complexos "trans"-SNARE. Nas vesículas sinápticas, os complexos "trans" metaestables rapidamente formados están compostos por tres SNAREs: sintaxina 1 e SNAP-25 residentes na membrana celular e a sinaptobrevina (tamén denominada proteína de membrana asociada a vesículas ou VAMP) ancorada na membrana da vesícula.
Na exocitose neuronal, a sintaxina e a sinaptobrevina están ancoradas nas respectivas membranas polos seus dominios C-terminais, mentres que a SNAP-25 está amarrada á membrana plasmática por medio de varias cadeas palmitoíl ligadas a cisteína. O complexo central trans-SNARE é un feixe de catro hélices α, no que unha hélice α é proporcionada pola sintaxina 1, outra pola sinaptobrevina e dúas máis pola SNAP-25.
Os SNAREs residentes na membrana plasmática están presentes en microdominios ou agrupamentos, a integridade dos cales é esencial para que a célula realice a exocitose.
Fusión de membranas[editar | editar a fonte]

Durante a fusión de membranas, as proteínas v-SNARE e t-SNARE en membranas separadas combínanse para formar un complexo trans-SNARE, tamén chamado "SNAREpin". Dependendo do estado de fusión de membranas, estes complexos poden denominarse de diferentes maneiras.
Durante a fusión dos complexos trans-SNARE, as membranas fusiónanse e as proteínas SNARE implicadas na formación de complexos despois da fusión denomínanse complexo "cis"-SNARE, porque agora reside nunha soa (ou cis) membrana resultante. Despois da fusión, o complexo cis-SNARE únese a unha proteína adaptadora chamada alfaSNAP, que o desensambla. Despois, a ATPase AAA NSF hexamérica cataliza o despregamento dependente do ATP das proteínas SNARE e libéraas no citosol para a súa reciclaxe.
Pénsase que os SNAREs son os compoñentes centrais necesarios da maquinaria de fusión e poden funcionar independentemente de proteínas citosólicas adicionais. Isto foi demostrado polas chamadas "flipped" SNAREs (SNAREs "volteadas") producidas por enxeñaría, nas que os dominios SNARE están situados cara ao espazo extracelular en vez de cara ao citosol. Cando as células que conteñen v-SNAREs contactan con células que conteñen t-SNAREs, fórmanse os complexos trans-SNARE e prodúcese a fusión entre as células.[5]
Compoñentes[editar | editar a fonte]
O complexo SNARE central é un feixe de 4 hélices α.[6] A sinaptobrevina e a sintaxina contribúen cada unha cunha hélice α, mentres que o SNAP-25 participa no complexo con dúas hélices α (abreviadas como Sn1 e Sn2). Os residuos de aminoácidos que interaccionan e se unen en cremalleira co complexo SNARE poden agruparse en capas. Cada capa ten 4 residuos de aminoácidos, un residuo por cada 4 hélices α. No centro do complexo está a capa iónica cero composta por un residuo de arxinina (R) e tres de glutamina (Q), e está flanqueado por cremalleiras de leucina. As capas '-1', '+1' e '+2' no centro do complexo seguen moi aproximadamente a xeometría ideal da cremalleira de leucina e a composición de aminoácidos.[7]
A capa iónica cero está composta polo R56 da VAMP-2, o Q226 da sintaxina-1A, o Q53 da Sn1 e o Q174 da Sn2, e está completamente enterrado nas capas de cremalleira de leucina. O grupo guanidinio cargado positivamente do residuo de arxinina (R) interacciona cos grupos carboxilos de cada un dos tres residuos de glutamina (Q).
As capas flanqueantes de cremalleira de leucina actúan como selo impermeable á auga que serve para protexerse das interaccións iónicas dos solventes que o rodean. A exposición da capa iónica cero ao solvente acuoso ao romper as cremalleiras de leucina flanqueantes leva á inestabilidade do complexo SNARE e é o mecanismo suposto polo cal o α-SNAP e a NSF reciclan os complexos SNARE despois de que se complete a exocitose da vesícula sináptica.
Mecanismo da fusión de membranas[editar | editar a fonte]
Ensamblaxe[editar | editar a fonte]

As proteínas SNARE deben ensamblarse nos complexos trans-SNARE para que poidan proporcionar a forza que é necesaria para a fusión de vesículas. Os catro dominios de hélice α (un de cada sinaptobrevina e sintaxina, e dous da SNAP-25) xúntanse para formar un motivo de hélice superenrolada. O paso limitante no proceso de ensamblaxe é a asociación do dominio SNARE da sintaxina, xa que se encontra normalmente nun estado "pechado" no que non pode interaccionar con outras proteínas SNARE.[8] Cando a sintaxina está nun estado aberto, a formacióin do complexo trans-SNARE empeza coa asociacióin dos catro dominios SNARE no seu N-terminal. Os dominios SNARE actúan formando un motivo en hélice superenrolada na dirección do C-terminal dos seus dominios respectivos.
A proteína SM Munc18 crese que xoga un papel na ensamblaxe do complexo SNARE, aínda que o mecanismo exacto polo cal actúa é aínda debatido. Sábese que o enganche de Munc18 bloquea a sintaxina nunha conformación pechada ao unirse aos dominios α-helicoidais SNARE, que inhibe que a sintaxina entre nos complexos SNARE (e dese modo inhibe a fusión de vesículas).[8] Porén, o enganche pode tamén unirse ao feixe completo de catro hélices do complexo trans-SNARE. Unha hipótese suxire que, durante a ensamblaxe do complexo SNARE, o enganche de Munc18 libera a sintaxina pechada, permanece asociado co péptido N-terminal da sintaxina (o que permite a asociación do dominio SNARE da sintaxina con outras proteìnas SNARE), e despois volve a unirse ao complexo SNARE de catro hélices acabado de formar.[9] Este posible mecanismo de disociación e a subseguinte reasociación cos dominios SNARE podería ser dependente do calcio.[10] Isto apoia a idea de que Munc18 xoga un papel clave regulador na fusión de vesículas; baixo condicións normais Munc18 impedirá que se forme o complexo SNARE, pero cando se desencadea a acción de Munc18 esta axudará á ensamblaxe do complexo SNARE e, por tanto, actúa como un catalizador da fusión.[9]
Apertura de unión en cremalleira e poro de fusión[editar | editar a fonte]

A fusión de membranas comprende unha serie de eventos moi esixentes enerxeticamente, que requiren a translocación de proteínas na membrana e a alteración da bicapa lipídica, seguida da formación dunha estrutura de membrana moi curvada. O proceso de xuntar as dúas membranas require enerxía para superar as forzas electrostáticas repulsivas entre as membranas. Non se coñece o mecanismo que regula o movemento das proteínas asociadas a membranas fóra da zona do contacto entre membranas antes de que se produza a fusión, pero o incremento local na curvatura da membrana crese que contribúe ao proceso. Os SNAREs xeran enerxía por medio de interaccións proteína-lípido e proteína-proteína, que actúan como unha forza impulsora da fusión de membranas.
Un modelo hipotetiza que a forza necesaria para xuntar as dúas membranas durante a a fusión procede do cambio conformacional nos complexos trans-SNARE para formar complexos cis-SNARE. A hipótese actual que describe este proceso denomínase "unión en cremalleira" dos SNAREs.[11]
Cando se forma o complexo trans-SNARE, as proteínas SNARE aínda se encontran en membranas opostas. A medida que os dominios SNARE continúan enrolándose nun proceso espontáneo, forman un feixe de catro hélices moito máis apertado e estable. Durante esta "unión en cremalleira" do complexo SNARE, pénsase que unha fracción da enerxía liberada na unión é almacenada como tensión de curvatura molecular nos motivos SNARE individuais. Postúlase que este estrés mecánico é almacenado nas rexións de enlace semirríxidas entre os dominios transmembrana e o feixe helicoidal de SNAREs.[12][13] A curvatura enerxeticamente desfavorable minimízase cando o complexo se move perifericamente ao sitio de fusión das membranas. Como resultado, alíviase o estrés e isto supera as forzas repulsivas entre as vesículas e a membrana celular e preme as dúas membranas unha contra outra para que se unan.[14]
Téñense proposto varios modelos para explicar o paso seguinte (a formación de talos e poros de fusión). Porén, a natureza exacta destes procesos aínda se debate. De acordo coa hipótese "cremalleira", a medida que se forma o complexo SNARE, o feixe de hélices que se vai apertando crea unha forza de torsión sobre os dominios transmembrana (TM) da sinaptobrevina e sintaxina.[15] Isto causa que os dominios TM se inclinen nas membranas separadas a medida que as proteínas se enroscan máis apertadamente. A configuración inestable dos dominios TM causa finalmente que as dúas membranas se fusionen e as proteínas SNARE se xunten formando unha soa membrana, o cal se denomina complexo cis-SNARE.[16] Como resultado do rearranxo dos lípidos, ábrese un poro de fusión e isto permite que o contido químico que leva a vesícula se verta ao ambiente externo.
Outra explicación é a explicación continua da formación de talos, que suxire que a fusión de membranas empeza cun raio infinitesimal ata que se expande radialmente formando unha estrutura de tipo talo. Porén, esta descrición falla ao ter en conta a dinámica molecular dos lípidos de membrana. Simulacións moleculares recentes mostran que a estreita proximidade das membranas permite que os lípidos separen as súas colas, de maneira que unha poboación de lípidos insire unha das súas colas hidrófobas na membrana veciña, de modo que queda situado "poñendo un pé" en cada unha das membranas. A resolución dun estado de lípido separado prodúcese espontaneamente para formar a estrutura en talo. Nesta explicación molecular, o estado intermedio de lípido coas colas separadas é a barreira limitante do proceso e non a formación do talo, o cal agora convértese no mínimo de enerxía libre. A barreira enerxética para o establecemento da conformación de lípido separado é directamente proporcional á distancia intermembrana. Por tanto, os complexos SNARE e a súa presión para xuntar as dúas membranas poderían proporcionar a enerxía libre que cómpre para superar a barreira.[17]
Desensamblaxe[editar | editar a fonte]
A enerxía que se necesita para que teña lugar a fusión de membranas mediada por SNAREs procede da desensamblaxe do complexo SNARE. A fonte de enerxía que se sospeita que actúa é o factor sensible á N-etilmaleimida (NSF), unha ATPase que está implicada na fusión das membranas. Os homohexámeros de NSF, xunto co cofactor de NSF α-SNAP, únense e disócianse do complexo SNARE ao acoplaren este proceso coa hidrólise do ATP.[18] Este proceso permite a recaptación da sinaptobrevina para o seu uso posterior na vesícula, mentres que as outras proteínas SNARE permanecen asociadas coa membrana plasmática.
As proteínas SNARE disociadas teñen un estado de enerxía maior que o complexo cis-SNARE máis estable. Crese que a enerxía que impulsa a fusión deriva da transición a un complexo cis-SNARE de menor enerxía. A disociación de complexos SNARE acoplada á hidrólise do ATP é un investimento de enerxía que pode ser comparado con "amartelar unha pistola" para que, unha vez que se desencadea a fusión da vesícula, o proceso teña lugar espontaneamente e a unha velocidade óptima. Un proceso comparable ten lugar nos músculos, nos cales as cabezas de miosina deben primeiramente hidrolizar ATP para adaptar a conformación necesaria para a interacción coa actina e que se produza a forza de pulo para mover os miofilamentos.
Efectos reguladores sobre a exocitose[editar | editar a fonte]
Regulación por medio da palmitoilación de SNAP-25[editar | editar a fonte]
A proteína Q-SNARE Proteína 25 asociada sinaptosomal (SNAP-25) está composta por dous dominios α-helicoidais conectados por un tramo de enlace (linker) con enrolamento aleatorio. Esta rexión enlazadora caracterízase por ter catro residuos de cisteína.[19] Os dominios en hélice α combínanse cos da sintaxina e sinaptobrevina (tamén chamada proteína de membrana asociada ás vesículas ou VAMP) para formar o complexo SNARE de hélice superenrolada de 4 hélices α esencial para unha exocitose eficiente.
Aínda que tanto a sintaxina coma a sinaptobrevina conteñen dominios transmembrana que permiten o atraque coas membranas da diana e a vesícula respectivamente, a SNAP-25 depende da palmitoilación dos residuos de cisteína que se encontran na súa rexión con enrolamento aleatorio para o atraque á membrana diana. Algúns estudos indicaron que a asociación coa sintaxina por medio de interaccións cos SNARE evita a necesidade deses mecanismos de atraque. Porén, os estudos de knockdown da sintaxina, non mostraron que houbese un decrecemento na unión á membrana de SNAP-25, o que suxire que debe existir un modo de atraque alternativo.[20] O enlace covalente de cadeas de ácidos graxos a SNAP-25 por medio de enlaces tioéster cun ou máis residuos de cisteína proporciona, por tanto, unha regulación do atraque e finalmente da exocitose mediada por SNARE. Este proceso é mediado por un encima especializado chamado DHHC palmitoíl transferase.[21] O dominio rico en cisteína de SNAP-25 pode asociarse feblemente coa membrana plasmática permitindo posiblemente que sexa localizado preto do encima para a subseguinte palmitoilación. O inverso deste proceso lévao a cabo outro encima chamado palmitoíl proteína tioesterase (ver figura).

Tamén se teoriza que a dispoñibilidade de SNAP-25 no complexo SNARE posiblemente estea regulada espacialmente por medio da localización de microdominios lipídicos na membrana diana. Os residuos de cisteína palmitoilados poderían ser localizados na rexión da membrana diana desexada por medio dun ambiente lipídico favorable (posiblemente rico en colesterol) complementario das cadeas de ácido graxo unidas aos residuos de cisteína de SNAP-25.[22]
Regulación de SNAP-25 das canles de Ca2+ reguladas por voltaxe nos axóns neuronais terminais[editar | editar a fonte]
A medida que un potencial de acción chega ao axón terminal, eventos de despolarización estimulan a apertura de canles de calcio reguladas por voltaxe (VGCCs), o que permite unha rápida entrada de calcio a favor do seu gradiente electroquímico. O calcio estimula a exocitose ao unirse á sinaptotagmina 1. Porén, a SNAP-25, regula negativamente a función das canles de calcio regulados por voltaxe en células neuronais glutamatérxicas. A SNAP-25 orixina a redución da densidade de corrente a través da canle de calcio e así diminúe a cantidade de calcio que se une á sinaptotagmina, causando unha diminución na exocitose glutamaérxica neuronal. Inversamente, a subexpresión de SNAP-25 fai que se incremente a densidade de corrente nas canles de calcio e aumente a exocitose.[23]
Algunhas investigacións indican que hai posibles relacións entre a sobre/subexpresión de SNAP-25 e unha variedade de doenzas cerebrais. No trastorno por déficit de atención con hiperactividade (TDAH), os polimorfismos no locus do SNAP-25 en humanos foron ligados á enfermidade, o que suxire un potencial papel na súa manifestación.[24] Isto tamén é indicado polos estudos de knockout de SNAP-25 heteroxéneo realizados en ratos mutantes con coloboma (defecto ocular), que orixinaron as características fenotípicas do TDAH.[25] Outros estudos indicaron tamén unha correlación da sobre/subexpresión de SNAP-25 e o comezo da esquizofrenia.[26][27]
A sintaxina e o dominio Habc[editar | editar a fonte]
A sintaxina consta dun dominio transmembrana (TMD), un dominio SNARE en hélice alfa, unha rexión de enlace curta, e o dominio Habc, que consta de tres rexións en hélice alfa. O dominio SNARE da sintaxina serve como un sitio diana para o atraque de SNAP-25 e sinaptobrevina para formar o necesario feixe de catro hélices do complexo SNARE e a subseguinte fusión. Porén, o dominio Habc, funciona como un dominio autoinhibidor na sintaxina. Prégase sobre o dominio SNARE da sintaxina e asóciase con el, inducindo un estado "pechado", creando unha barreira física para a formación do motivo SNARE. Inversamente, o dominio Habc pode agora disociarse do dominio SNARE o que deixa a sintaxina libre para poder asociarse tanto con SNAP-25 coma coa sinaptobrevina.[28]
A sintaxina 1B e o conxunto de vesículas facilmente liberables[editar | editar a fonte]
Hai unha enorme diversidade de subtipos de sintaxina, e no xenoma humano hai 15 variedades.[29] Suxeriuse que a sintaxina1B ten un papel na regulación do número de vesículas sinápticas listas para a exocitose no axón terminal. Isto tamén se denomina conxunto de vesículas facilmente liberables (RRP). Un estudo de knockout de xenes de 2014 indicou que a falta de sintaxina1B causa un descenso significativo do tamaño destas vesículas RRP.[30]
Toxinas[editar | editar a fonte]
Moitas neurotoxinas afectan directamente aos complexos SNARE. Toxinas como a toxina botúlica e a tetánica funcionan tomando como dianas os complexos SNARE. Estas toxinas impiden a correcta reciclaxe das vesículas e como resultado prodúcese un control muscular malo, espasmos, parálise, e mesmo a morte.
Neurotoxina botúlica[editar | editar a fonte]
A toxina botúlica (BoNT) é unha das toxinas máis potentes coñecidas.[31] É un encima proteolítico que cliva as proteínas SNARE nas neuronas. A súa estrutura proteica está composta por dúas subunidades peptídicas, unha cadea pesada (de 100kDa) e unha cadea lixeira (de 50kDa), que están unidas por unha ponte disulfuro. A acción da BoNT ten lugar por un mecanismo de 4 pasos, que inclúe a unión á membrana neuronal, a endocitose, a translocación de membranas, e a proteólise de proteínas SNARE.[32]
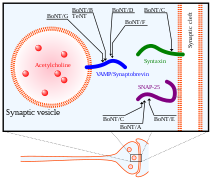
No seu mecanismo de acción, a cadea pesada da BoNT utilízase primeiro para atopar as súas dianas neuronais e unirse aos gangliósidos e proteínas de membrana das neuronas presinápticas. Seguidamente, a toxina é endocitada na membrana plasmática. A cadea pesada sofre un cambio conformacional importante para tanslocar a cadea lixeira no citosol da neurona. Finalmente, despois de que a cadea lixeira da BoNT se leva ao citosol da neurona diana, libérase da cadea pesada para que poida chegar aos seus sitios de clivaxe activos nas proteínas SNARE.[32] A cadea lixeira libérase da cadea pesada por redución da ponte disulfuro que as mantiña unidas. A redución desta ponte disulfuro é mediada polo sistema NADPH-tioredoxina redutase-tiorredoxina.[34] A cadea lixeira da BoNT actúa como unha metaloprotease sobre as proteínas SNARE, que é dependente de ións Zn(II),[35] clivándoas e eliminando a súa función na exocitose.
Coñécense 8 isotipos de BoNT, nomeados de BoNT/A a BoNT/H, cada un con diferentes sitios de clivaxe específicos sobre as proteínas SNARE. SNAP25 é un membro da familia de proteínas SNARE localizado na membrana das células, que é clivado polos isotipos de BoNT A, C, e E. A clivaxe de SNAP-25 por estes isotipos de BoNT inhibe grandemente a súa función na formación do complexo SNARE por fusión de vesículas á membrana sináptica. BoNT/C tamén ten como diana a sintaxina-1, outra proteína SNARE localizada na membrana sináptica. Degrada estas proteínas sintaxina cun rendemento similar que con SNAP-25. Unha terceira proteína SNARE, a sinaptobrevina (VAMP), está localizada nas vesículas e a VAMP2 é tamén unha diana e é clivada polos isotipos de BoNT B, D, e F en neuronas sinápticas.[31] As dianas destes varios isotipos de BoNT e da neurotoxina tetánica (TeNT) móstranse na figura da dereita.
En cada un destes casos, a neurotoxina botúlica causa danos funcionais ás proteínas SNARE, o cal ten implicacións médicas e fisiolóxicas significativas. Ao danar as proteínas SNARE, a toxina impide que as vesículas sinápticas se fusionen coa membrana sináptica e liberen os seus neurotransmisores na fenda sináptica. Coa inhibición da liberación de neurotransmisores na fenda sináptica, os potenciais de acción non se poden propagar para estimular as células musculares. Isto ten como resultado a parálise nos individuos infectados e en casos graves pode orixinar a morte. Aínda que os efectos da neurotoxina botúlica poden ser fatais, tamén foi utilizada como axente terapéutico en tratamentos médicos e cosméticos.[36][37]
Neurotoxina tetánica[editar | editar a fonte]

A toxina tetánica ou TeNT está composta por unha cadea pesada (de 100KDa) e outra lixeira (de 50kDa) que están conectadas por unha ponte disulfuro. A cadea pesada é responsable da unión neuroespecífica da TeNT á membrana terminal do nervio, e tamén da endocitose da toxina, e da translocación da cadea lixeira no citosol. A cadea lixeira ten unha actividade de endoeptidase dependente de zinc ou máis especificamente unha actividade de metaloproteinase de matriz (MMP) por medio da cal ten lugar a clivaxe da sinaptobrevina ou VAMP.[38]
Para que sexa activada a cadea lixeira da TeNT debe unirse un átomo de zinc a cada molécula da toxina.[39] Cando se une o zinc prodúcese a redución da ponte disulfuro principalmente por medio do sistema redox da NADPH-tiorredoxina redutase-tiorredoxina.[40] Despois, a cadea lixeira queda libre para clivar o enlace Gln76-Phe77 da sinaptobrevina.[38] A clivaxe da sinaptobrevina afecta á estabilidade do núcleo central (core) do SNARE ao restrinxir a súa entrada na conformación de baixa enerxía, que é a diana para a unión da NSF.[41] Esta clivaxe da sinaptobrevina é a diana final da TeNT e mesmo a baixas doses de neurotoxina inhibe a exocitose do neurotransmisor.
Papel na liberación de neurotransmisores[editar | editar a fonte]
Os neurotransmisores almacénanse en conxuntos de vesículas facilmente liberables contidas dentro da terminal presináptica. Durante a neurosecreción/exocitose, os SNAREs xogan un papel fundamental no atraque de vesículas, cebado, fusión, e sincronización da liberación de neurotransmisores na fenda sináptica.
O primeiro paso na fusión de vesículas sinápticas é o seu enganche á membrana, no cal as vesículas son translocadas desde o conxunto de vesículas para tomaren contacto físico coa membrana. Na membrana, a proteína Munc-18 está inicialmente unida á sintaxina 1A nunha estrutura pechada. Postúlase que a disociación de Munc-18 do complexo libera a sintaxina 1A para que se una coas proteínas v-SNARE.[42] O seguinte paso na liberación é o atraque das vesículas, no cal as proteínas v- e t-SNARE se asocian transitoriamente de maneira dependente do calcio. As vesículas son despois cebadas, polo que os motivos SNARE forman unha interacción estable entre a vesícula e a membrana. As proteínas complexinas estabilizan o complexo SNARE cebado orixinándose vesículas que xa están listas para a exocitose.
A zona da membrana sináptica que contén as vesículas cebadas e o conxunto de proteínas SNARE denomínase zona activa. As canles de calcio reguladas por voltaxe están moi concentrados arredor das zonas activas e ábrense en resposta á despolarización da membrana na sinapse. O fluxo de entrada de calcio é detectado pola sinaptotagmina 1, que á súa vez desaloxa a proteína complexina e permite que a vesícula se fusione coa membrana presináptica para liberar o neurotransmisor. As canles de calcio reguladas por voltaxe tamén interaccionan directamente coas t-SNAREs sintaxina 1A e SNAP-25, e coa sinaptotagmina 1. Estas interaccións poden inhibir a actividade da canle de calcio e ademais agregar estreitamente as moléculas na zona do sitio de liberación.[43]
En moitos casos clínicos atopouse que os xenes dos SNARE estaban ligados con trastornos neurais. Observouse unha deficiencia no ARNm do SNAP-25 no tecido do hipocampo dalgúns pacientes esquizofrénicos, e un polimorfismo de nucleótido simple no SNAP-25 está ligado a hiperactividade nos trastornos de espectro autista, e a sobreexpresión de SNAP-25B leva ao comezo temperán do trastorno bipolar.[43]
Papel na autofaxia[editar | editar a fonte]
A macroautofaxia é un proceso catabólico envolvido na formación de orgánulos de dobre membrana chamados autofagosomas, que axudan á degradación de compoñentes celulares por medio da fusión con lisosomas. Durante a autofaxia, porcións do citoplasma son englobados por unha estrutura de dobre membrana con forma de copa chamada fagóforo e finalmente convértense no contido dos autofagosomas totalmente ensamblados. Para a bioxénese de autofagosomas cómpre a iniciación e crecemento de fagóforos, un proceso que antes se cría que ocorría por medio dunha adición de novo de lípidos. Porén, probas recentes indican que os lípidos que contribúen ao crecemento dos fagóforos orixínanse a partir de numerosas fontes de membrana, entre as que están o retículo endoplasmático, o aparato de Golgi, a membrana plasmática, e as mitocondrias.[44] Os SNAREs xogan un importante papel en mediar a fusión de vesículas durante a iniciación e expansión dos fagóforos e na fusión autofagosoma-lisosoma nos últimos estadios da autofaxia.
Aínda que non se coñece o mecanismo de iniciación do fagóforo en mamíferos, os SNAREs foron implicados na formación de fagóforos por medio de fusión homotípica de pequenas vesículas de membrana simple revestidas de clatrina, que conteñen Atg16L, a v-SNARE VAMP7, e os seus t-SNAREs correspondentes: sintaxina-7, sintaxina-8, e VTI1B.[45] Nos lévedos, son necesarios os t-SNAREs Sec9p e Sso2p para a exocitose e promoven a evaxinación tubulovesicular de vesiculas Atg9 positivas, que se requiren tamén para a bioxénese de autofagosomas.[46] Ao facer un knock-out destes SNAREs prodúcese a acumulación de pequenas vesículas que conteñen Atg9, que non se fusionan, e así impídese a formación da estrutura preautofagosómica.[46]
Ademais da ensamblaxe do fagóforo, os SNAREs son tamén importantes na mediación da fusión autofagosoma-lisosoma. En mamíferos, os SNAREs VAMP7, VAMP8, e VTI1B son necesarios na fusión autofagosoma-lisosoma e este proceso está alterado nos trastornos de almacenamento lisosómico, nos que se acumula colesterol no lisosoma e os SNAREs quedan retidos nas rexións ricas en colesterol da membrana, o que impide a súa reciclaxe.[47] Recentemente, a sintaxina 17 (STX17) foi identificada como un SNARE asociado a autofagosomas que interacciona con VAMP8 e SNAP29 e é necesario para a fusión co lisosoma.[48] A STX17 está localizado na mmbrana externa dos autofagosomas, pero non nos fagóforos ou outros precursores dos autofagosomas, o cal impide que estes se fusionen prematuramente co lisosoma.[48] En lévedos, a fusión dos autofagosomas con vacúolos (equivalentes en lévedos dos lisosomas) require SNAREs e proteínas relacionadas como o homólogo da sintaxina Vam3, o homólogo de SNAP-25 Vam7, a GTPase de tipo Ras Ypt7, e o ortólogo de NSF, Sec18.[44]
Notas[editar | editar a fonte]
- ↑ Gerald K (2002). "Cell and Molecular Biology (4th edition)". John Wiley & Sons, Inc.
- ↑ Malsam J, Söllner TH (1 de outubro de 2011). "Organization of SNAREs within the Golgi stack.". Cold Spring Harbor perspectives in biology 3 (10): a005249. PMID 21768609. doi:10.1101/cshperspect.a005249.
- ↑ Hong W, Lev S (xaneiro de 2014). "Tethering the assembly of SNARE complexes.". Trends in cell biology 24 (1): 35–43. PMID 24119662. doi:10.1016/j.tcb.2013.09.006.
- ↑ Martens S, McMahon HT (21 de maio de 2008). "Mechanisms of membrane fusion: disparate players and common principles". Nature Reviews Molecular Cell Biology 9 (7): 543–556. PMID 18496517. doi:10.1038/nrm2417.
- ↑ Hu C, Ahmed M, Melia TJ, Söllner TH, Mayer T, Rothman JE (13 de xuño de 2003). "Fusion of Cells by Flipped SNAREs". Science 300 (5626): 1745–1749. PMID 12805548. doi:10.1126/science.1084909.
- ↑ Sutton RB, Fasshauer D, Jahn R, Brunger AT (1998). "Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 Å resolution". Nature 395 (6700): 347–353. PMID 9759724. doi:10.1038/26412. Arquivado dende o orixinal o 10 de setembro de 2006. Consultado o 08 de agosto de 2015.
- ↑ Fasshauer D, Sutton RB, Brunger AT, Jahn R (1998). "Conserved structural features of the synaptic fusion complex: SNARE proteins reclassified as Q- and R-SNAREs". Proceedings of the National Academy of Sciences 95 (26): 15781–15786. PMC 28121. PMID 9861047. doi:10.1073/pnas.95.26.15781.
- ↑ 8,0 8,1 Burkhardt P, Hattendorf DA, Weis WI, Fasshauer D (2008). "Munc18a controls SNARE assembly through its interaction with the syntaxin N-peptide". EMBO J. 27 (7): 923–33. PMC 2323264. PMID 18337752. doi:10.1038/emboj.2008.37.
- ↑ 9,0 9,1 Südhof TC, Rothman JE (xaneiro de 2009). "Membrane fusion: grappling with SNARE and SM proteins". Science 323 (5913): 474–7. PMC 3736821. PMID 19164740. doi:10.1126/science.1161748.
- ↑ Jahn R, Fasshauer D (2012). "Molecular machines governing exocytosis of synaptic vesicles". Nature 490 (7419): 201–7. PMID 23060190. doi:10.1038/nature11320.
- ↑ Chen YA, Scheller RH (2001). "SNARE-mediated membrane fusion". Nat. Rev. Mol. Cell Biol. 2 (2): 98–106. PMID 11252968. doi:10.1038/35052017.
- ↑ Wang Y, Dulubova I, Rizo J, Südhof TC (2001). "Functional analysis of conserved structural elements in yeast syntaxin Vam3p". J. Biol. Chem. 276 (30): 28598–605. PMID 11349128. doi:10.1074/jbc.M101644200.
- ↑ Kiessling V, Tamm LK (xaneiro de 2003). "Measuring distances in supported bilayers by fluorescence interference-contrast microscopy: polymer supports and SNARE proteins.". Biophysical journal 84 (1): 408–18. PMID 12524294. doi:10.1016/s0006-3495(03)74861-9.
- ↑ Risselada HJ, Kutzner C, Grubmüller H (2 de maio de 2011). "Caught in the act: visualization of SNARE-mediated fusion events in molecular detail.". Chembiochem : a European journal of chemical biology 12 (7): 1049–55. PMID 21433241. doi:10.1002/cbic.201100020.
- ↑ Fang Q, Lindau M (2014). "How could SNARE proteins open a fusion pore?". Physiology (Bethesda) 29 (4): 278–85. PMID 24985331. doi:10.1152/physiol.00026.2013.
- ↑ Zucker, Robert S.; Kullmann, Dimitri M.; Kaeser, Pascal S. (agosto de 2014). "Chapter 15: Release of Neurotransmitters". En Byrne, John H.; Heidelberger, Ruth; Waxham, M. Neal. From Molecules to Networks: An Introduction to Cellular and Molecular Neuroscience. Academic Press. pp. 443–488. ISBN 9780123982674.
- ↑ Risselada HJ, Grubmüller H (abril de 2012). "How SNARE molecules mediate membrane fusion: recent insights from molecular simulations.". Current opinion in structural biology 22 (2): 187–96. PMID 22365575. doi:10.1016/j.sbi.2012.01.007.
- ↑ Söllner T, Bennett MK, Whiteheart SW, Scheller RH, Rothman JE (1993). "A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion". Cell 75 (3): 409–18. PMID 8221884. doi:10.1016/0092-8674(93)90376-2.
- ↑ Bock, LV; Woodbury, DJ (9 de agosto de 2010). "Chemomechanical regulation of SNARE proteins studied with molecular dynamics simulations". Biophysical Journal 99 (4). doi:10.1016/j.bpj.2010.06.019.
- ↑ Greaves, Jennifer (5 de abril de 2009). "Regulation of SNAP-25 Trafficking and Function by Palmitoylation". Biochemical Society Transactions 38 (part 1): 163–166. doi:10.1042/BST0380163.
- ↑ Greaves, Jennifer (11 de maio de 2010). "Palmitoylation of the SNAP-25 Protein Family: Specificity and Regulation by DHHC Palmitoyl Transferases". The Journal of Biological Chemistry 285 (32): 24629–24638. doi:10.1074/jbc.M110.119289.
- ↑ Greaves, Jennifer (5 de abril de 2009). "Regulation of SNAP-25 Trafficking and Function by Palmitoylation". Biochemical Society Transactions 38 (part 1): 163–166.
- ↑ Condliffe, Steven B (3 de xuño de 2010). "Endogenous SNAP-25 Regulates Native Voltage-gated Calcium Channels in Glutamatergic Neurons". The Journal of Biological Chemistry 285 (32): 24968–24976. doi:10.1074/jbc.M110.145813.
- ↑ Corradini, Irene (21 de xaneiro de 2009). "SNAP-25 in Neuropsychiatric Disorders". Annals of the New York Academy of Science 1152: 93–99. doi:10.1111/j.1749-6632.2008.03995.x.
- ↑ Hess, EJ (1992). "Spontaneous locomotor hyperactivity in a mouse mutant with a deletion including the Snap gene on chromosome 2". Journal of Neuroscience 12: 2865–2874. PMID 1613559.
- ↑ Thompson, PM (1998). "Altered levels of the synaptosomal associated protein SNAP-25 in schizophrenia". Biological Psychiatry 43: 239–243. PMID 11711867.
- ↑ Gabriel, SM (1997). "Increased concentrations of presynaptic proteins in the cingulate cortex of subjects with schizophrenia". Archives of General Psychiatry 54: 559–566. PMID 9193197.
- ↑ MacDonald, Chris (3 de abril de 2009). "Autoinhibition of SNARE complex assembly by a conformational switch represents a conserved feature of syntaxins". Biochemical Society Transactions 38: 209–212. doi:10.1042/BST0380209.
- ↑ Teng, Felicia Yu Hsuan (24 de outubro de 2001). "The Syntaxin". Genome Biology 2 (11): reviews 3012.1-reviews3012.7.
- ↑ Mishima, Tatsuya (28 de febreiro de 2014). "Syntaxin 1B, but Not Syntaxin 1A, Is Necessary for the Regulation of Synaptic Vesicle Exocytosis and of the Readily Releasable Pool at Central Synapses". PLoS ONE 9 (2). doi:10.1371/journal.pone.0090004.
- ↑ 31,0 31,1 Peng L, Liu H, Ruan H, Tepp WH, Stoothoff WH, Brown RH, Johnson EA, Yao WD, Zhang SC, Dong M (12 de febreiro de 2013). "Cytotoxicity of botulinum neurotoxins reveals a direct role of syntaxin 1 and SNAP-25 in neuron survival". Nature Communications 4: 1472. PMID 23403573. doi:10.1038/ncomms2462.
- ↑ 32,0 32,1 Rossetto O, Pirazzini M, Bolognese P, Rigoni M, Montecucco C (decembro de 2011). "An update on the mechanism of action of tetanus and botulinum neurotoxins" (PDF). Acta Chim Slov 58 (4): 702–7. PMID 24061118. Arquivado dende o orixinal (PDF) o 12 de agosto de 2012. Consultado o 08 de agosto de 2015.
- ↑ Barr JR, Moura H, Boyer AE, Woolfitt AR, Kalb SR, Pavlopoulos A, McWilliams LG, Schmidt JG, Martinez RA, Ashley DL (2005). "Botulinum neurotoxin detection and differentiation by mass spectrometry". Emerging Infect. Dis. 11 (10): 1578–83. PMC 3366733. PMID 16318699. doi:10.3201/eid1110.041279.
- ↑ Pirazzini M, Bordin F, Rossetto O, Shone CC, Binz T, Montecucco C (xaneiro de 2013). "The thioredoxin reductase-thioredoxin system is involved in the entry of tetanus and botulinum neurotoxins in the cytosol of nerve terminals". FEBS Letters 587 (2): 150–155. PMID 23178719. doi:10.1016/j.febslet.2012.11.007.
- ↑ Silvaggi NR, Wilson D, Tzipori S, Allen KN (maio de 2008). "Catalytic Features of the Botulinum Neurotoxin A light chain Revealed by High Resolution Structure of an Inhibitory Peptide Complex". Biochemistry 47 (21): 5736–5745. PMID 18457419. doi:10.1021/bi8001067.
- ↑ Wheeler AH (1998). "Botulinum toxin A, adjunctive therapy for refractory headaches associated with pericranial muscle tension". Headache 38 (6): 468–71. PMID 9664753. doi:10.1046/j.1526-4610.1998.3806468.x.
- ↑ Garcia A, Fulton JE (1996). "Cosmetic denervation of the muscles of facial expression with botulinum toxin. A dose-response study". Dermatol Surg 22 (1): 39–43. PMID 8556256. doi:10.1111/j.1524-4725.1996.tb00569.x.
- ↑ 38,0 38,1 Schiavo G, Benfenati F, Poulain B, Rossetto O, Polverino de Laureto P, DasGupta BR, Montecucco C (29 de outubro de 1992). "Tetanus and botulinum-B neurotoxins block neurotransmitter release by proteolytic cleavage of synaptobrevin.". Nature 359 (6398): 832–5. PMID 1331807. doi:10.1038/359832a0.
- ↑ Schiavo G, Poulain B, Rossetto O, Benfenati F, Tauc L, Montecucco C (outubro de 1992). "Tetanus toxin is a zinc protein and its inhibition of neurotransmitter release and protease activity depend on zinc.". The EMBO journal 11 (10): 3577–83. PMID 1396558.
- ↑ Pirazzini M, Bordin F, Rossetto O, Shone CC, Binz T, Montecucco C (2013). "The thioredoxin reductase-thioredoxin system is involved in the entry of tetanus and botulinum neurotoxins in the cytosol of nerve terminals". FEBS Lett. 587 (2): 150–5. PMID 23178719. doi:10.1016/j.febslet.2012.11.007.
- ↑ Pellegrini LL, O'Connor V, Lottspeich F, Betz H (2 de outubro de 1995). "Clostridial neurotoxins compromise the stability of a low energy SNARE complex mediating NSF activation of synaptic vesicle fusion.". The EMBO journal 14 (19): 4705–13. PMID 7588600.
- ↑ Shi L, Kümmel D, Coleman J, Melia TJ, Giraudo CG (novembro de 2011). "Dual roles of Munc18-1 rely on distinct binding modes of the central cavity with Stx1A and SNARE complex.". Molecular biology of the cell 22 (21): 4150–60. PMID 21900493. doi:10.1091/mbc.e11-02-0150.
- ↑ 43,0 43,1 Ramakrishnan NA, Drescher MJ, Drescher DG (maio de 2012). "The SNARE complex in neuronal and sensory cells.". Molecular and cellular neurosciences 50 (1): 58–69. PMID 22498053. doi:10.1016/j.mcn.2012.03.009.
- ↑ 44,0 44,1 Moreau K, Ravikumar B, Renna M, Puri C, Rubinsztein DC (xullo de 2011). "Autophagosome Precursor Maturation Requires Homotypic Fusion". Cell 146 (2): 303–317. PMID 21784250. doi:10.1016/j.cell.2011.06.023.
- ↑ Ravikumar B, Moreau K, Jahreiss L, Puri C, Rubinsztein DC (18 de xullo de 2010). "Plasma membrane contributes to the formation of pre-autophagosomal structures". Nature Cell Biology 12 (8): 747–757. PMID 20639872. doi:10.1038/ncb2078.
- ↑ 46,0 46,1 Nair U, Jotwani A, Geng J, Gammoh N, Richerson D, Yen WL, Griffith J, Nag S, Wang K, Moss T, Baba M, McNew JA, Jiang X, Reggiori F, Melia TJ, Klionsky DJ (xullo de 2011). "SNARE Proteins Are Required for Macroautophagy". Cell 146 (2): 290–302. PMID 21784249. doi:10.1016/j.cell.2011.06.022.
- ↑ Fraldi A, Annunziata F, Lombardi A, Kaiser HJ, Medina DL, Spampanato C, Fedele AO, Polishchuk R, Sorrentino NC, Simons K, Ballabio A (24 de setembro de 2010). "Lysosomal fusion and SNARE function are impaired by cholesterol accumulation in lysosomal storage disorders". The EMBO Journal 29 (21): 3607–3620. PMID 20871593. doi:10.1038/emboj.2010.237.
- ↑ 48,0 48,1 Itakura E, Kishi-Itakura C, Mizushima N (decembro de 2012). "The Hairpin-type Tail-Anchored SNARE Syntaxin 17 Targets to Autophagosomes for Fusion with Endosomes/Lysosomes". Cell 151 (6): 1256–1269. PMID 23217709. doi:10.1016/j.cell.2012.11.001.
Véxase tamén[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- SNARE Proteins Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- SNARE Complex Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
